食管鳞状细胞癌组织中uPA和PAI-1表达与浸润转移及预后的关系研究
朱丽娟, 陈 晓, 蒲红伟, 李晓梅
(新疆医科大学1基础医学院病理学教研室, 乌鲁木齐 830011, 2临床医学研究院, 乌鲁木齐 830054, 3高职学院, 乌鲁木齐 830011)
食管鳞状细胞癌(ESCC)是世界上常见的消化系统恶性肿瘤之一, 在我国每年大约有24万食管癌新发病例[1], 据统计其5年生存率为3.5%~13.9%[2]。在新疆,食管癌死亡率为13.05/10万, 其中哈萨克族(哈族)死亡率为68.88/10万, 严重威胁着人们的健康[3]。自1976年有研究报道尿激酶型纤溶酶原激活物(uPA)存在于人卵巢肿瘤细胞中以来,uPA与肿瘤浸润转移的关系逐渐受到人们的关注,其广泛存在于人体多种肿瘤组织细胞中,在恶性肿瘤组织中的表达水平高于其相应的正常组织[4-5]。uPA系统可能通过多种途径对消化道肿瘤的血管生成、侵袭转移等进行调节,与单核细胞激活抗原、基质金属蛋白酶的产生有关[6]。纤溶酶原激活物抑制剂I(PAI-1)是一种糖蛋白,表达在各种各样的细胞类型中如血管内皮细胞、上皮细胞、单核细胞、星形胶质细胞中[7-8],与正常细胞和凋亡细胞间的作用有所差别,能调节后者的吞噬作用,作为有效的特异性uPA抑制剂,参与uPA/uPAR/PAI-1复合物形成,阻止细胞外基质(ECM)的过分降解,从而具有抑制肿瘤转移的作用[9]。本研究应用免疫组织化学技术联合检测uPA和PAI-1在80例ESCC中的表达水平,旨在探讨两者表达与食管癌临床病理特征和患者预后的关系,现报道如下。
1 材料与方法
1.1材料选取1997-2004年新疆医科大学第一附属医院手术切除并经病理证实的ESCC标本80例,其中哈萨克族40例,汉族40例,男性57例,女性23例,年龄46~77岁,平均60岁。所有病例术前未经任何放疗和化疗。按照WHO分类标准进行病理分级:中高分化46例,低分化34例。无淋巴结转移53例,有淋巴结转移27例。同时选取20例食管癌旁正常组织作为对照。标本均经10%甲醛固定,常规石蜡包埋,3 μm厚度,连续切片4张。uPA鼠抗人单克隆抗体(浓缩型)购自美国Santa Cruz公司、鼠抗PAI-1单克隆抗体购自美国Abcam公司,SP免疫组化试剂盒、抗体稀释液、DAB显色试剂盒购自北京中杉公司。
1.2方法采用免疫组织化学Envision二步法检测各组织中蛋白的表达。步骤如下:石蜡切片逐级脱蜡、水化至水,用30 mL/L H2O2室温下孵育20 min(封闭内源性过氧化物酶),PBS漂洗。将切片置于pH 6.0的枸橼酸盐缓冲液中,微波炉加热修复抗原20 min(温度控制在95℃~100℃),取出自然冷却至室温后,用PBS漂洗。滴加一抗,置于湿盒内,4℃冰箱过夜。同法冲洗切片,DAB显色,置于湿盒中,自来水终止显色反应,切片苏木素复染,盐酸酒精分化返蓝,脱水封片。
1.3结果观察uPA、PAI-1以胞浆内出现棕黄色或棕褐色颗粒颗粒为阳性染色细胞。在400倍视野下每张切片随机观察5个视野,阳性细胞<5%为阴性,>5%为阳性[10]。
1.4统计学处理采用SPSS17.0软件包进行统计学处理,进行Kaplan-Meier生存分析、Cox回归模型,以P<0.05为差异有统计学意义。
2 结果
2.1uPA、PAI-1在食管鳞状细胞癌组织和正常食管组织中的表达uPA在食管癌组织和正常黏膜组织中阳性表达率分别为75.0%和45.0%,PAI-1在食管癌组织和正常黏膜组织中阳性表达率分别为75.0%和10.0%,在食管癌组织中uPA、PAI-1蛋白表达显著高于食管正常黏膜组织,差异均有统计学意义(P<0.05),见表1。

表1 uPA蛋白及PAI-1蛋白在食管癌组织和正常食管组织表达结果/例(%)
2.2uPA、PAI-1与临床病理参数之间的关系uPA、有淋巴结转移组PAI-1蛋白表达低于无淋巴结转移组,差异有统计学意义(P<0.01);随着浸润深度的增加, uPA、PAI-1蛋白表达阳性率也逐渐增高,肌层和浆膜层两比较差异有统计学意义(P<0.05)。在不同的肿瘤大小组中的表达差异无统计学意义(P>0.05);汉族和哈萨克族患者uPA的表达的差异无统计学意义(P>0.05)。
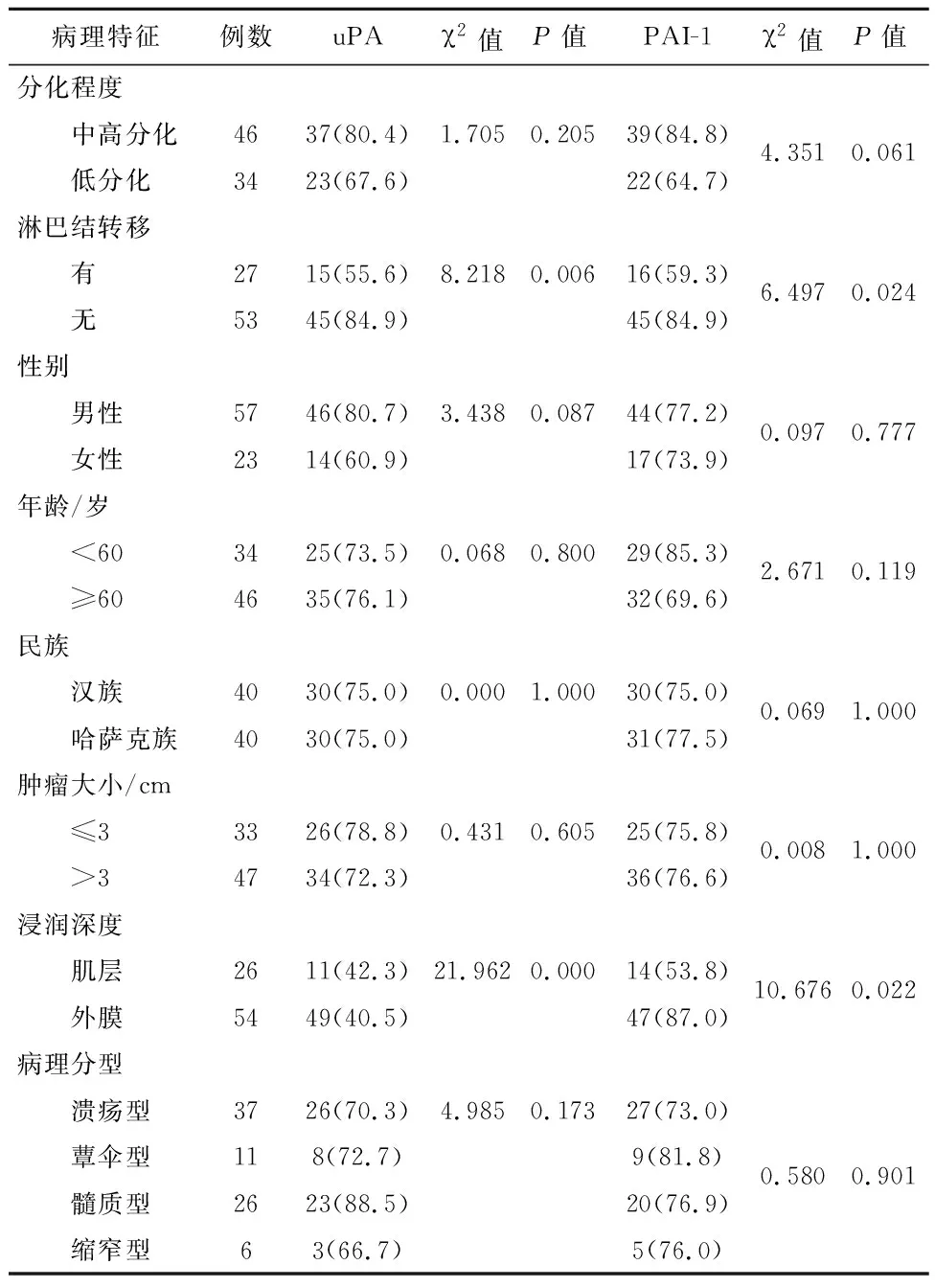
表2 uPA蛋白及PAI-1蛋白与临床病理参数之间的关系/例(%)
2.3uPA和PAI-1的表达相关性PAI-1和uPA 表达均为阴性为23例,PAI-1和uPA 表达均为阳性的为28例,PAI-1阳性和uPA阴性5例,PAI-1阴性和PAI-1阳性27例。uPA和PAI-1的表达呈正相关(r=7.092,P<0.05),见表3。
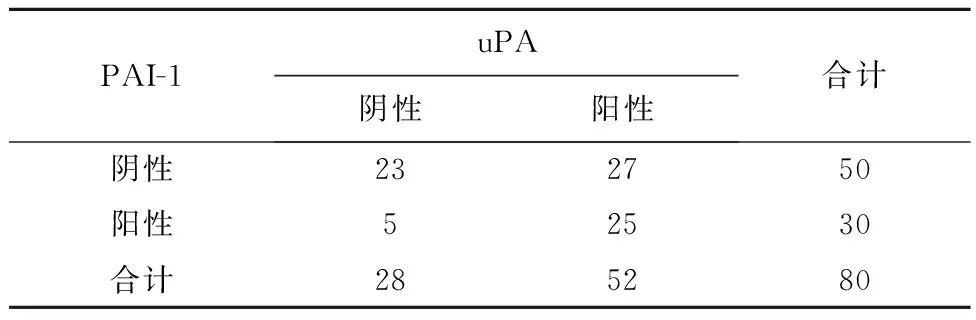
表3 uPA和PAI-1表达的相关性/例
2.4单因素Kaplan-Meier生存分析80例ESCC患者中16例存活,中位生存期为60个月(生存期6~80个月),10年生存率为20%(16/80)。阳性表达组平均生存时间和中位生存时间均高于阴性表达组,但差异无统计学意义(图1、2)。
2.5多因素分析以患者年龄、性别、肿瘤浸润深度、淋巴结转移、分化程度、病变长度、病理类型以及食管癌中uPA和PAI-1蛋白的表达为变量,进行Cox多因素回归分析。结果显示,独立的预后因素为患者肿瘤浸润深度和转移(表4)。
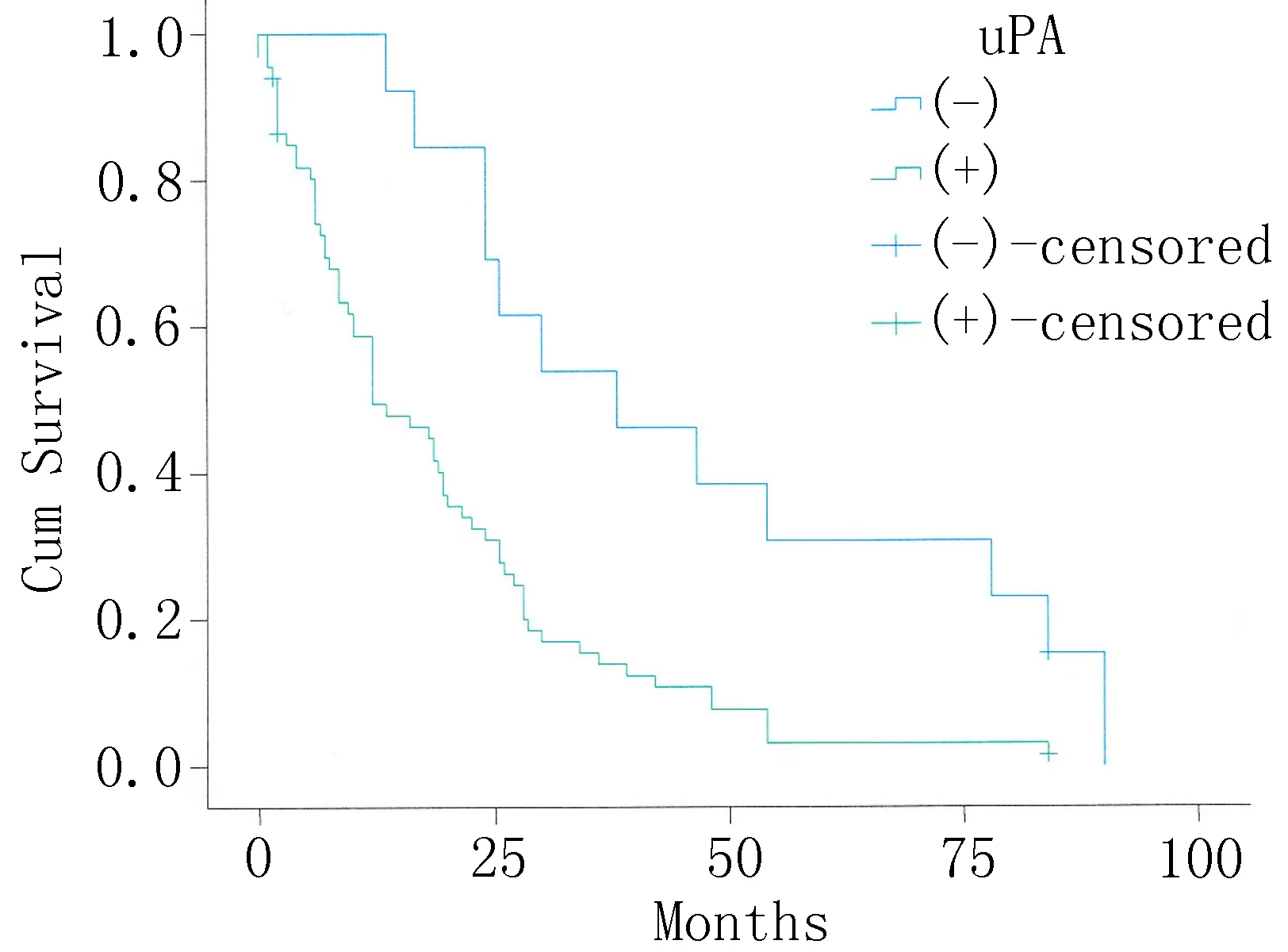
图1 uPA表达阴性和阳性表达组生存曲线
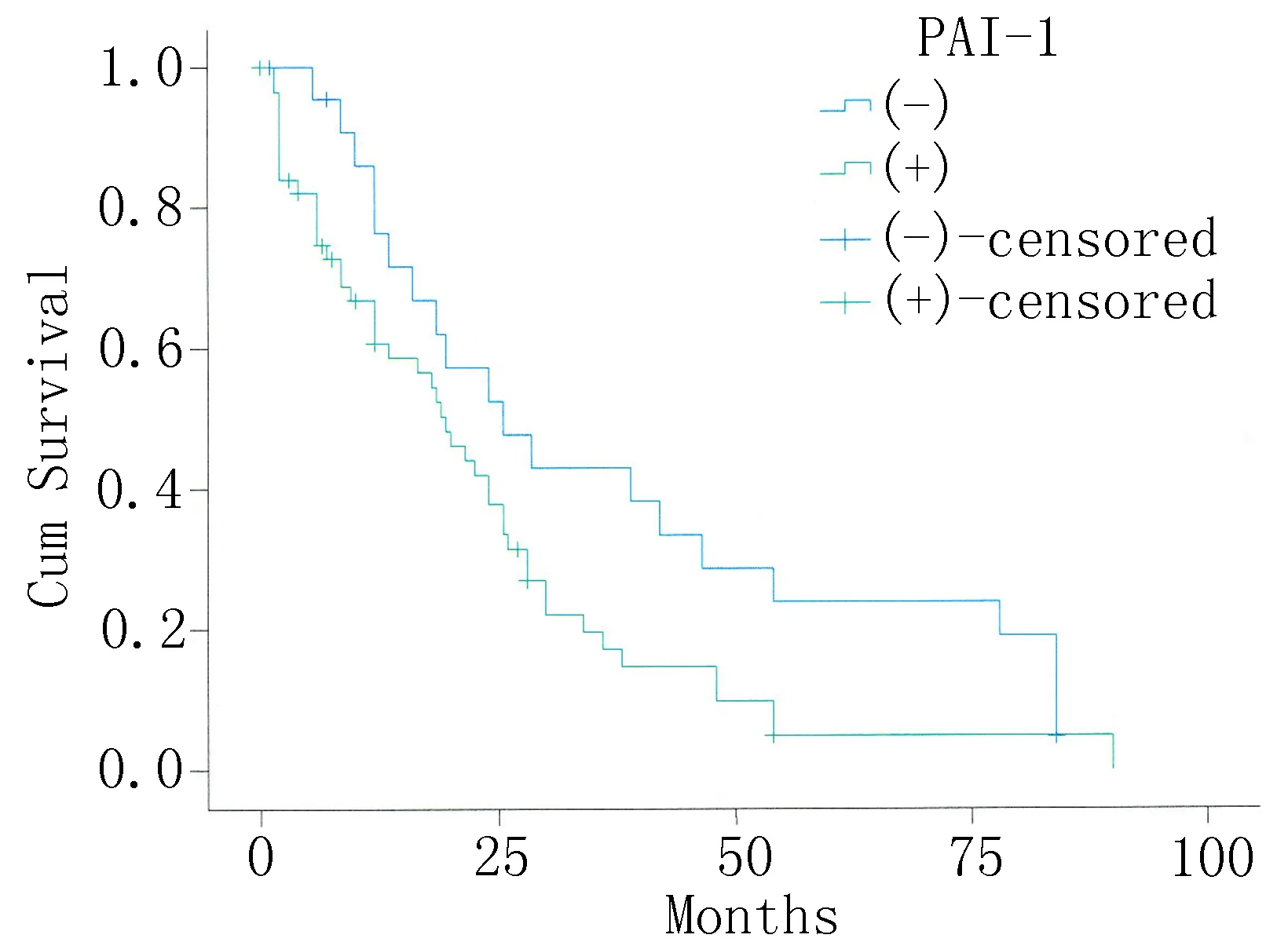
图2 PAI-1表达阴性和阳性表达组生存曲线

表4 食管癌预后的Cox模型多因素分析
3 讨论
Gosciski等[11]研究发现食管鳞癌远处转移者,uPA阳性表达率明显高于无远处转移患者,uPA表达阳性越高的食管鳞癌患者肿瘤侵袭力越强,且与肿瘤生长方式、浸润深浅、淋巴转移呈正相关,提出uPA可能参与食管鳞癌的发生与发展,参与肿瘤组织血管形成,利于肿瘤细胞转移。韩艳春等[12]对乳腺浸润性导管癌组织中uPA表达的研究发现,uPA 在乳腺癌组织中的表达明显高于正常组织,与乳腺癌的TNM 分期及淋巴结转移关系密切。本研究显示,uPA蛋白表达与食管鳞癌组织淋巴结转移、浸润深度相关,但与分化程度、病理分型等关系不明显,证实了uPA蛋白表达与肿瘤的浸润、转移密切相关,对于肿瘤发展起重要作用。
钱璞等[13]发现胰腺癌患者血浆PAI-l浓度与TNM分期有关,Ⅳ期高于Ⅲ期,可能与胰腺癌病情发展晚期,PAI-l降解细胞外基质加速和PAI-l浓度过高有关。姜琳等[14]研究发现胰腺癌组织中PAI-l的表达明显高于正常胰腺组织中的表达水平,与胰腺癌的临床TNM分期及淋巴结转移密切相关, 而与肿瘤大小、病理分化等均无关,这些与肿瘤细胞产生细胞因子等物质促进肿瘤血管生成、基质浸润、肿瘤细胞脱落、淋巴转移等过程导致肿瘤侵袭转移有关。本研究中,PAI-1蛋白表达与淋巴结转移、浸润深度有关,提示PAI-1蛋白表达与食管癌的发展有一定关系。
Borstnar等[15]研究发现,uPA及PAI-1的血液浓度越高,对抗癌药越敏感,认为可作为化疗疗效指标。提示uPA及PAI-1有可能成为肿瘤治疗的靶点。孟丽等[16]研究发现在子宫内膜癌组织中uPA与PAI-1表达水平及uPA与PAI-1血清值均显著高于子宫内膜增生组及正常子宫内膜组织,并且其与子宫内膜癌手术病理分期、组织学分级及其浸润转移、疾病进展及预后有关。本研究结果表明uPA、PAI-1蛋白表达呈正相关,其在食管癌的侵袭转移中可能具有协调作用。这可能与PAI-1对uPA的直接抑制作用无关,具体的机制尚待进一步研究。通过Kaplan-Meier生存分析显示,PAI-1阳性表达组与阴性表达组相比,后者5年生存率较前者高,但差异无统计学意义(P>0.05),进一步做Cox多因素回归分析,结果uPA、PAI-1与肿瘤浸润深度、淋巴结转移有一定的关系,不能独立影响食管鳞癌预后,与实验结果不一致,值得进一步研究。
参考文献:
[1] 陈建国,陆建华.国内外癌症防治现状[J].肿瘤,2007,27(9):755-759.
[2] 陈建国,朱健,张永辉.启东市1972-2000年主要恶性肿瘤生存分析[J].中国肿瘤, 2006,15(9):575-578.
[3] 吕秀平,蒲红伟,龚晓瑾,等.MALDI-TOF-MS分析新疆食管鳞状细胞癌的蛋白组学[J].世界华人消化杂志,2011,19(36):3682-3686.
[4] Witzel ID, Midel-Langosch K, Witzl RM, et al. Comparison of microarray based RNA expression with ELISA-based protein determinination of HER-2 uPA and PAI-1 in tumor tissue of patients with breast cancer and relation to outcome [J]. J Cancer Ras Clin Oncol, 2010, 36 (11):1709-1718.
[5] Yong HY, Kim, IY, Kim JS, et al. ErbB2-enhanced invasiveness of H-Ras MCF 10A breast cells requires MMP13 and uPA up-regulation Via p38 MAPK signaling[J]. Int Oncol,2010, 36(2):501-507.
[6] Salas AL, Montezuma TD, Farina GG, et al. Genistein modifies liver fibrosis and improves liver function by inducing uPA expression and proteolytic activity in CCL4-treated rats[J]. Pharmacology, 2008, 81(1):41-49.
[7] Ha H, Oh EY, Lee HB, et al. The role of plasminogen activator inhibitor 1 in renal and cardiovascular diseases [J]. Nat Rev Nephrol,2009, 5(2):203-211.
[8] Hultman K, Blomstrand F, Nilsson M,et al. Expression of plasminogen activator inhibitor-1 and protease nexin-1 in human astrocytes:response to injury-related factors[J]. J Neurosci Res, 2010, 88(11):2441-2449.
[9] Hyejin J, Jong-Heon K, Jae-Hong K, et al. Plasminogen activator inhibitor type 1 regulates microglial motility and phogacytic activity[J]. J Neuroinflammat, 2012, 9(1):149-156.
[10] 马红,陈 晓,马海梅,等.E-cadherin 和B-catenin 在食管鳞状细胞癌中的表达及其意义[J].新疆医科大学学报,2008,31(5):534-536.
[11] Goscinski MA, Suo ZH, Nesland JM, et al. Dipeptidyl peptidase IV expression in cancer and stromal cells of human esophageal squamous cell carcinomas, adenocarcinomas and squamous cell carcinoma cell lines[J].APMIS, 2008, 116(9):823-831.
[12] 韩艳春,刘鲁英,王霞,等.乳腺癌组织中VEGF-C和uPA的表达及意义[J].临床与实验病理学杂志,2010,26(3):296-299.
[13] 钱璞,卢志贤,杨春香.胰腺癌患者血浆PAI-1测定的临床意义[J].放射免疫学杂志,2012,25(5):559-560.
[14] 姜琳,孙灿林,李慧,等.胰腺癌组织中Smad7、uPA及PAI-1的表达及临床意义[J].江苏大学学报:医学版,2010,20(6):527-531.
[15] Bofstnar S,Sadikov A,Mozina B, et al. High levels of uPA and PAI-1 predict a good response to anthracyelines [J].Breast Cancer Res Treat, 2010, 121(3):615-624.
[16] 孟丽,山峰,刘相萍,等.子宫内膜癌组织uPA和PAI-1 mRNA表达及其意义[J].青岛大学医学院学报,2008,44(3):241-243.

