链霉菌菌株F-1的鉴定及其对水稻纹枯病防效的初步测定
王岩,李国庆
1.临沂大学地质古生物研究所,山东临沂276000 2.华中农业大学植物科技学院,湖北武汉430070
链霉菌菌株F-1的鉴定及其对水稻纹枯病防效的初步测定
王岩1,2,李国庆2*
1.临沂大学地质古生物研究所,山东临沂276000 2.华中农业大学植物科技学院,湖北武汉430070
采用形态特征观察及16S rDNA序列分析等方法,对分离自健康水稻植株的内生链霉菌菌株F-1进行了鉴定;采用对峙培养试验测定了菌株F-1对水稻纹枯病菌(Rhizoctonia solani)的拮抗作用,在离体水稻叶片和活体水稻植株上,测定了菌株F-1代谢产物对水稻纹枯病的防治效果。结果表明:菌株F-1与普特拉链霉菌(Streptomyces platensi)亲缘关系最近,同源性达100%,且形态与培养特征、生理生化特性与普特拉链霉菌相符,故将其命名为普特拉链霉菌(Streptomyces platensi)F-1;其对水稻纹枯病菌有显著的拮抗作用,其代谢产物导致水稻纹枯病菌顶端菌丝弯曲,菌丝体皱缩畸形;在离体叶片和活体水稻植株上,菌株F-1的培养物滤液能够有效防治水稻纹枯病。普特拉链霉菌菌株F-1对水稻纹枯病具有较好的生防潜力。
普特拉链霉菌菌株F-1;鉴定;水稻纹枯病;生物防治
由茄丝核菌(Rhizoctonia solani Kühn)引起的水稻纹枯病是世界范围内分布最为广泛的水稻病害之一,一般可减产10~30%,严重时减产幅度可达50%[1]。在控制水稻纹枯病为害的多种防治方法中,利用有益微生物进行生物防治是一种经济有效,且无副作用的防治方法。利用拮抗微生物防治水稻纹枯病,报道较多的是利用拮抗真菌和拮抗细菌。对水稻纹枯病生物防治研究最多的是拮抗细菌[2]。链霉菌是存在于土壤当中的一类重要的微生物类群,其可以产生丰富的次生代谢产物,是重要的天然抗生素来源,一些链霉菌代谢产生的抗生素类的次生代谢产物可以有效抑制水稻纹枯病的发生[3~4]。目前,利用分离自水稻植株的链霉菌对水稻纹枯病进行防效潜力测定,并对其进行种类鉴定,尚未见报道。链霉菌菌株F-1(StreptomycesplatensisF-1)是分离自湖北武汉地区水稻植株上的一株拮抗链霉菌,其水稻纹枯病菌等多种病原真菌均有较强的拮抗作用。本研究对链霉菌菌株F-1进行了种类鉴定,在离体水稻叶片和盆栽水稻植株上初步测定其代谢产物对水稻纹枯病的防治效果,探讨其对水稻纹枯病的防病机制,评价其生防应用潜力。
1 材料与方法
1.1 菌株来源
链霉菌菌株F-1分离于湖北武汉地区健康水稻植株,由华中农业大学植病生防实验室保存。
1.2 种类鉴定
1.2.1 形态观察用葡萄糖马铃薯琼脂埋片培养,28℃下分别培养7,14,21,28 d后,光学显微镜观察基内菌丝、气生菌丝和孢子丝形态,扫描电子显微镜观察培养7 d时的形态特征。
1.2.2 培养性状将试验菌株用接种环画线接种于葡萄糖马铃薯琼脂、高氏合成一号、酵母浸出物麦芽糖琼脂、燕麦琼脂、无机盐淀粉琼脂、甘油天冬氨酸琼脂、察氏蔗糖琼脂、葡萄糖酪氨酸琼脂、葡萄糖马铃薯琼脂等各测定培养基,28℃光照培养,3~14 d分别观察记录菌株生长情况,对照《链霉菌鉴定手册》[5]记录气生菌丝、基内菌丝和可溶性色素的颜色变化。
1.2.3 生理生化特征将试验菌株画线接种于PDA培养基,分别在5~45℃(每5℃设一梯度)暗光培养,7 d后,观察记录其生长情况。参考《链霉菌鉴定手册》测定淀粉水解、纤维素利用、明胶液化、牛奶凝固与胨化、H2S产生、碳源利用等生理生化特征。
1.2.4 16S rDNA序列分析总DNA的提取按CTAB法,PCR扩增产物使用以下引物:Primer A:5′-AGAGTTTGATCCTGGCTCAG-3′;PrimerB:5′-AAGGAGGTGATCCAGCCGCA-3′。PCR反应体系(总体积50 μL):10×Buffer5.0 μL,dNTP(2 mmol/L)4.0 μL,Primer A(10 pmol/L)1.0 μL,PrimerB(10 pmol/L)1.0 μL,Taq酶(2 U/μL)0.4 μL,DNA模板(50 ng~1 μg)1.0 μL,去离子水37.4 μL反应条件:95℃5 min;95℃1 min,55℃1 min,72℃3 min,35个循环;72℃5 min。PCR产物用1.0%琼脂糖凝胶电泳检测。PCR回收纯化后的产物送北京奥科生物技术有限公司测序。
1.3 抗生作用
1.3.1 对峙培养试验用接种环蘸取培养好的菌株F-1孢子,划线接种于PDA平板两侧,28℃光照培养3 d,平板中央接种水稻纹枯菌菌丝琼脂块。28℃培养24 h,观察在菌株F-1菌落和纹枯菌菌落之间产生的抑菌带。分别挑取受抑制的纹枯菌顶端菌丝和对照纹枯菌顶端菌丝,乳酚棉兰染色,光学显微镜下观察菌丝特征。
1.3.2 菌株F-1液体培养滤液对水稻纹枯菌的抑制效果从菌株F-1菌落表面洗下孢子(孢子浓度为107个孢子/mL),按0.1%(V/V)的比例将菌株F-1孢子液接种至PDB液体培养液中,28℃振荡培养(200 r/min)3 d后离心(10000 r/min,10 min),上清液用细菌过滤器过滤,得到含有抗真菌物质的链霉菌菌株F-1 PDB培养滤液,记为AFSPDB。将制备AFSPDB按10%比例(V/V)与PDA混合倒平板,冷却后中央接种直径6 mm水稻纹枯菌菌丝块,28℃光照培养24 h,以加无菌水处理为对照。将处理组和对照组的纹枯菌顶端菌丝乳酚棉兰染色,光学显微镜观察菌丝状况。在含有10%比例AFSPDB的PDA平板上铺一层无菌玻璃纸,接种纹枯菌,28℃培养24 h,将附有顶端菌丝的玻璃纸剪成长宽各4 mm的小片,电镜扫描观察菌丝形态。以加无菌水处理为对照。
1.4 防效测定
1.4.1 离体叶片防效试验盆栽水稻生长约40 d(水稻品种汕优63,为水稻纹枯病感病品种),采集生理部位一致的健康水稻叶片,冲洗干净,放入加有0.5%土温20的自来水中润湿叶表,剪取相同生理部位长约6 cm的水稻叶片,用AFSPDB均匀润湿水稻叶片表面,放入无菌的培养皿(3片/皿),在同一端接种纹枯菌菌丝块(直径6 mm),28℃光照保湿培养,并于第1~6 d按0~4级标准(0级:叶片健康无症状;1级:1%~25%叶片发病;2级:26%~50%叶片发病;3级:51%~75%叶片发病;4级:76%以上叶片黄化,水渍状枯黄)记录各叶片纹枯病病害严重度。设6个重复,以无菌水处理做对照。
1.4.2 盆栽防效试验选取新鲜、粗细均匀的水稻秸秆,剪成6 cm的小段放至三角瓶中,高压灭菌后接种新鲜的水稻纹枯菌菌丝块,28℃光照培养至水稻秸秆表面长满水稻纹枯菌备用。盆栽水稻生长至第50 d时,将含有0.05%土温20的AFSPDB均匀喷施到水稻植株上,分别以5%的井冈霉素乳油和无菌水处理为对照,每组处理设3个重复。室温下水稻表面晾干后,在每簇水稻植株基部接种1根长有纹枯菌的稻秆,用半透明塑料袋罩住盆栽水稻的底部,留出中上部,温室培养15 d后,按照0~9级标准记录每株水稻的病害严重度(0级:健康无病害;1级:病斑面积小于叶鞘面积的1/4;3级:病斑面积小于叶鞘面积的1/2;5级:病斑面积大于叶鞘面积的1/2,水稻基部叶片(倒数第3、第4叶);7级:病斑面积大于叶鞘面积的3/4,顶部叶片受到严重侵染;9级:病斑到达植株顶部,所有叶片被严重侵染,有些植株枯死[18])。按以下公式计算水稻株发病率、病情指数和防病效果:
水稻株发病率=发病总株数/接种总株数×100%
病情指数=∑(各级发病株数×病级值)/(总株数×最高病级值)×100
防治效果=(对照病情指数-处理病情指数)/对照病情指数×100%
2 结果
2.1 种类鉴定
2.1.1 形态特征菌株F-1在葡萄糖马铃薯琼脂培养基上培养一周后,气生菌丝、基内菌丝均生长丰茂,无可溶性色素,孢子丝波曲或螺旋状,孢子呈卵圆形或短杆状,表面光滑,孢子直径约1 μm。菌丝弯曲较多分枝,无横膈膜,无断裂(图1)。
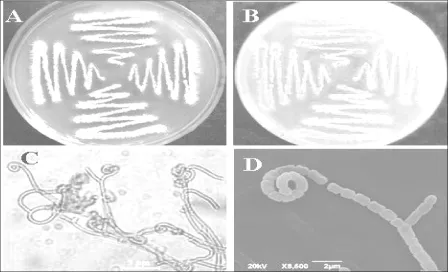
图1 链霉菌菌株F-1菌落、孢子丝及孢子形态特征(PDA,28℃,7 d)A.菌落正面B.菌落背面C.孢子丝D.孢子链及孢子(SEM)Fig.1 Morphology of colony and conidia spores of Streptomyces platensis F-1 A.Obverse of colony B.Inverse of colony C.Spore hypha D.Spore chain and single spore(SEM)
2.1.2 培养特征菌株F-1在多数培养基上气丝丰茂呈粉状,孢子多为灰白到灰色。在多数培养基上均不产生色素,仅在甘油天冬氨酸琼脂上7 d后渐有轻微色素产生(表1)。

表1 链霉菌菌株F-1不同培养基上的培养特征Table 1 Streptomyces F-1 cultural characteristics on different media
2.1.3 生理生化特征菌株F-1生长温度范围在10℃~40℃之间,最适宜生长的温度为28℃~35℃。菌株F-1可使淀粉水解,在纤维素上不生长,明胶液化微弱,牛奶胨化可凝固,不产生H2S。该菌较好利用葡萄糖、麦芽糖、果糖、肌醇,可利用乳糖、甘油、甘露醇,不利用蔗糖山梨醇。
2.1.4 16S rDNA序列分析链霉菌菌株F-1 16S rDNAPCR产物在约1500 bp位置有一条明显的电泳带。将测序所得的16S rDNA序列根据测序结果,先利用BLAST搜索软件从GenBank数据库中调出的相关放线菌菌株的16S rDNA序列,选取同属的10个菌株及类链霉菌属(Streptomycoides),异壁链霉菌属(Actinoalloteichus)放线菌属(Actinomyces)的16S rDNA做同源性分析,利用DNAMAN软件进行序列比对,并构建进化树。从16S rDNA序列为基础的聚类图可以看出,所选链霉菌属的14个种基本聚成4个主要的分支,放线菌属的一个菌株独自构成一支。待测链霉菌菌株F-1与Streptomyces platensis16S rDNA的同源性为100%,它们在聚类图上聚在一起的置信度达到100%(图2)。
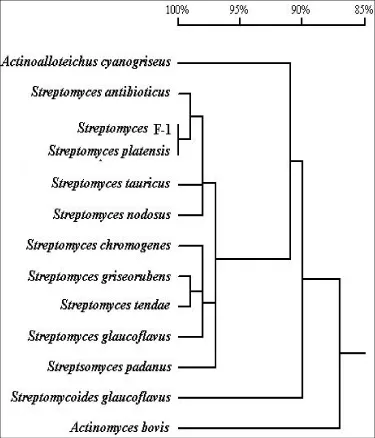
图2 链霉菌菌株F-1及相关菌株的16S rDNA系统发育树Fig.2 Phylogenetic tree showing the relationship between Streptomyces platensis F-1 and related species based on 16S rDNAsequences
综合形态特征、培养性状及生理生化性状,将链霉菌菌株F-1定名为普特拉链霉菌(Streptomyces platensis F-1),其16S rDNA序列已在GenBank数据库中注册,注册号为EF583557。
2.2 抗生作用
28℃培养24 h后,在F-1菌落和纹枯菌菌落之间形成明显的抑菌带,宽度为10~15 mm。显微观察,对照菌落的纹枯菌顶端菌丝生长笔直,呈直角分枝;与链霉菌菌株F-1对峙培养的纹枯菌菌丝顶端弯曲,有的菌丝膨大,分枝异常呈锐角,明显畸形,说明链霉菌菌株F-1代谢所产生的物质对水稻纹枯菌菌丝生长具有显著的抑制作用。在28℃下培养1 d后,加无菌水的对照组纹枯菌几乎长满平板,其顶端菌丝生长旺盛,呈直角分支。加AFSPDB处理组的纹枯菌生长受到抑制,菌落变厚,边缘菌丝出现肿大、弯曲、分支增多等异常形态(图3)。电镜扫描显示:对照组纹枯菌菌丝生长均匀,伸展自然,菌丝体饱满光滑,分支成典型的直角;与之相反,AFSPDB处理的纹枯菌菌丝不规则扭曲,菌丝体干瘪皱缩,表面粗糙,分支较多(图4)。
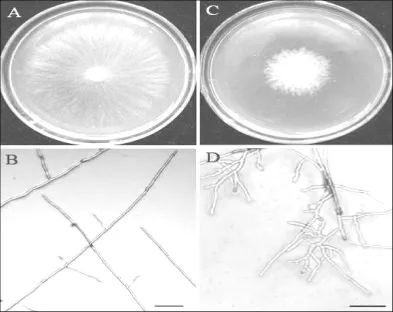
图3 链霉菌菌株F-1液体培养滤液(AFSPDB)对水稻纹枯菌菌丝生长抑制作用A.对照水稻纹枯菌菌落形态B.对照水稻纹枯菌菌丝顶端菌丝显微形态C.AFSPDB处理的水稻纹枯菌菌落形态D.AFSPDB处理的水稻纹枯菌菌菌丝顶端显微形态标尺=100 μmFig.3 Effect of cultural filtrate of Streptomyces sp.F-1 on mycelial growth of Rhizoctonia solani A.R.solani culture treated with sterile distilled water B.Hyphal tips of R.solani from culture treated with sterile distilled water C.R.solani culture treated with AFSPDBand D.Hyphal tips R.solani from culture treated with AFSPDBBars=100 μm

图4 链霉菌菌株F-1液体培养物滤液对水稻纹枯菌菌丝抑制作用的扫描电子显微镜观察A.对照水稻纹枯菌菌丝形态B.AFSPDB处理的水稻纹枯菌菌丝形态Fig.4 SEM micrographs showing inhibitory effect of AFSPDBof Streptomyces sp.F-1 on Rhizoctonia solani A.Hyphal of R.solani from culture treated with sterile distilled waterB.Hyphal of R.solani from culture treated with AFSPDB
2.3 防效测定
2.3.1 离体叶片防效试验试验结果(表2)表明:链霉菌F-1 PDB培养物滤液对水稻纹枯病均有显著的防效(P<0.05)。例如,在接种培养第3 d时,无菌水对照处理组的水稻纹枯病严重度为2.2级,而链霉菌F-1 PDB培养物滤液处理组的水稻叶片病害等级为0.9,仅有零星病斑;第6 d时,无菌水处理的水稻叶片病害严重度接近4级,叶片黄化,溃烂,并且叶片上出现菌核,而链霉菌F-1 PDB培养物滤液处理组处理的水稻叶片病害严重度只有1.8级。
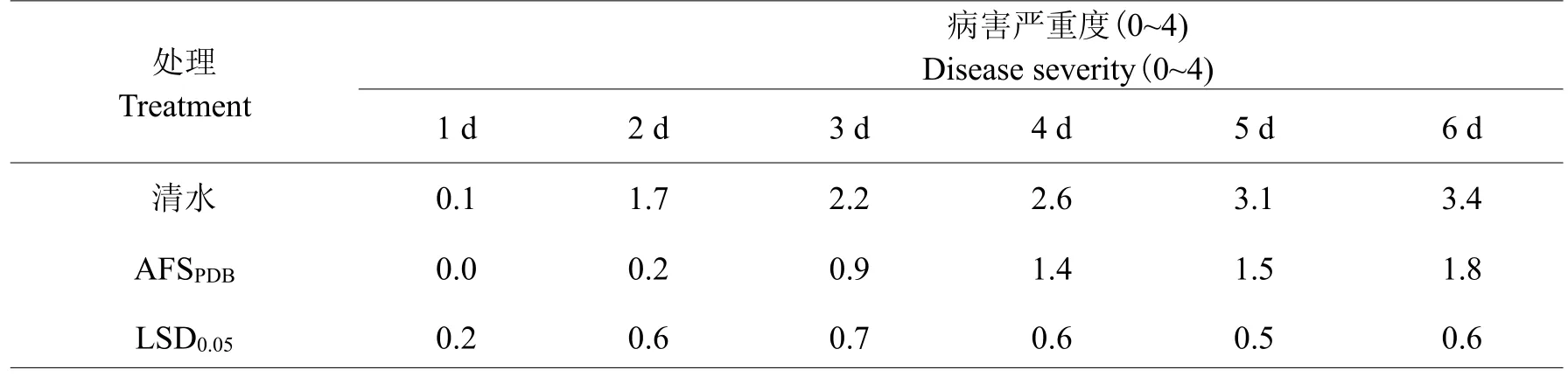
表2 链霉菌F-1培养物滤液(AFSPDB)对水稻纹枯病菌侵染的影响Table 2 Effect of the culture filtrate on infection of detached rice leaves by Rhizoctonia solani
2.3.2 盆栽防效试验接种培养15 d后(表3),对照组发病率达到100%,水稻植株发病严重,病害严重度达到6.1级,病情指数达到67.7%,在茎基部接种水稻纹枯菌的附近区域,形成1~2 cm长的不规则水渍状病斑,菌丝扩展到叶部,并引起叶部病斑并形成菌核。浓度为5%的井冈霉素乳油处理组,发病率为89.1,水稻病害严重度有所降低,为3.7级,病情指数为41.4。链霉菌菌株F-1液体培养滤液处理的水稻长势旺盛,病害严重度较井冈霉素阳性对照进一步降低,仅有少量发病,发病率为34.3%,病害严重度仅为0.4,病情指数为4.5,与井冈霉素处理及无菌水对照均差异显著(P<0.05)。
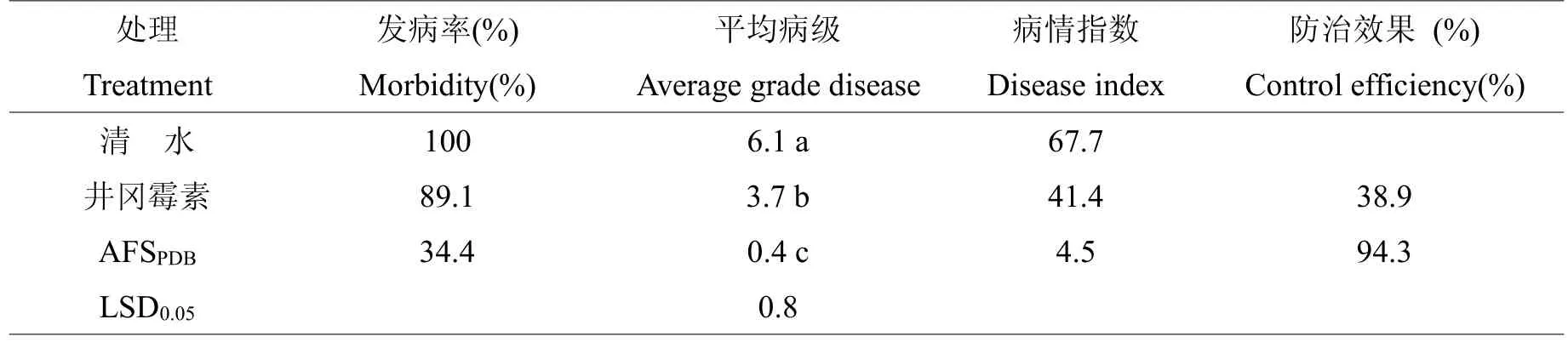
表3 链霉菌菌株F-1液体培养物滤液与井冈霉素对水稻纹枯病的防治效果Table 3 Efficacy of the antifungal substances of Streptomyces platensis.F-1 and Jinggangmycin in suppression of R. solani on rice plants
3 讨论与小结
本研究参照传统的链霉菌分类鉴别方法对拮抗链霉菌菌株F-1的形态学和生理生化反应进行了观察鉴定。对16S rDNA序列的比较分析可知,待测链霉菌菌株F-1与吸水链霉菌属普特拉种群具有高度同源性和置信度,说明它们具有很近在亲缘关系。因此,将菌株F-1定名为普特拉链霉菌菌株F-1(Streptomyces platensisF-1)。研究表明,普特拉链霉菌产生的次生代谢产物中,有一些对真菌具有拮抗性[7-9]。沈寅初及日本Som kyo发现的活性菌株,菌号为Streptomyces platensis SAN K6091,该菌株产生的抗生物质对多种植物病原菌有显著的抗菌活性[10]。本研究首次报道了分离自健康水稻植株的普特拉链霉菌对水稻纹枯菌有显著的拮抗作用。
链霉菌菌株F-1在PDA固体培养基及PDB液体培养基生长均可产生对水稻纹枯菌有拮抗作用的抗菌物质,显微观察结果表面,其对水稻纹枯菌的抑制效果相同,进而初步推测它们是相同的物质,这种物质可能有一种或几种具有抑菌活性的成份组成[11-12]。离体和盆栽试验结果表面,链霉菌菌株F-1孢子液及其液体培养物滤液均对水稻纹枯病有显著防效,具有成为水稻纹枯病生防因子的潜力,类似前人报道的链霉菌PM5[13],可提取其抗菌物质用于病害的防治。此外,链霉菌菌株F-1在液体和固体培养下均可产生挥发性物质,尤其在固体培养时其产生挥发性物质对水稻纹枯菌所引起叶片纹枯,核盘菌(Sclerotinia.sclerotiorum)所引起的油菜叶枯和灰霉菌(Botrytis cinerea)引起的草莓灰霉病均有显著防效[14],进一步增强了其生防潜力及开发利用价值。
拮抗放线菌生物防治病害的途径主要有两种途径:一是寄生在植物组织体内,诱导植物自身产生抗病性或代谢出一些具有抑菌作用的活性物质(抗生素)影响病原菌的新陈代谢过程,从而达到防病治病的目的;二是在寄主体外利用[15]。本研究中,经链霉菌菌株F-1抗菌物质处理的水稻纹枯菌菌丝皱缩、干瘪,水稻纹枯菌菌丝体内容物外泄。Olivia研究发现,一些抗菌物质能引起某些离子从菌体内释放出来,从而引起细胞死亡[16]。离体拮抗试验中,链霉菌菌株F-1产生的抗菌物质对水稻纹枯菌不是完全抑制,而是减慢其生长,说明链霉菌菌株F-1产生的抗菌物质只是对水稻纹枯菌细胞产生毒害,或是引起细胞内物质外泄后,导致细胞生长活力衰退,致病能力下降,而没有将其杀死。根据以上结果初步推断,链霉菌菌株F-1的防病机制之一是其产生的抗菌物质使水稻纹枯菌菌丝顶端弯曲畸形,生长速度大幅度减慢,导致了其致病力下降。这一结论与Moreno报道相一致[17]。
本研究表明,分离自健康水稻植株的普特拉链霉菌菌株F-1对水稻纹枯菌有较强拮抗性,其液体培养产生的抗菌物质在离体水稻叶片和盆栽水稻上均对水稻纹枯病具有显著防效,对水稻纹枯病具有很好的防治潜力。
[1]孟庆忠,刘志恒,王鹤影,等.水稻纹枯病研究进展[J].沈阳农业大学学报,2001,32(5):376-381
[2]刘薇,杨超,邹剑锋,等.水稻纹枯病生物防治研究进展[J].广西农业科学,2009,40(5):512-516
[3]Prabavathy V R,Mathivanan N,Murugesan K.Control of blast and sheath blight diseases of rice using antifungal metabolites produced by Streptomyces sp PM5[J].Biol Control,2006,39:313-319
[4]Rakotoniriana EF,Chataigné G,Raoelison G,et al.Characterization of an endophytic whorl-forming Streptomyces from Catharanthus roseus stemsproducing polyene macrolide antibiotic[J].Can J Microbiol,2012,58(5):617-627
[5]中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册[M].北京:科学出版社,1975
[6]IRRI.International Rice Research InstituteAnnual Report for 1979[R].Philippines:Los Banos,1980
[7]Igarashi Y,Ogawa M,Sato Y,et al.A novel inhibitor of the infection of Chinese cabbage by Alternaria brassicicola, from Streptomyces sp.TP-A0569[J].JAntibiotics,2000,53:1117-11122
[8]Brautaset T,Sletta H,Degnes KF,et al.New nystatin-related antifungal polyene macrolides with altered polyol region generated via biosynthetic engineering of Streptomyces noursei[J].Appl EnvironMicrobiol,2011,77(18):6636-6643
[9]SahaS,PriyadharshiniA,Dhanasekaran D,et al.Preclinical evaluation and molecular docking of 4-phenyl-1-Napthyl phenyl acetamide(4P1NPA)fromStreptomycessp.DPTB16 as a potent antifungal compound[J].Comput Biol Med,2012,42(5):542-547
[10]顾学斌,陶黎明,徐文平.磷氮霉素PN-2的分离鉴定及活性研究初报[J].农药学学报,2002,4(1):75-79
[11]Fguira L F B,Fotso S,Ameur-Mehdi R B,et al.Purification and structure elucidation of antifungal and antibacterial activities of newly isolated Streptomyces sp.strain US80[J].Res Microbiol,2005,156:341–347
[12]Hou X G,Boyetchko S M,Brkic M,et al.Characterization of the anti-fungal activity of a Bacillus spp.associated with sclerotia from Sclerotinia sclerotiorum[J].Appl Microbiol Biotechnol,2006,72:644–653
[13]Prabavathy V R,Mathivanan N,Murugesan K.Control of blast and sheath blight diseases of rice using antifungal metabolites produced by Streptomyces sp[J].PM5.Biol Control,2006,39:313-319
[14]Wan MG,Li G Q,Zhang JB,et al.Effect of volatile substances of Streptomycesplatensis F-1 on control of plant fungal diseases[J].Biological Control,2008,46(3):552-559
[15]宋光桃,周国英.拮抗链霉菌F10抗油茶炭疽病菌抑菌机理的研究[J].中南林业科技大学学报,2012,32(8):89-93
[16]Olivivia M,Maire P R,Colin H.Lacticin 3147 a broad-spectrum bacteriocin whicn selectively dissipates the membranc potential[J].Appl Eenvironmental Microbiolog,1998,64:439-445
[17]Moreno A B,Martínezdel P Á,Borja M,et al.Activity of the Antifungal Protein from Aspergillus giganteus Against Botrytiscinerea[J].Phytopathology,2003,93:1344-1353
Identification of Streptomyces platensi Strain F-1 and the Control Effect on Rice Sheath Blight
WANG Yan1,2,LI GUO-qing2*
1.Institute of Geology and Paleontology,Linyi University,Linyi 276000,China 2.College of Plant Science and Technology of Huazhong Agricultural University,Wuhan 430070,China
Strain F-1 was identified by morphological and cultural traits,physio-biochemical characteristics and 16S rDNA sequence analysis.Antagonistic interaction between strain F-1 and Rhizoctonia solani,was tested using the dual cultural method.Cultural filtrate of strain F-1 was determined for control of R.solani on in vitro rice leaves and on rice plants.The results showed that strain F-1 was most closely related to Streptomyces platensis(100%si milarity)by the 16S rDNA sequence analysis,the morphological and cultural traits,and physio-biochemical characte ristics of strain F-1 conformed with S.Platensis,so strain F-1 was affiliated to Streptomyces platensis F-1.It inhib ited growth of R.solani,resulting in hyphal malformation.Application of the culture filtrate of strain F-1 to rice d etached rice leaves and to potted rice plants reduced disease incidence caused by R.solani effectively.Strain F-1w as preliminarily identified as S.platensis F-1,and it is an effective agent against R.solani.
Streptomyces platensis F-1;identification;rice sheath blight;biological control
S435.115
A
1000-2324(2014)03-0321-07
2012-10-21
2012-11-04
国家自然科学基金项目(30570079);临沂市科技发展计划项目(201312024);2013年山东省高等学校青年骨干教师国内访问学者项目(1413097)
王岩(1979-),女,讲师,博士,主要从事生物学研究.E-mail:wangyan6696@lyu.edu.cn
*通讯作者:Author for correspondence.E-mail:guoqingli@mail.hzau.edu.cn

