温度和浓度对钒电解液性能的影响
扈显琦,张玉贤,房少华
(1.承德万利通实业集团有限公司,河北承德067000;2.承德石油高等专科学校,河北承德067000)
钒电池系统主要由隔膜、极板、电极、正负极电解液储液罐和循环泵等几部分构成。在钒电池中,正负极储液罐中为不同价态的钒离子溶液。其中正极为V5+/V4+电对,负极为V3+/V2+电对[1]。工作时正负极溶液通过泵导入电池中并在电极上发生氧化还原反应,电池正负极之间以离子交换膜隔开,充放电时电池内部通过电解质中的阳离子定向迁移而导通。全钒氧化还原液流电池具有充放电可逆性高、循环寿命长、能量转换效率高、正负极电解质无交叉污染和容易规模化等优点。钒电池系统可以广泛用于太阳能和风能发电的储能设备、大型应急电源系统、电站储能和电力系统的削峰填谷,负载调平等方面。近年来,对于钒电池使用的隔膜、极板、电极等部件和钒电解液稳定性的研究比较多[2-7],温度对钒电池性能的影响也有研究[8],但是有关温度对钒电解液本身电化学行为的研究报道还很少见。本文则对不同浓度的钒电解液在不同温度下的电化学循环伏安行为进行了研究,总结了温度对钒电解液电化学性能的影响规律,以供钒电池研究和生产参考。
1 实验
1.1 实验仪器及试剂
实验试剂使用由99.5%V2O5制备的V3+和V4+比例为1∶1的不同浓度的钒电解液,其中游离H2SO4浓度为3.0 mol/L。实验仪器使用CS350型电化学工作站,HH-4型恒温水浴锅,FYL-YS-150L型制冷加热两用恒温箱。
1.2 实验方法
采用三电极体系,测量不同温度下不同浓度的钒电解液的循环伏安曲线,扫描速率为50 mV/s。Pt为辅助电极,碳电极为工作电极,饱和甘汞电极(SCE)为参比电极。
2 结果与讨论
2.1 浓度对钒电解液性能的影响
在10、20、30和40℃测得的不同浓度钒电解液的循环伏安曲线分别示于图1、图2、图3和图4。图1~图4中数据显示,在不同的测量温度下,电化学循环伏安曲线变化具有相似的规律。在测量温度范围内的同一温度下,随着含钒离子浓度增大,氧化反应和还原反应的峰值电流增大。温度为10℃时,1.0 mol/L的钒电解液V5+/V4+电对的还原峰电流为0.14 A,氧化峰电流为0.22 A;而2.0 mol/L的电解液中此电对的还原峰电流为0.14 A,氧化峰电流增大为0.25 A。40℃时,1.0 mol/L的钒电解液中V5+/V4+电对的还原峰电流为0.18 A,氧化峰电流为0.28 A;而2.0 mol/L的电解液中此电对的还原峰电流为0.25 A,氧化峰电流增大为0.43 A。这说明含钒离子浓度增加,参加电化学反应的离子数量增多,对全钒液流电池来说,意味着可以产生更大的输出电流。

图1 在10℃条件下测得的不同浓度钒电解液的循环伏安曲线

图2 在20℃条件下测得的不同浓度钒电解液的循环伏安曲线

图3 在30℃条件下测得的不同浓度钒电解液的循环伏安曲线

图4 在40℃条件下测得的不同浓度钒电解液的循环伏安曲线
由图1~图4还可以发现,随着含钒离子浓度增加,氧化峰向右移动,而还原峰向左移动,导致两峰之间的电势差增大。10℃时,1.0 mol/L的钒电解液V5+/V4+电对的还原峰与氧化峰之间的电势差为0.451 V,而2.0 mol/L的钒电解液中此电势差则增大到0.782 V。40℃时,1.0 mol/L的钒电解液V5+/V4+电对的还原峰与氧化峰之间的电势差为0.422 V,而2.0 mol/L的钒电解液中此电势差则增大到0.823 V。这一结果反映出随着钒电解液浓度的升高,电化学反应的可逆性变差。对全钒液流电池来说,这意味着充放电循环过程的能量损失将会增加,势必会降低电池的能量效率。钒原子有空的d轨道,钒离子之间极易缔合,浓度越高,缔合程度也越大,复杂离子参加电化学反应,相应的反应能垒增加,导致极化增大;另一方面,浓度增大导致溶液黏度增大,使传质过程受到一定的阻碍[9]。因此,随着钒电解液浓度的增大,电化学反应发生需要克服更大的阻力,导致反应可逆性变差。
2.2 温度对钒电解液性能的影响
1.6和1.8 mol/L钒电解液在10、20、30和40℃条件下测得的循环伏安曲线分别示于图5和图6。图5和图6中数据反映出,对于不同浓度的钒电解液,温度对电化学循环伏安行为的影响规律也是相同的,即对于同一浓度下的钒电解液,氧化反应和还原反应的峰值电流随着温度的升高而增大,而氧化峰和还原峰的峰值电势基本没变。在1.6 mol/L的钒电解液中,V5+/V4+电对的还原峰电流10℃时为0.14 A,40℃时增大到0.22 A;氧化峰电流10℃时为0.24 A,40℃时增大到0.37 A。在1.8 mol/L的钒电解液中,V5+/V4+电对的还原峰电流10℃时为0.14 A,40℃时增大到0.24 A;氧化峰电流10℃时为0.25 A,40℃时增大到0.41 A。这一现象可由阿累尼乌斯方程解释。阿累尼乌斯方程为[10]:lnk=lnk0-Ea/RT(1)式中:k为反应速率常数,min;k0为频率因子常数,min;Ea为反应活化能,J/mol;R为气体常数,8.314 J/(mol·K);T为绝对温度,K。
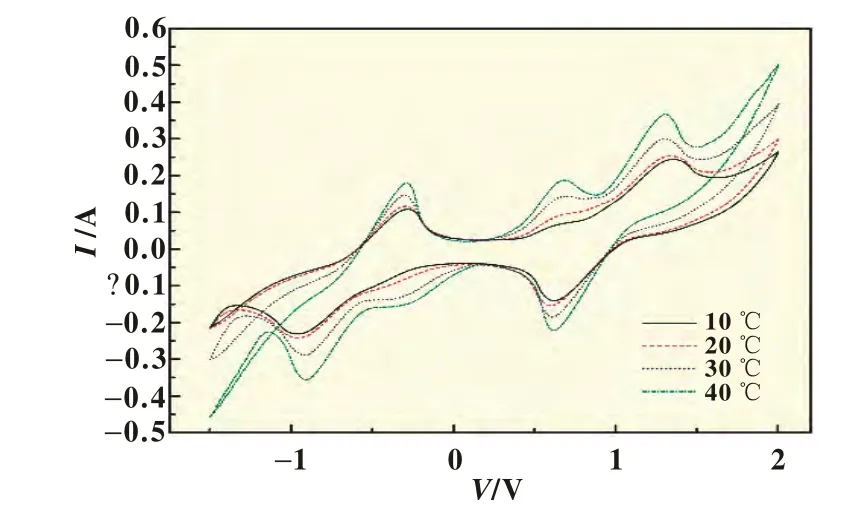
图5 1.6 mol/L的钒电解液在不同温度下测得的循环伏安曲线
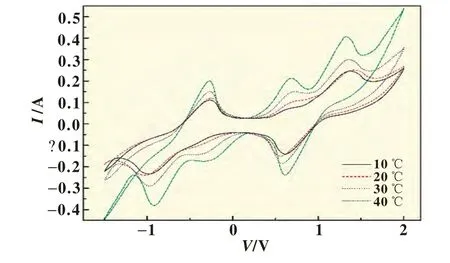
图6 1.8 mol/L的钒电解液在不同温度下测得的循环伏安曲线
由式(1)可知,温度升高,反应速率常数增大,反应产生的电流增大,这与实验现象一致。因而,为了提高全钒液流电池的输出电流,可适当提高钒电解液温度。具体使用温度还要考虑电堆材料的耐热性能。
3 结论
(1)在同一温度下,随着含钒离子浓度增大,参加电化学反应的离子数量增多,钒电池可以产生更大的输出电流。同时随着含钒离子浓度增加,电化学反应的可逆性变差,钒电池充放电循环过程的能量损失将会增加,这势必会降低电池的能量效率。
(2)对于同一浓度下的钒电解液,氧化反应和还原反应的峰值电流值随着温度的升高而增大。因而,适当提高钒电解液温度,可提高全钒液流电池的输出电流。
[1]SKYLLAS-KAZACOS M,ROBINS R G.All-vanadium redox battery:US,4786567[P].1988-01-12.
[2]李荣,余祖孝.钒电池电解液伏安行为研究[J].重庆师范大学学报:自然科学版,2008,25(3):73-76.
[3]刘素琴,张文昔,黄可龙.全钒液流电池用碳毡电极的改性研究[J].电源技术,2006,30(5):395-397.
[4]龙飞,范永生,王保国.全钒液流电池用PVDF基离子交换膜[J].电池,2009,39(2):68-70.
[5]管涛,林茂财,余晴春.添加剂对电解液及钒电池性能的影响[J].电池,2011,41(6):325-327.
[6]汪钱,陈金庆,王保国.导流结构和电极结构对全钒液流电池性能的影响[J].电池,2008,38(6):346-348.
[7]QIAN P,ZHANG H M,CHEN J,et al.A novel electrode-bipolar plate assembly for vanadium redox flow battery applications[J].Power Sources,2008,175(1):613-620.
[8]滕祥国,赵永涛,武增华,等.温度对钒电池性能的影响[J].电源技术,2009,33(7):587-589.
[9]罗冬梅.钒氧化还原液流电池研究[D].沈阳:东北大学,2005.
[10]傅献彩,沈文霞,姚天扬,等.物理化学[M].北京:高等教育出版社,2005.
- 电源技术的其它文章
- 磷酸铁锂动力电池预充工艺的研究

