壳层隔绝纳米粒子增强拉曼光谱检测乳腺浸润性导管癌组织的生物学特点及其临床意义
张海鹏,吴 迪,张 湜,付 彤,路 璐,范志民,郑 超,韩 冰
(1.吉林大学第一医院产科,吉林长春 130021;2.吉林大学第一医院乳腺外科,吉林长春 130021)
壳层隔绝纳米粒子增强拉曼光谱检测乳腺浸润性导管癌组织的生物学特点及其临床意义
张海鹏1,吴 迪2,张 湜∗,付 彤2,路 璐2,范志民2,郑 超2,韩 冰2
(1.吉林大学第一医院产科,吉林长春 130021;2.吉林大学第一医院乳腺外科,吉林长春 130021)
目的:采用壳层隔绝纳米粒子增强拉曼光谱(SHINERS)技术检测乳腺浸润性导管癌(IDC)组织和正常乳腺组织,探讨乳腺IDC的光谱学特点、生物学特征和鉴别方法。方法:收集行乳腺外科手术患者的乳腺组织冰冻切片,共24例,均为女性,年龄27~59岁;其中乳腺IDC组织15例,正常乳腺组织9例。冰冻切片解冻后先行普通拉曼光谱检测,加壳层隔绝纳米粒子(SHINs)后再次检测。共收集了263个拉曼光谱和249个SHINERS光谱,所有光谱均进行基线修正拟合,再将所有的光谱用Adjacent-Averaging算法进行15点平滑。结果:正常乳腺组织特征峰出现在1 090、1 157、1 262、1 300、1 442、1 658、1 745和1 874 cm-1;在加入SHINs后,少数特征峰的峰位出现2~3 cm-1位移,其中1 090和1 157 cm-1相对强度明显增加,出现1 496 cm-1特征峰。乳腺IDC组织普通拉曼光谱检测可见多个核酸特征峰(包括878、1 086和1 157 cm-1);加入SHINs后,明显看到1 004、1 157、1 526和1 658 cm-1相对强度增加,脂类的特征峰1 745和1 442 cm-1为C=O和CH2伸缩振动,IDC组织相对于正常组织表现出2~3 cm-1的蓝移;类胡萝卜素的特征峰出现在1 527 cm-1;核酸的特征峰1 090 cm-1蓝移至1 086 cm-1。结论:拉曼光谱能够发现乳腺IDC组织DNA、蛋白质及类胡萝卜素与正常乳腺组织的差异。SHINERS对不同类型的乳腺组织最大增强的特征峰不同,可以用来区分乳腺IDC组织和正常乳腺组织。
乳腺肿瘤;拉曼光谱;表面增强拉曼光谱;浸润性导管癌
拉曼光谱分析技术是以拉曼效应为基础建立起来的分子结构表征技术,其信号来源于分子的振动和转动[1],拉曼光谱分析在生物学领域研究中的突出优点使其成为近年来应用最多的一种研究手段。拉曼光谱的分析方法不需要对样品进行前处理,操作简便,测定时间短,灵敏度高,有利于临床即时检测;拉曼光谱检测后的组织仍可以进行病理学检查,有利于检测结果与病理结果的对比研究[2-3]。但由于生物样品的拉曼谱峰具有强的荧光背景和复杂的成分等特点,得到质量高可分析的拉曼谱图相对比较困难。田中群等[4]合成了一种全新的增强粒子——壳层隔绝纳米粒子(SHINs),发明了基于表面增强拉曼光谱的一种新技术,即壳层隔绝纳米粒子增强光谱(SHINRES)方法,并将其应用于生物样本的检测,取到很好的效果,目前国内外尚无将该方法应用于乳腺病变组织检测的相关报道。本研究采用SHINRES方法检测乳腺浸润性导管癌(IDC)组织和正常乳腺组织,通过拉曼光谱结果的差异探讨乳腺IDC光谱学特点,为鉴别病变性质和进一步研究病变机制奠定基础。
1 资料与方法
1.1 一般资料收集2011年5月—2012年5月吉林大学第一医院乳腺外科手术患者的乳腺组织冰冻切片,共24例,均为女性,年龄27~59岁;其中乳腺IDC组织15例(年龄31~74岁,中位年龄51.6岁),正常乳腺组织9例(年龄27~59岁,中位年龄40.3岁)。所有患者均同意参加本研究。手术后,样本立即送至吉林大学第一医院病理科,并在-25℃~-20℃条件下冰冻,而后通过冷冻切片机(LEICA-CM3050S,德国)切成6μm厚连续冰冻切片。每个患者均切取1个样本且每个样本仅切取2张冰冻切片。其中1张连续冰冻切片经HE染色后由1位乳腺癌病理学专家进行常规组织病理学诊断;另一张连续冰冻切片在液氮中送往实验室。分析之前,冰冻切片在实验室室温22℃下解冻10 min,光谱采集期间用生理盐水(p H7.4)保持湿润。每张切片均收集多个光谱,但由于一些肿瘤组织样本切片中含有正常和病变区域,因此本研究利用已染色的HE组织病理学切片,只收集病变区域的光谱数据。本文作者收集数据的组织样本切片中的确切区域,在进行病理诊断时以其最高级定义。
1.2 拉曼光谱检测使用具有3λ空间分辨率、20 m W、633 nm的氦氖激光作为激发光的共聚焦拉曼系统收集拉曼光谱。拉曼散射光的收集使用50倍显微镜物镜用于激发光的聚焦。激光聚焦在组织上的光斑大小为2μm。强烈的瑞利散射光被4-notch过滤器过滤。扫描光谱范围为600~2 000 cm-1,积分时间为60 s,累积次数为3次。波数校准设置参照硅片520.7 cm-1振动频率。所有的光谱测量均保持这些设置。
1.3 数据采集从HE染色切片中找到肿瘤位置,收集其连续冰冻切片中相同位置的拉曼光谱。每个样品中从不同位置收集10~12个光谱,以确保代表性取样和收集变化的信号。收集普通拉曼光谱后,将SHINs(由厦门大学田中群院士课题组提供)滴加到冷冻切片的表面,之后收集SHINERS光谱。共收集了来源于不同组织的263个拉曼光谱和249个SHINERS光谱,其中正常乳腺组织共收集103个拉曼光谱和92个SHINERS光谱,乳腺IDC组织共收集160个拉曼光谱和157个SHINERS光谱。
1.4 统计学分析所有光谱均进行基线修正拟合,再减去一个三阶多项式。将所有光谱用Adjacent-Averaging算法进行15点平滑。
2 结果
观察正常乳腺组织冰冻切片的普通拉曼光谱和SHINERS的平均光谱图(图1,见插页五)以及相应的HE染色(图2A,见插页五)、冰冻切片(图2B,见插页五)和滴加SHINs后的病理学图像(图2C,见插页五),普通拉曼光谱可见特征峰出现在1 090、1 157、1 262、1 300、1 442、1 658、 1 745和1 874 cm-1,其中大多数为脂类特征峰和蛋白质,如胶原蛋白的特征峰。加入SHINs后,由于所处环境的改变,少数特征峰的峰位会有2~3 cm-1位移,其中1 090和1 157 cm-1相对强度明显增加,出现1 496 cm-1特征峰,这3个特征峰归属为脂类和核酸中的O-P-O和C-C键。
观察乳腺IDC组织冰冻切片的普通拉曼光谱和SHINERS的平均光谱图(图3,见插页五)以及相应的HE染色(图4A,见插页五)、冰冻切片(图4B,见插页五)和滴加SHINs后的病理学图像(图4C,见插页五),普通拉曼光谱可见有多个核酸特征峰(包括878、1 086和1 157 cm-1),通过蛋白质特征峰可见大量的氨基酸残基(色氨酸、苯丙氨酸和脯氨酸)。加入SHINs后,明显看到1 004、1 157、1 526和1 658 cm-1相对强度增加。各特征峰归属见表1。
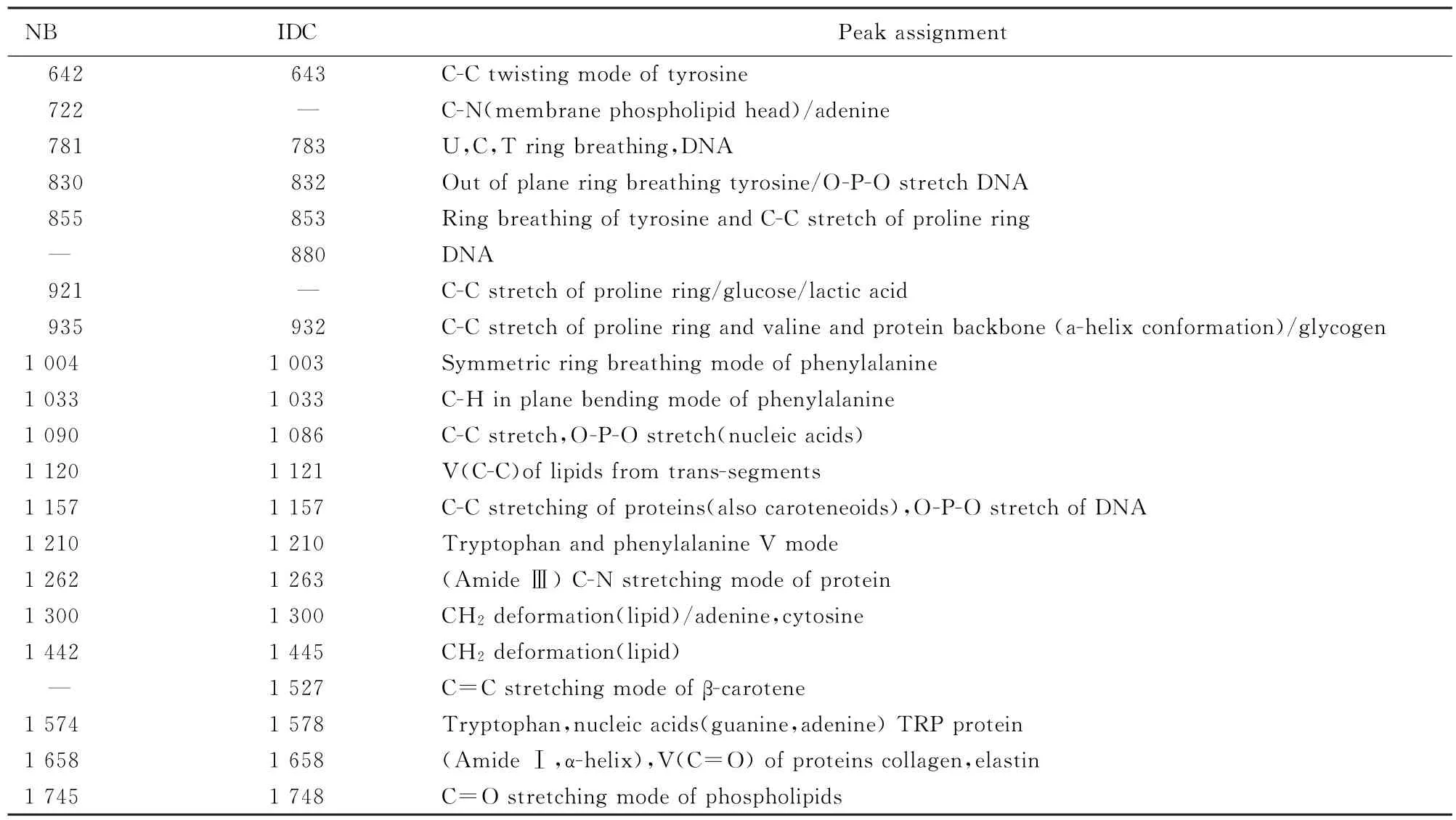
表1 正常乳腺组织和乳腺IDC组织拉曼光谱特征峰的归属Tab.1 Assignments of special peaks of Raman spectra of normal breast tissue and breast IDC tissue
对于脂类的特征峰,1 745和1 442 cm-1左右为C=O和CH2伸缩振动,乳腺IDC组织相对于正常组织表现出2~3 cm-1的蓝移;类胡萝卜素的特征峰出现在1 527 cm-1;核酸的特征峰中, 1 090 cm-1蓝移至1 086 cm-1。蛋白和核酸特征峰增强前后光谱峰的比值见表2。其中1 262、1 445和1 748 cm-1为脂类的特征峰,1 004和1 658 cm-1为蛋白质的特征峰,880、1 086和1 157 cm-1为核酸的特征峰。

表2 正常乳腺组织和乳腺IDC组织中脂类、蛋白和核酸的特征峰增强前后的光谱绝对峰值比值Tab.2 Ratios of absolute values of spectrum of characteristic peaks of lipid,protein and nucleic acid before and after enhancement in normal breast tissue and breast IDC tissue
3 讨论
拉曼光谱对水环境干扰小。可以从分子水平反映结构组分的变化和差异,是一种具有高灵敏度的无损检测方法。拉曼光谱的激发波长和激光能量密度不破坏组织,并且有相对大的穿透深度,所以适合进行体内检测[5-6]。在病变的初期拉曼光谱即可发现其分子细微的生物学组分改变[7],可用于肿瘤的早期诊断,因而显示其具有广泛的应用前景。对于正常乳腺组织,在加入SHINs后,由于所处环境的改变,少数特征峰的峰位发生2~3 cm-1位移,其中1 090和1 157 cm-1相对强度明显增加,并出现了新的特征峰,即1 496 cm-1,这3个特征峰可归属为脂类和核酸中的O-P-O和C-C 键,由此可以推断出SHINs对上述2种化学键有明显的增强作用。本研究在其他特征峰中, 1 262 cm-1为蛋白质的三级结构中的酰胺Ⅲ和酰胺Ⅰ,未观察到非常明显的核酸特征峰,可见正常乳腺组织中细胞比较完整,代谢及复制、转录和翻译等分裂过程正常,未出现病变无限制繁殖及凋亡现象。
本研究结果显示:在乳腺IDC组织普通光谱中可以看到多个核酸特征峰(878、1 086和1 157 cm-1),而蛋白质特征峰则均可见大量的氨基酸残基(色氨酸、苯丙氨酸、脯氨酸)[8-9],可能因其恶性病变后细胞非正常的分裂繁殖,使氨基酸残基逐渐增多,这是细胞的非正常代谢所导致的直接结果[10-11];在加入SHINs后,可明显看到1 004、1 157、1 526和1 658 cm-1相对强度增加,这些特征谱线可归属为氨基酸残基苯丙氨酸、类胡萝卜素、核酸中的嘌呤和酰胺Ⅰ。在正常组织中,酰胺Ⅰ特征谱线比较明显,在恶性病变中却观察不到酰胺Ⅰ特征谱线,但经过SHINs增强,可以观察到比较明显的特征谱线,所以可以推断在恶性病变中存在酰胺Ⅰ带特征峰。对于脂类的特征峰, 1 745和1 442 cm-1左右为C=O和CH2伸缩振动,乳腺IDC组织相对于正常组织表现出2~3 cm-1的蓝移,该变化可能由于细胞癌变过程中脂质过氧化导致[12];而就蛋白特征峰而言, 665 cm-1归属于氨基酸的C-S伸缩振动,只出现在IDC组织中;类胡萝卜素的特征峰,1 527 cm-1C=C伸缩振动只有在IDC组织中表现的比较明显,在其他组织中几乎观察不到。Shafer-Pelitier 等[11]在其所建立的人乳腺组织显微光谱模型中观察到类胡萝卜素未显示出或显示较小的特异性,并不能被视为区分正常、良性和恶性乳腺组织的标志,而本研究结果表明:类胡萝卜素的拉曼光谱是恶性肿瘤表现出的关键特征。核酸的特征峰中,1 090 cm-1左右是DNA的磷酸骨架伸缩振动谱线,一旦DNA发生单、双链的断裂,该谱线强度下降并会发生位移。乳腺IDC组织中该峰蓝移至1 086 cm-1,说明在癌变组织中部分DNA的单双链已开始断裂。比较正常乳腺组织和乳腺IDC组织的普通拉曼光谱特征可以发现:其光谱特征表现出很大的相似性,可能由于2种组织主要的化学成分相同,主要为脂类、蛋白质、核酸和胡萝卜素。同时,2种乳腺组织的普通拉曼光谱表现出一些差异,可以为区分乳腺组织提供一种手段。但由于乳腺组织本身具有强的荧光背景和复杂的化学成分,再加上普通拉曼光谱其灵敏度低,有时很难得到乳腺组织的普通拉曼光谱。因此,为了获得更详细和有效的信息来区分2种乳腺组织,本文作者利用SHINs增强得到了SHINERS,将其与普通拉曼光谱对比显示:拉曼信号强度得到了一定的增强,说明SHINERS可以为区分乳腺疾病提供更有效的信息。
为了利用SHINERS进一步区分2种乳腺组织,本研究采用SHINs对各个组织的主要化学成分包括脂质、蛋白和核酸特征峰的具体增强效果进行比较。SHINs对不同乳腺组织的同类特征峰表现出了不同程度的增强。脂类的特征峰中,正常乳腺组织的1 745 cm-1左右C=O伸缩振动增强效果最明显,1 262 cm-1左右=C-H平面振动增强效果最差。而乳腺IDC组织中,SHINs对1 442 cm-1脂类的CH2伸缩振动增强效果最强,对1 262和1 748 cm-1的增强效果相似。根据表面选择性规则,垂直于金属基底表面的振动模式能得到很大的增强,而平行于金属基底表面的振动模式增强较小[4,13-14]。由此可以推断:在正常乳腺组织和乳腺IDC组织中,脂类的C=O伸缩振动垂直吸附于SHINs表面,=C-H平面振动可能平行吸附于SHINs表面,而导致出现不同程度的增强效果。SHINs对2种组织的1 658 cm-1蛋白质的酰胺Ⅰ带和α-螺旋均表现出较强的增强效果,却对正常组织中1 004 cm-1的苯丙氨酸对称环伸缩振动[15]表现出减弱的作用,对乳腺IDC组织的该特征峰表现出一定的增强作用。事实上,苯丙氨酸一直被认为是细胞增殖不受控制的标志,其广泛存在于纤维腺瘤中的胶原纤维形成及肿瘤癌变增殖等过程,在此表现出的增强效果的差异尚需进一步研究。
核酸不仅是重要的基本遗传物质,而且在合成蛋白质的过程中还起着重要的作用,SHINs对正常乳腺组织中核酸的各个特征峰增强效果类似,而对于乳腺IDC组织,880 cm-1表现出比较强的增强效果。SHINs对每种组织均有1个特征峰的最大增强。在乳腺IDC组织中,880 cm-1归属于DNA的核糖的特征峰得到了最大程度的增强,其增强倍数为10。而对于正常乳腺组织得到最大增强的是1 745 cm-1左右脂类C=O伸缩振动峰,其增强倍数仅为3.5。
本研究结果显示:SHINs对乳腺组织的增强效果并不是特别好,可能是由于SHINs作为SHINERS增强基底,增强机制主要为电磁场增强,而电磁场增强涉及的分子与金属的作用为物理吸附[4,13-14],乳腺组织的成分比较复杂,表面不能很好地吸附纳米粒子,使分子不能很好地吸附在纳米粒子周围而影响了其增强效果,使其低于文献报道的SiO2层为2和4 nm时,可分别增强142和85倍。但是对拉曼光谱的最大增强效果仍旧可以达到10倍左右,这在一定程度上可以提高拉曼光谱对乳腺组织检测的灵敏度。
综上所述,拉曼光谱可以在分子水平上反映乳腺组织生化成分的结构变化和差异,为乳腺疾病的诊断提供了一种有效的光谱手段。拉曼光谱能够发现乳腺IDC组织DNA、蛋白质及类胡萝卜素与正常乳腺组织之间的差异,为癌变机制研究提供一种可能方法。SHINs对不同类型的乳腺组织最大增强的特征峰不同,可以用来区分乳腺IDC和正常乳腺组织。
[1]Tu Q,Chang C.Diagnostic applications of Raman spectroscopy[J].Nanomedicine,2012,8(5):545-558.
[2]张海鹏,付 彤,宋 东,等.壳层隔绝纳米粒子增强光谱方法检测乳腺导管内癌组织的生物学特性[J].吉林大学学报:医学版,2014,40(2):374-378.
[3]张海鹏,付 彤,张志茹,等.应用PCA方法分析拉曼光谱检测结果对乳腺良恶性疾病鉴别诊断的价值[J].吉林大学学报:医学版,2013,39(5):952-957.
[4]Li JF,Huang YF,Ding Y,et al.Shell-isolated nanoparticle-enhanced Raman spectroscopy[J].Nature, 2010,464(7287):392-395.
[5]Stone N,Matousek P.Advanced transmission Raman spectroscopy:a promising tool for breast disease diagnosis[J].Cancer Res,2008,68(11):4424-4430.
[6]Matousek P,Stone N.Recent advances in the development of Raman spectroscopy for deep non-invasive medical diagnosis[J].J Biophotonics,2013,6(1):7-19.
[7]Hu C,Wang J,Zheng C,et al.Raman spectra exploring breast tissues:Comparison of principal component analysis and support vector machine-recursive feature elimination[J].Med Phys,2013,40(6):063501.
[8]Haka AS,Shafer-Peltier KE,Fitzmaurice M,et al.Diagnosing breast cancer by using Raman spectroscopy[J].Proc Natl Acad Sci U S A,2005,102(35):12371-12376.
[9]Haka AS,Shafer-Peltier KE,Fitzmaurice M,et al.Identifying microcalcifications in benign and malignant breast lesions by probing differences in their chemical composition using Raman spectroscopy[J].Cancer Res,2002, 62(18):5375-5380.
[10]Yuen JM,Shah NC,Walsh JT,et al.Transcutaneous glucose sensing by surface-enhanced spatially offset Raman spectroscopy in a rat model[J].Anal Chem,2010, 82(20):8382-8385.
[11]Shafer-Peltier KE,Haka AS,Fitzmaurice M,et al.Raman microspectroscopic model of human breast tissue:implications for breast cancer diagnosisin vivo[J].J Raman Spectrosc, 2002,33(7):552-563.
[12]Abramczyk H,Placek I,Brozek-Pluska B,et al.Human breast tissue cancer diagnosis by Raman spectroscopy[J].Spectrosc-Int J,2008,22(2/3):113-121.
[13]Li JF,Tian XD,Li SB,et al.Surface analysis using shellisolated nanoparticle-enhanced Raman spectroscopy[J].Nat Protoc,2013,8(1):52-65.
[14]Anema JR,Li JF,Yang ZL,et al.Shell-isolated nanoparticle-enhanced Raman spectroscopy:expanding the versatility of surface-enhanced Raman scattering[J].Annu Rev Anal Chem(Palo Alto Calif),2011,4:129-150.
[15]Marcelo M,Leandro R,Emília Angelo Loschiavo A,et al.Raman spectroscopy study of breast disease[J].Theor Chem Acc,2009,125(3-6):329-334.
∗吉林大学临床医学院2012级
Biological characteristics of breast invasive ductal carcinoma detected by shell-isolated nanoparticleenhanced Raman spectroscopy and their clinical significances
ZHANG Hai-peng1,WU Di2,ZHANG Shi∗,FU Tong2,LU Lu2,FAN Zhi-min2,ZHENG Chao2,HAN Bing2
(1.Department of Obstetrics Surgery,First Hospital,Jilin University,Changchun 130021,China; 2.Department of Breast Surgery,First Hospital,Jilin University,Changchun 130021,China)
ObjectiveTo identify normal breast tissue and breast invasive ductal carcinoma(IDC)tissue by shellisolated nanoparticle-enhanced Raman spectroscopy(SHINERS),and to explore the biological characteristics of IDC and the identification method by discussing its spectroscopy characteristics.MethodsThe frozen section of breast tissue from 24 patients(female,aged 27-59 years)underwent routine surgical resection were obtained.9 cases of normal breast tissue and 15 cases of IDC breast tissue were detected by Raman spectroscopy and thenSHINERS technique was utilized.A total of 263 Raman spectra and 249 SHINERS spectra were obtained.All the spectra were dealt with baseline corrected by fitting and subtracting a third-order polynomial and then smoothed with a 15-point Adjacent-Averaging.ResultsThe characteristic peak of normal breast tissue appeared at 1 090,1 157, 1 262,1 300,1 442,1 658,1 745,and 1 874 cm-1.After adding shell-isolated nanoparticles(SHINs),some peaks shifted at 2-3 cm-1,and the relative strengthes of 1 090 and 1 157 cm-1were significantly increased,and the characteristic peak at 1 496 cm-1appeared.The Raman spectroscopy showed there were more nucleic acid characteristic peaks(including 878,1 086,1 157 cm-1)in the breast IDC tissue;after adding SHINs,the relative strengthes of 1 004,1 157,1 526,and 1 658 cm-1were increased,the characteristic peak of lipid at 1 745 cm-1and 1 442 cm-1stemmed from the C=O and CH2 stretching vibration.Compared with the normal breast tissue, the breat IDC tissue showed a blue shift of 2-3 cm-1.The characteristic peaks of nucleic acid had the blue shift from 1 086 cm-1to 1 090 cm-1,and the characteristic peak ofβ-carotene emerged at 1 527 cm-1.ConclusionRaman spectra can discover the differences of the characteristic peaks of DNA,β-carotene,and protein between breast IDC and normal breast tissues;SHINERS can distinguish breast IDC tissue from normal breast tissue successfully.
breast neoplasms;Raman spectroscopy;surface enhanced Raman spectroscopy;invasive ductal carcinoma
R737.9
A
2014-02-10
国家自然科学基金青年基金资助课题(81202078);吉林省科技厅科技发展计划青年基金资助课题(20130522030JH);吉林省科技厅科研基金资助课题(201015155)
张海鹏(1980-),女,吉林省长春市人,主治医师,在读医学博士,主要从事生物拉曼光谱的研究。
韩 冰(Tel:0431-81875672,E-mail:yintian77@126.com);
付 彤(Tel:0431-88782963,E-mail:xxli@jlu.edu.cn)
1671-587Ⅹ(2014)05-1064-05
10.13481/j.1671-587x.20140530

