丹参酮ⅡA对帕金森病模型小鼠多巴胺能神经元的保护作用及其机制
任 博,孙法威,张作凤,张宇新
(河北联合大学基础医学院人体解剖学教研室,河北唐山 063000)
丹参酮ⅡA对帕金森病模型小鼠多巴胺能神经元的保护作用及其机制
任 博,孙法威,张作凤,张宇新
(河北联合大学基础医学院人体解剖学教研室,河北唐山 063000)
目的:探讨丹参酮ⅡA对1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱发的帕金森病(PD)模型小鼠中脑黑质区多巴胺能神经元损伤的影响,阐明其对多巴胺能神经元的保护作用及其可能机制。方法:将60只C57BL/6N小鼠随机分为对照组、PD模型组和丹参酮ⅡA组,每组20只。PD模型组和丹参酮ⅡA小鼠采用MPTP制备PD小鼠模型,丹参酮ⅡA组制备PD模型后腹腔注射丹参酮ⅡA,观察各组小鼠行为学表现,采用免疫组织化学、免疫蛋白印迹和免疫荧光双标法检测各组小鼠中脑黑质区酪氨酸羟化酶(TH)、整合素超家族成员Ⅰ型跨膜蛋白(cd11b)、烟酰胺腺嘌呤二核苷酸(NADPH)氧化酶、诱导型一氧化氮合酶(iNOS)阳性细胞数和蛋白表达水平。结果:与对照组比较,PD模型组小鼠出现典型的PD样症状;PD模型组小鼠中脑黑质区TH阳性神经元数和蛋白表达水平较对照组减少约45%和50%,cd11b、p47-phox和iNOS阳性细胞数和蛋白表达水平增加(P<0.01)。与PD模型组比较,丹参酮ⅡA组小鼠PD样症状减轻,黑质区TH阳性神经元数量和蛋白表达水平明显升高(P<0.01),cd11b、p47-phox和iNOS阳性细胞数明显减少(P<0.01),蛋白表达水平明显降低(P<0.01)。结论:丹参酮ⅡA可在一定程度上阻抑MPTP诱导的PD模型小鼠中脑黑质区多巴胺能神经元的丢失,其神经保护作用机制可能与抑制小胶质细胞激活、NADPH氧化酶和iNOS表达有关。
帕金森病;小胶质细胞;烟酰胺腺嘌呤二核苷酸氧化酶;诱导型一氧化氮合酶;酪氨酸羟化酶;丹参酮ⅡA;小鼠
帕金森病(Parkinson’s disease,PD)是一种常见的中老年神经系统变性疾病,在我国65岁以上人群发病率高达1%。临床上PD以静止性震颤、运动迟缓、肌强直和姿势步态异常为主要特征,病理学方面PD以黑质多巴胺能神经元及其他含色素的神经元大量变性丢失和残存的神经细胞内出现嗜酸性包涵体——路易小体(Lewy body)为特征。PD的发病机制十分复杂,多种因素参与该病的发生和发展,其中小胶质细胞的激活所导致的氧化应激损伤起十分重要的作用[1]。在成熟的脑内,静息态的小胶质细胞表现出典型的分支状形态,负责免疫监视。当遇到脑外伤或免疫刺激时,小胶质细胞易被激活,从静息的分支状转变为激活的阿米巴状。活化的小胶质细胞可以产生大量的活性物质,包括活性氧和活性氮,可直接对神经细胞造成损伤[2-3],产生活性物质的2个主要来源是烟酸胺腺嘌呤二核苷酸(NADPH)氧化酶和诱导型一氧化氮合酶(iNOS)[4-6]。在正常的中枢神经系统中,NADPH氧化酶和iNOS均不表达或低表达;但在PD患者和1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的PD小鼠模型脑内,两者均高表达,参与PD的发生和发展,而在缺乏这2种酶的基因突变小鼠中,多巴胺能神经元的减少程度均减轻[7-9]。本研究采用整合素超家族成员Ⅰ型跨膜蛋白(cd11b)和p47-phox分别标记小胶质细胞和NADPH氧化酶。
丹参酮ⅡA(tanshinoneⅡA,TanⅡA)是一种从中药丹参中提取的主要有效成分,在多种疾病中发挥抗炎和抗氧化作用[10-13]。然而,丹参酮ⅡA能否在PD中发挥神经保护作用尚未明确。本研究采用MPTP制备PD小鼠模型,观察模型小鼠中脑黑质多巴胺能神经元、小胶质细胞、NADPH氧化酶和iNOS的变化情况,观察丹参酮ⅡA是否具有保护多巴胺能神经元的作用,并探讨其可能的保护作用机制。
1 材料与方法
1.1 实验动物及主要试剂健康雄性C57BL/6N小鼠60只,8~12周龄,体质量25~30 g,购于北京维通利华公司,合格证号:SCXX(京)2002-2003,自由进食饮水,室温(25±2)℃,单笼喂养,自然光照。MPTP(Sigma公司,美国),大鼠抗小鼠酪氨酸羟化酶(tyrosine hydroxylase,TH)单克隆抗体(Chemicon公司,美国),兔抗小鼠cd11b多克隆抗体(武汉博士德公司),兔抗小鼠p47-phox多克隆抗体(Bioworld公司,美国),兔抗小鼠iNOS多克隆抗体(北京博奥森公司),丹参酮ⅡA[西安开来生物工程有限公司,高效液相色谱(HPLC)≥98%)],UhraSensitive SP超敏试剂盒(福州迈新公司),预染蛋白Marker(天津灏洋公司)。
1.2 动物分组及模型制备60只小鼠随机分为对照组、PD模型组和丹参酮ⅡA组,每组20只。PD模型组:小鼠腹腔注射MPTP 20 mg·kg-1,生理盐水溶解,1次·2 h-1,连续4次;丹参酮ⅡA组:除给予模型组相同的处理外,在最后一次注射MPTP 12 h后,腹腔注射丹参酮ⅡA 25 mg·kg-1(含1%二甲基亚砜的PBS溶液),每天1次,连续7 d;对照组:注射与模型组和丹参酮ⅡA组等体积的生理盐水和含1%二甲基亚砜的PBS溶液。于每次注射药物后观察小鼠的行为学变化。
1.3 标本采集分别于末次注射MPTP后第3和7天处死小鼠。小鼠麻醉后,行40 g·L-1多聚甲醛磷酸盐缓冲液常规灌注固定,迅速开颅取脑, 40 g·L-1多聚甲醛后固定48 h(4℃),石蜡包埋、切片。MPTP末次注射后3 d所取标本用于观察cd11b、p47-phox和iNOS的表达,MPTP末次注射后7 d所取标本用于判定PD模型是否复制成功。
1.4 免疫组织化学SP检测每组小鼠随机取9只行免疫组织化学SP法染色。脑组织切片常规脱蜡至水后,用TBST洗3次,每次3 min,组织抗原行水浴法热修复,3%过氧化氢阻断内源性过氧化物酶,TBST洗3次;采用正常非免疫动物血清室温孵育10 min;同一组织相邻切片分别加入大鼠抗小鼠TH单克隆抗体(1∶300)、兔抗小鼠cd11b多克隆抗体(1∶200)、兔抗小鼠p47-phox多克隆抗体(1∶200)和兔抗小鼠iNOS多克隆抗体(1∶150),4℃过夜;TBST洗3次后,加入生物素标记的第二抗体,室温孵育20 min,TBST洗3次,加入链霉素抗生物素蛋白-过氧化物酶,室温孵育20 min,DAB显色,中性树脂胶封固,光镜下观察拍照。选定黑质所在区域,采用CMIAS真彩医学图像免疫组织化学自动分析系统进行阳性细胞计数。各组每只动物6张脑片数值相加后取平均值。
1.5 免疫荧光检测每组小鼠随机取5只行免疫荧光双标记法检测。取脑组织切片室温放置30 min后,用PBS洗涤3次,每次5 min,新鲜的胚胎牛血清封闭2 h,0.4%Triton PBS打孔1 h,正常非免疫动物血清室温孵育30 min,同一组织相邻切片分别加入大鼠抗小鼠TH单克隆抗体(1∶300)和兔抗小鼠cd11b多克隆抗体(1∶200)一抗混合液,大鼠抗小鼠TH单克隆抗体(1∶300)和兔抗小鼠p47-phox多克隆抗体(1∶150)一抗混合液,大鼠抗小鼠TH单克隆抗体(1∶300)和兔抗小鼠iNOS多克隆抗体(1∶100)一抗混合液4℃过夜,PBS振洗3次,每次5 min,加入FITC标记山羊抗兔IgG(1∶50)和TRITC标记的山羊抗小鼠IgG(1∶50)荧光二抗混合液,37℃孵育60 min,PBS振洗3次,每次5 min,超纯水振洗10 min,甘油缓冲液封片,荧光显微镜拍照观察。绿色荧光为cd11b、p47-phox和iNOS表达,红色荧光为TH表达,橘黄色为双重荧光标记。
1.6 蛋白质免疫印迹分析每组取6只小鼠行免
疫蛋白印迹分析。小鼠麻醉后迅速取脑,分离中脑黑质部分,置入4℃细胞裂解液中,低温匀浆,静置30 min,12 000×g、4℃离心15 min,取上清液,-80℃保存备用。蛋白定量后加入4倍体积样本缓冲液,95℃变性5 min。蛋白上样量为20 mg,样品在10%SDS-PAGE凝胶上电泳并转移至硝酸纤维素膜,以标准蛋白标记物为参照,依相对分子质量大小切取条带,相应条带分别加入cd11b多抗(1∶200)、p47-phox多抗(1∶150)、iNOS多抗(1∶300)和TH单抗(1∶1 000),4℃过夜,室温孵育1 h后,TBS洗5次,每次3 min,分别加入二抗(生物素标记羊抗兔IgG,1∶500)室温孵育1 h,TBS洗5次,每次3 min,洗涤后ECL显色,扫描蛋白印迹条带,行定量分析。
1.7 统计学分析采用SPSS 13.0统计软件进行数据分析。各组小鼠中脑黑质TH、cd11b、p47-phox和iNOS阳性细胞数及蛋白表达水平以±s表示,组间比较采用单因素方差分析。
2 结果
2.1 各组小鼠行为学表现PD模型组小鼠于MPTP第3次注射后均出现不同程度的震颤、竖毛、弓背和翘尾等症状,四肢肌张力增高,协调性差,呈尾僵过直伸状;第4次注射后,上述表现愈加明显,出现自发性活动减少并进行性加重,运动减缓或不能。对照组小鼠未见上述变化。丹参酮ⅡA组小鼠上述行为学症状明显减轻。
2.2 免疫组织化学检测对照组小鼠中脑黑质致密部可见大量TH阳性神经元,且分布整齐,呈条带状,黑质区有少量cd11b、p47-phox和iNOS阳性细胞分布。与对照组比较,PD模型组小鼠中脑黑质区TH阳性神经元数量减少(P<0.01), cd11b、p47-phox和iNOS免疫阳性细胞数增加(P<0.01)。与PD模型组小鼠比较,丹参酮ⅡA组小鼠中脑黑质区TH阳性神经元数量明显增加(P<0.01),cd11b、p47-phox和iNOS阳性细胞数明显减少(P<0.01)。见图1(插页二)和表1。
对照组小鼠中脑黑质区小胶质细胞形态呈分支状,细胞较小;与对照组比较,PD模型组小鼠中脑黑质区小胶质细胞体积明显增大,胞浆内容物增多,为典型的激活态表现;与PD模型组比较,丹参酮ⅡA组小鼠中脑黑质区小胶质细胞体积明显缩小,胞浆内容物明显减少。见图2(插页二)。
免疫荧光双标结果显示:PD模型组小鼠中脑黑质区TH免疫阳性细胞呈红色,呈条带状分布; p47-phox和iNOS免疫阳性细胞呈绿色,融合图像可见橘黄色荧光(图3,见插页二),提示黑质区NADPH氧化酶和iNOS可表达于TH免疫阳性细胞。
2.3 免疫印迹分析在预染蛋白标准相对分子质量约48 000、61 000、130 000和165 000处分别可见p47-phox、TH、iNOS和cd11b特异性蛋白条带(图4)。图像分析结果显示:与对照组比较, PD模型组小鼠中脑黑质区p47-phox、iNOS和cd11b的表达水平升高(P<0.01),TH表达水平降低(P<0.01);与PD模型组比较,丹参酮ⅡA组小鼠中脑黑质区p47-phox、iNOS和cd11b表达水平降低(P<0.01),TH水平升高(P<0.01)。见表2。
表1 各组小鼠中脑黑质区TH、cd11b、p47-phox和iNOS阳性细胞数Tab.1 Number of TH,cd11b,p47-phox and iNOS positive cells in substantia nigra of mice in various groups (n=9,±s)

表1 各组小鼠中脑黑质区TH、cd11b、p47-phox和iNOS阳性细胞数Tab.1 Number of TH,cd11b,p47-phox and iNOS positive cells in substantia nigra of mice in various groups (n=9,±s)
∗P<0.01 vs control group;△P<0.01 vs model group.
Group Number of positie cells TH cd11b p47-phox iNOS Control 173.59±5.60 3.11±0.78 30.40±6.06 47.46±4.60 Model 82.60±35.45∗12.33±1.00∗101.45±48.12∗88.17±27.45∗TanⅡA 115.09±23.78△4.89±1.16△76.61±25.56△69.96±16.28△
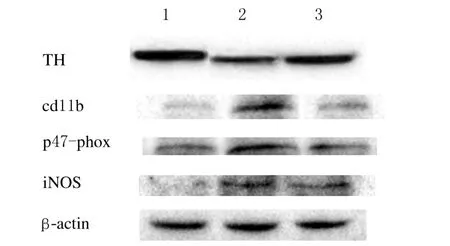
图4 Western blotting法检测各组小鼠中脑黑质区TH、cd11b、p47-phox和iNOS蛋白表达电泳图Fig.4 Electrophoregram of expressions of TH,cd11b,p47-phox and iNOS proteins in substantia nigra of mouse midbrain in various groups detected by Western blotting methodLane 1:Control group;Lane 2:Model group;Lane 3:TanⅡA group.
3 讨论
PD以静止性震颤、运动迟缓和姿势步态异常等为主要临床表现,以中脑黑质区多巴胺能神经元变性和丢失为主要神经病理学特征。本实验复制的动物模型具有典型的PD样行为学表现,中脑黑质区多巴胺能神经元特异性标记物TH免疫阳性细胞明显减少,中脑黑质TH蛋白表达下降,提示本实验模型动物中脑黑质存在多巴胺能神经元大量丢失;因纹状体接受从黑质多巴胺能神经元投射来的神经纤维,故本实验对小鼠纹状体TH免疫组织化学染色结果显示:PD模型组小鼠纹状体的TH阳性神经元数量明显减少,并与黑质多巴胺能神经元丢失相一致。上述结果说明本实验采用的动物模型符合实验要求。本研究中丹参酮ⅡA组小鼠中脑黑质多巴胺能神经元和纹状体多巴胺能神经元数量均比模型组明显增加,表明丹参酮ⅡA具有保护中脑黑质多巴胺能神经元的作用。
表2 各组小鼠中脑黑质区TH、cd11b、p47-phox和iNOS蛋白表达水平Tab.2 Expression levels of TH,cd11b,p47-phox and iNOS in substantia nigra of mouse midbrain in various groups (n=6,±s)

表2 各组小鼠中脑黑质区TH、cd11b、p47-phox和iNOS蛋白表达水平Tab.2 Expression levels of TH,cd11b,p47-phox and iNOS in substantia nigra of mouse midbrain in various groups (n=6,±s)
∗P<0.01 vs control group;△P<0.01 vs model group.
Group Expression level of protein TH cd11b p47-phox iNOS Control 16.60±0.82 1.10±0.20 4.60±0.30 4.30±0.35 Model 9.57±4.37∗18.30±4.30∗14.58±8.20∗14.46±5.37∗TanⅡA 11.24±3.13△3.20±1.20△9.93±3.73△10.19±4.61△
流行病学研究[14]显示:炎症可增加PD发病率,许多PD动物实验也显示炎症可以导致中脑黑质致密部多巴胺能神经元死亡[7-9]。本实验免疫印迹结果显示:PD模型组小鼠中脑黑质cd11b蛋白表达水平较对照组明显上调,TH蛋白表达明显下降;免疫组织化学结果显示:PD模型组小鼠中脑黑质区小胶质细胞体积区较对照组明显增大,TH阳性神经元明显减少,这些结果提示PD模型组小鼠黑质区存在炎症反应,且这种炎症反应可能与多巴胺能神经元的减少有关;丹参酮ⅡA干预后,小鼠中脑黑质区cd11b蛋白表达较PD模型组明显下降,小胶质细胞胞体较模型组明显减小,同时伴有TH蛋白水平升高,TH阳性神经元增多,纹状体多巴胺能神经纤维增多,提示丹参酮ⅡA有保护多巴胺能神经元的作用,且这种作用可能与抑制小胶质细胞激活表达有关。
炎症过程中小胶质细胞会产生大量活性物质,这些活性物质的大量产生会使中脑黑质处于氧化应激状态,从而导致多巴胺能神经元死亡。这些活性物质的主要来源是NADPH氧化酶和iNOS[15]。NADPH氧化酶是由gp91-phox、p22-phox、p47-phox、p67-phox和p40-phox亚基构成的多聚体酶,其中p47-phox、p67-phox和p40-phox是其胞浆部分,gp91-phox和p22-phox是其胞膜部分,本实验采用p47-phox作为该酶的标记物进行观察。本实验采用免疫组织化学和免疫印迹法检测各组小鼠中脑黑质区中p47-phox和iNOS的表达结果显示:PD模型组小鼠中脑黑质区p47-phox和iNOS表达较对照组明显增多,且伴TH表达明显减少,表明NADPH氧化酶和iNOS的大量表达可能导致多巴胺能神经元丢失;采用丹参酮ⅡA干预后,小鼠中脑黑质区p47-phox和iNOS表达较PD模型组明显减少,同时伴有TH表达升高,表明丹参酮ⅡA有保护多巴胺能神经元的作用,且这种保护作用可能与抑制NADPH氧化酶和iNOS的表达有关。
研究[16]证实:小胶质细胞来源的NADPH氧化酶和iNOS的激活表达可导致多巴胺能神经元死亡。为探讨多巴胺能神经元能否表达NADPH氧化酶和iNOS从而导致自身死亡,本实验采用p47-phox、TH和iNOS和TH荧光双标观察结果显示:PD模型组小鼠中脑黑质区TH阳性神经元和p47-phox及iNOS阳性细胞存在共定位,表明多巴胺能神经元本身可表达NADPH氧化酶和iNOS。然而,这种共定位仅占p47-phox和iNOS表达的一部分,共定位区域周围也见p47-phox和iNOS表达的其他类型细胞。这一结果提示:在黑质多巴胺能神经元死亡过程中,不仅可能存在小胶质细胞源的NADPH氧化酶和iNOS的激活表达[16],而且多巴胺能神经元本身亦可表达NADPH氧化酶和iNOS。
有研究[17]显示:iNOS或NADPH氧化酶的单独激活表达可能相对有益,甚至可能起细胞保护作用,但一旦两者联合表达,则会导致细胞死亡。本实验中,PD模型组小鼠中脑黑质区有大量激活表达的NADPH氧化酶与iNOS,同时伴有多巴胺能神经元大量变性丢失,提示小胶质细胞与其他细胞,特别是多巴胺能神经元自身的NADPH氧化酶和iNOS大量激活表达相互作用、相互影响,共同促进了多巴胺能神经元的丢失。丹参酮ⅡA对保护多巴胺能神经元的作用可能与其抑制黑质内NADPH氧化酶和iNOS表达有关。
[1]Peterson LJ,Flood PM.Oxidative stress and microglial cells in Parkinson’s disease[J].Mediators Inflamm, 2012,2012(5):401264.
[2]Kraft AD,Harry GJ.Features of microglia and neuroinflammation relevant to environmental exposure and neurotoxicity[J].Int J Environ Res Public Health,2011, 8(7):2980-3018.
[3]Hanisch UK.Microglia as a source and target of cytokines[J].Glia,2002,40(2):140-155.
[4]Heese K,Hock C,Otten U.Inflammatory signals induce neurotrophin expression in human microglial cells[J].J Neurochem,1998,70(2):699-707.
[5]Whitney NP,Eidem TM,Peng H,et al.Inflammation mediates varying effects in neurogenesis:relevance to the pathogenesis of brain injury and neurodegenerative disorders[J].J Neurochem,2009,108(6):1343-1359.
[6]Heese K,Fiebich BL,Bauer J,et al.NF-kappaB modulates lipopolysaccharide-induced microglial nerve growth factor expression[J].Glia,1998,22(4):401-407.
[7]Yoneyama M,Shiba T,Hasebe S,et al.Adult neurogenesis is regulated by endogenous factors produced during neurodegeneration[J].J Pharmacol Sci,2011, 115(4):425-432.
[8]Bartels AL,Leenders KL.Neuroinflammation in the pathophysiology of Parkinson’s disease:evidence from animal models to human in vivo studies with[11C]-PK11195 PET[J].Mov Disord,2007,22(13):1852-1856.
[9]Block ML,Hong JS.Chronic microglial activation andprogressive dopaminergic neurotoxicity[J].Biochem Soc Trans,2007,35(5):1127-1132.
[10]Yin X,Yin Y,Cao FL,et al.TanshinoneⅡA attenuates the inflammatory response and apoptosis after traumatic injury of the spinal cord in adult rats[J].PLoS One,2012, 7(6):e38381.
[11]Chen Y,Wu X,Yu S,et al.Neuroprotection of TanshinoneⅡA against cerebral ischemia/reperfusion injury through inhibition of macrophage migration inhibitory factor in rats[J].PLoS One,2012,7(6):e40165.
[12]Chen Y,Wu X,Yu S,et al.Neuroprotective capabilities of TanshinoneⅡA against cerebral ischemia/reperfusion injury via anti-apoptotic pathway in rats[J].Biol Pharm Bull, 2012,35(2):164-170.
[13]Wang P,Wu XQ,Bao YX,et al.TanshinoneⅡA prevents cardiac remodeling through attenuating NAD(P)H oxidasederived reactive oxygen species production in hypertensive rats[J].Pharmazie,2011,66(7):517-524.
[14]Hirsch EC,Hunot S.Neuroinflammation in Parkinson’s disease:a target for neuroprotection?[J].Lancet Neurol, 2009,8(4):382-397.
[15]Brown GC.Mechanisms of inflammatory neurodegeneration: iNOS and NADPH oxidase[J].Biochem Soc Trans,2007, 35(5):1119-1121.
[16]Block ML,Hong JS.Microglia and inflammation-mediated neurodegeneration:multiple triggers with a common mechanism[J].Prog Neurobiol,2005,76(2):77-98.
[17]Mander P,Brown GC.Activation of microglial NADPH oxidase is synergistic with glial iNOS expression in inducing neuronal death:a dual-key mechanism of inflammatory neurodegeneration[J].J Neuroinflammation,2005, 12(2):20-35.
Protective effect of tanshinoneⅡA on dopaminergic neurons in mouse model of Parkinson’s disease and its mechanism
REN Bo,SUN Fa-wei,ZHANG Zuo-feng,ZHANG Yu-xin
(Department of Anatomy,School of Basic Medical Sciences,Hebei United University,Tangshan 063000,China)
ObjectiveTo explore the effects of tanshinoneⅡA on the injury of dopaminergic neurons of Parkinson’s disease(PD)mouse model induced by 1-methy-4-phenyl-1,2,3,6-tetrahydropyridine(MPTP),and to clarify the possible mechanism of its protective effects on dopaminergic neurons.Methods60 C57BL/6N mice were randomly divided into control group,PD model group and tanshinoneⅡA group(n=20).The mice in PD model group and tanshinoneⅡA group were treated with MPTP to establish PD models.The bebavior of the mice in various groups was observed.The number of tyrosine hydroxylase(TH),cd11b,p47-phox,and induciblenitricoxidesynthase(iNOS)-positive cells,and the protein expression levels of TH,cd11b,p47-phox and iNOS in the substantia nigra(SN)of the midbrain of the mice in various groups were detected with immunohistochemistry, Western blotting and double-labeling immunofluorescence assay.ResultsCompared with control group,the mice in PD model group exhibited typical symptoms of PD,and the number of TH-positive cells and the protein expression level of TH in the substantia nigra of the mice in PD model group were reduced by about 45%and 50%; the number of cd11b,p47-phox,iNOS-positive cells and the protein expression levels of cd11b,p47-phox,iNOS were markedly increased(P<0.01).Compared with PD model group,the symptoms of PD of the mice in tanshinoneⅡA group were alleviated,the number of TH-positive cells and the expression level of TH protein in the SN were increased(P<0.01),and the number of cd11b,p47-phox and iNOS-positive cells and the TH protein expression levels were obviously decreased(P<0.01).ConclusionTanshinoneⅡA could mitigate the loss of dopaminergic neurons in the PD mouse model induced by MPTP.The mechanism of neuprotective effect may be related to the inhibition of microglial activation,NADPH oxidase and iNOS expressions.
Parkinson’s disease;microglia;NADPH oxidase;inducible nitric oxide synthase;tyrosine hydroxylase;tanshinoneⅡA;mice
R742.5
A
2013-12-02
河北省科技厅自然科学基金资助课题(C2004000689);河北省科技厅博士基金资助课题(05547008D-4);河北省科技厅科学技术与社会发展计划项目资助课题(04276135)
任 博(1987-),男,山东省济南市人,医学硕士,主要从事帕金森病病因与发病机制的研究。
张宇新(Tel:0315-3726421,E-mail:jpzyx@163.com)
时间: 2014-08-27 14:42
网络出版地址: www.cnki.net/kcms/detail/22.1342.R.20140827.1442.003.html
1671-587Ⅹ(2014)05-0947-06
10.13481/j.1671-587x.20140508

