苯通过激活线粒体凋亡通路对小鼠骨髓细胞凋亡的诱导作用及其机制
于光艳,宋祥福,赵淑华,刘晓梅,孙志伟,2
(1.吉林大学公共卫生学院劳动卫生与环境卫生教研室,吉林长春 130021;2.首都医科大学公共卫生学院卫生毒理学教研室,北京 100069)
苯通过激活线粒体凋亡通路对小鼠骨髓细胞凋亡的诱导作用及其机制
于光艳1,宋祥福1,赵淑华1,刘晓梅1,孙志伟1,2
(1.吉林大学公共卫生学院劳动卫生与环境卫生教研室,吉林长春 130021;2.首都医科大学公共卫生学院卫生毒理学教研室,北京 100069)
目的:建立小鼠吸入气态苯染毒模型,探讨苯对骨髓细胞凋亡的诱导作用和机制,为苯骨髓毒作用机制的研究提供实验依据。方法:将24只雄性小鼠随机分为对照组和低、中、高剂量苯染毒组(染毒剂量分别为400、800和1 600 mg·m-3),每组6只。各剂量苯染毒组小鼠进行静式染毒,每天2 h,连续染毒15 d后将各组小鼠全部处死,HE染色后光镜下观察各组小鼠骨髓细胞的病理学改变,流式细胞仪测定各组小鼠骨髓细胞凋亡率及线粒体膜电位,免疫组织化学法测定各组小鼠线粒体凋亡途径中相关基因蛋白的表达。结果:低、中和高剂量苯染毒组小鼠骨髓边缘及中央处细胞数明显减少,高剂量苯染毒组小鼠骨髓还伴有大量的血窦扩张。中和高剂量苯染毒组细胞凋亡率明显高于对照组,差异有统计学意义(Ρ<0.01),且高剂量苯染毒组与低和中剂量苯染毒组比较差异也有统计学意义(Ρ<0.05)。低、中和高剂量苯染毒组小鼠骨髓细胞线粒体膜电位随着染毒剂量的增加明显降低,中和高剂量苯染毒组与对照组比较差异有统计学意义(Ρ<0.05或P<0.01)。不同剂量苯染毒组Bax、CytC及中、高剂量苯染毒组Caspases-9、Caspases-3阳性细胞数随染毒剂量的增加显著升高,与对照组比较差异均有统计学意义(Ρ<0.05);而各剂量苯染毒组Bcl-2阳性细胞数则明显低于对照组(Ρ<0.05),且中和高剂量苯染毒组与低剂量苯染毒组比较差异也有统计学意义(Ρ<0.05)。结论:一定剂量的苯可以诱导小鼠骨髓细胞发生凋亡,促进线粒体凋亡相关基因蛋白的表达。通过线粒体凋亡通路诱导的细胞凋亡可能是苯骨髓毒性的重要机制之一。
苯;细胞凋亡;线粒体膜电位;凋亡基因蛋白
苯是一种在工农业生产及日常生活中应用很广泛的有机溶剂,普遍存在于环境中。流行病学和动物实验研究[1-5]表明:长期接触苯会引起血液系统方面的改变,导致白细胞减少和骨髓抑制,发生白血病和恶性淋巴瘤的危险性升高。尽管国内外专家学者对苯的毒作用机制已经进行了多方面的研究和探讨,但其致血液毒性的机制迄今尚未完全阐明。近年来研究[6-9]显示:苯可以诱导造血细胞发生凋亡,且凋亡相关基因的差异表达与苯血液毒性的发生、发展有密切关联。如果对苯诱导的细胞凋亡相关基因及调控凋亡的信号转导通路进行研究,可为阐明苯中毒的发病机制提供重要依据[5]。本研究通过建立小鼠吸入气态苯染毒模型,采用细胞生物学、免疫学等实验方法,探讨细胞凋亡相关信号转导通路在苯诱导的小鼠骨髓细胞凋亡中的作用,为阐明苯中毒的发病机制和预防白血病的发生及降低其发病率提供实验依据。
1 材料与方法
1.1 实验动物与分组24只普通级封闭群昆明系雄性小鼠由吉林大学实验动物部提供,合格证号: 10-1023,体质量(13±1)g。按照随机分组原则,参照小鼠吸入苯的半数致死浓度(LC50) [(45 000±935)mg·m-3·2 h-1],分为对照组和低、中、高剂量苯染毒组(染毒剂量为400、800 和1 600 mg·m-3),进行静式染毒,每天2 h。连续染毒15 d后将小鼠全部处死,取骨髓,测定相关指标。
1.2 主要试剂与仪器苯(分析纯,天津市致远化学试剂有限公司),Bax、Bcl-2、CytC、Caspase-3 和Caspase-9多克隆抗体(美国Santa Cruz公司),二氨基联苯胺显色试剂盒(北京中杉金桥生物技术有限公司),SP超敏试剂盒(福州迈新生物技术有限公司),碘化丙啶(PI)、RNA酶和Rhodamine123(美国Sigma公司)。56L静式染毒柜(吉林大学劳动卫生与环境卫生教研室提供), FACScan流式细胞仪(美国Becton Dickinson公司),光学显微镜(日本Olympus公司)。
1.3骨髓病理切片制备小鼠眼眶取血处死后,取胸骨,放入10%甲醛溶液中固定,乙醇梯度脱水,常规石蜡包埋,间断均匀切片5~10张,切片厚度5μm,HE染色,光镜下观察骨髓细胞形态学变化。
1.4 骨髓线粒体膜电位测定采用流式细胞术(FCM)检测[10]。将小鼠颈椎脱臼处死,取出股骨,剔除肌肉和结缔组织,剪开股骨两端,用1 m L注射器以0.01 mol·L-1PBS冲出骨髓细胞,滤网过滤(200目尼龙网),制成单个骨髓细胞悬液。加等体积的20 mg·L-1Rhodamine123,至终体积约10 mg·L-1,37℃避光孵育30 min,以PBS清洗脱色,1 500 r·min-1离心10 min,重复1次,用微量0.01 mol·L-1PBS(与沉淀等体积)混匀细胞,采用流式细胞仪(激发光波长488 nm)检测,每个样品收集1×104个细胞,测定细胞相对荧光强度,以U值表示,并以实验组U值/对照组U值×100%表示细胞线粒体膜电位变化。
1.5 骨髓细胞凋亡检测采用PI标记,FCM检测细胞凋亡率[11]。将小鼠颈椎脱臼处死,取出股骨,剔除肌肉和结缔组织,剪开股骨两端,用1 m L注射器以0.01 mol·L-1PBS冲出骨髓细胞,滤网过滤(200目尼龙网),制成单个骨髓细胞悬液。用0.01 mol·L-1PBS洗2次,加100μL RNase(10 mg·L-1)和100μL PI(5 mg·L-1), 4℃避光孵育30 min,用流式细胞仪收集1× 104个细胞,采用Cellquest软件分析结果,结果以凋亡细胞的百分率表示。
1.6 CytC、Bcl-2、Bax、Caspases-3和Caspases-9蛋白表达的检测将小鼠颈椎脱臼处死,取胸骨,常规涂片,自然晾干后,10%甲醛缓冲液固定15 min,风干后放于-20℃冰箱保存。采用免疫组织化学技术[11]进行检测。PBS洗3次,每次5 min。滴加1∶10稀释的正常血清,置湿盒内10 min后,每张玻片加1∶50稀释的第一抗体, 4℃过夜。PBS洗3次,每次5 min,滴加生物素标记的第二抗体,置湿盒内30 min。PBS洗3次,每次5 min,滴加1∶20稀释的第三抗体(卵白素-生物素过氧化酶复合物),置湿盒内1 h。PBS洗3次,每次5 min,滴加新鲜配制的酶作用底物(DAB),显色,显微镜下观察染色情况,当目的蛋白出现黄色,立即用自来水冲洗终止显色反应。苏木精复染,水洗。置入70%HCl-乙醇中15 s,水洗。弱氨水返蓝15 s,显微镜下观察,当胞核呈现蓝染,立即水洗。乙醇梯度脱水,二甲苯透明,中性树胶封片。阳性细胞为胞浆(或胞膜、胞核)呈棕黄色染色。显微镜下每张切片随机观察5个视野,每个视野观察100个细胞,阳性细胞在500个细胞中所占的比例为抗体阳性表达率。
1.7 统计学分析采用SPSS 14.0统计软件对数据进行统计处理。小鼠骨髓细胞凋亡率、线粒体膜电位和Bax、Caspases-9、Caspases-3、CytC、Bcl-2蛋白表达水平以±s表示,组间比较采用方差分析和q检验。
2 结果
2.1 小鼠骨髓细胞病理学低、中和高剂量苯染毒组骨髓边缘及中央处细胞数明显减少,高剂量苯染毒组还伴有大量的血窦扩张。见图1(插页二)。
2.2 各组小鼠骨髓细胞凋亡率及线粒体膜电位中和高剂量苯染毒组小鼠骨髓细胞凋亡率明显高于对照组,差异有统计学意义(Ρ<0.01),且高剂量苯染毒组与低、中剂量苯染毒组比较差异也有统计学意义(Ρ<0.05);各剂量苯染毒组小鼠骨髓细胞线粒体膜电位随着染毒剂量的增加明显降低,中和高剂量苯染毒组与对照组比较差异有统计学意义(Ρ<0.05或P<0.01)。见表1。
表1 各组小鼠骨髓细胞凋亡率及线粒体膜电位Tab.1 Apoptotic rates of bone marrow cells and mitochondrial membrane potential(MMP)of mice in various groups(n=4,±s,η/%)

表1 各组小鼠骨髓细胞凋亡率及线粒体膜电位Tab.1 Apoptotic rates of bone marrow cells and mitochondrial membrane potential(MMP)of mice in various groups(n=4,±s,η/%)
∗P<0.05,∗∗P<0.01 compared with control group;△P<0.05 compared with low dose of benzene group;#P<0.01 compared with middle dose of bezene group.
Group Apoptotic rate MMP Control 4.40±0.60 23.27±3.01 Benzene Low dose 6.53±1.64 19.48±3.34 Middle dose 11.65±2.35∗∗16.30±1.72∗High dose 19.73±2.13∗∗△#15.64±0.27∗∗
2.3 各组小鼠骨髓细胞中凋亡相关蛋白的表达不同剂量苯染毒组小鼠骨髓细胞中Bax、CytC及中、高剂量苯染毒组小鼠骨髓细胞中Caspases-9 和Caspases-3阳性细胞数随染毒剂量的增加显著升高,与对照组比较差异均有统计学意义(Ρ<0.05或P<0.01),中和高剂量苯染毒组与低剂量苯染毒组比较差异有统计学意义(Ρ<0.05或P<0.01);而各剂量苯染毒组小鼠骨髓细胞中Bcl-2阳性细胞数则明显低于对照组(Ρ<0.01),且中和高剂量组与低剂量组比较差异有统计学意义(Ρ<0.05)。见表2。
3 讨论
细胞凋亡即细胞程序性死亡,可以由多个基因参与调控。细胞凋亡调节紊乱可引起细胞增生、分化或异常,从而导致疾病或肿瘤的发生。有研究[12-13]显示:细胞凋亡的发生与多通路的信号转导及Caspase级联反应有关。当细胞受到外界刺激后,可通过线粒体膜通道孔(MPTP)的开放,使线粒体膜电位下降,诱导Cyt C等细胞凋亡相关因子的释放,激活Caspase-9,继而活化Caspase-3,启动Caspase级联反应,引起细胞凋亡[14-15]。在这一过程中,Bcl-2家族蛋白对于MPTP的开放和关闭起着关键的调节作用。促凋亡类蛋白Bax等可以通过与线粒体内膜上的腺苷酸转运蛋白(ANT)或外膜上的电压依赖性阴离子通道(VDAC)结合介导MPTP的开放,促进Cyt C的释放;而抗凋亡类蛋白Bcl-2等则通过与Bax竞争性地与ANT结合或直接阻止Bax与ANT、VDAC的结合发挥其抗凋亡效应[16-17]。
表2 各组小鼠骨髓细胞中Bax、Caspases-9、Caspases-3、CytC和Bcl-2阳性细胞数Tab.2 Number of Bax,Caspases-9,Caspases-3,CytC and Bcl-2 positive cells in bone marrow cells of mice in various groups (n=5,±s,η/%)
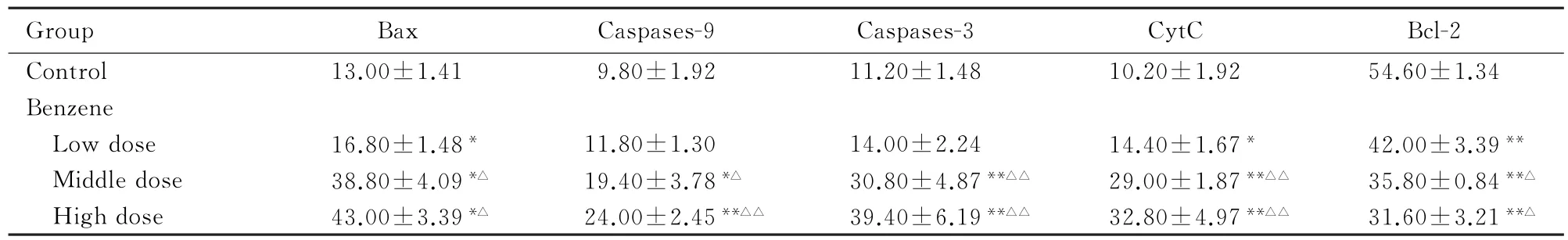
表2 各组小鼠骨髓细胞中Bax、Caspases-9、Caspases-3、CytC和Bcl-2阳性细胞数Tab.2 Number of Bax,Caspases-9,Caspases-3,CytC and Bcl-2 positive cells in bone marrow cells of mice in various groups (n=5,±s,η/%)
∗P<0.05,∗∗P<0.01 compared with control group;△P<0.05,△△P<0.01 compared with low dose of benzene group.
Group Bax Caspases-9 Caspases-3 CytC Bcl-2 Control 13.00±1.41 9.80±1.92 11.20±1.48 10.20±1.92 54.60±1.34 Benzene Low dose 16.80±1.48∗11.80±1.30 14.00±2.24 14.40±1.67∗42.00±3.39∗∗Middle dose 38.80±4.09∗△19.40±3.78∗△30.80±4.87∗∗△△29.00±1.87∗∗△△35.80±0.84∗∗△High dose 43.00±3.39∗△24.00±2.45∗∗△△39.40±6.19∗∗△△32.80±4.97∗∗△△31.60±3.21∗∗△
本研究结果表明:一定剂量的苯可以降低线粒体膜电位,诱导骨髓细胞发生凋亡。苯作为化学物质,对机体的刺激被细胞接受后,细胞可以将这些信号进行整合,通过细胞凋亡信号与特异性受体结合成复合物,激活Caspase,促使其对特异性底物进行降解,导致凋亡抑制失活,引起细胞凋亡。本研究采用免疫细胞化学方法检测小鼠骨髓细胞中凋亡相关蛋白CytC、Bax、Bcl-2、Caspase-9和Caspase-3蛋白表达的结果显示:一定剂量的苯可以诱导骨髓细胞凋亡相关蛋白的表达,使Cyt C、Bax、Caspase-9和Caspase-3阳性细胞数升高,而Bcl-2阳性细胞数降低。本研究结果表明线粒体凋亡通路参与了苯诱导的小鼠骨髓细胞凋亡,这可能是苯引起骨髓毒性的主要机制之一。
[1]Robert Schnatter A,Kerzic PJ,Zhou Y,et al.Peripheral blood effects in benzene-exposed workers[J].Chem Biol Interact,2010,184(1/2):174-181.
[2]Sorahan T.Occupational benzene exposure and lymphoma risks[J].Environ Health Perspect,2011,119(11):A468-469.
[3]Wong O,Harris F,Armstrong TW,et al.A hospital-based case-control study of acute myeloid leukemia in Shanghai: analysis of environmental and occupational risk factors by subtypes of the WHO classification[J].Chem Biol Interact, 2010,184(1/2):112-128.
[4]Vlaanderen J,Lan Q,Kromhout H,et al.Occupational benzene exposure and the risk of lymphoma subtypes:a metaanalysis of cohort studies incorporating three study quality dimensions[J].Environ Health Perspect,2011,119(2): 159-167.
[5]刘 扬,贺 今,刘 军.苯中毒细胞凋亡相关基因研究进展[J].职业与健康,2011,27(13):1542-1543.
[6]Zhang L,Mchale CM,Rothman N,et al.Systems biology of human benzene exposure[J].Chem Biol Interact,2010, 184(1/2):86-93.
[7]Peng D,Jiaxing W,Chunhui H,et al.Study on the cytogenetic changes induced by benzene and hydroquinone in human lymphocytes[J].Hum Exp Toxicol,2012, 31(4):322-335.
[8]Sappayatosok K,Maneerat Y,Swasdison S,et al.Expression of proinflammatory protein,iNOS,VEGF and COX2 in oral squamous cell carcinoma(OSCC),relationship with angiogenesis and their clinicopathological correlation[J].Med Oral Patol Oral Cir Bucal,2009,14(7):319-324.
[9]刘 军,王秀英.苯中毒患者骨髓单个核细胞凋亡调节基因的表达及其意义[J].新医学,2010,41(11):745-746.
[10]王志成,李艳博,郭 伟,等.低剂量电离辐射对小鼠睾丸生精细胞中活性氧活性和线粒体膜电位的影响[J].吉林大学学报:医学版,2007,33(5):786-789.
[11]龚守良.实用医学实验技术[M].长春:吉林科学技术出版社,1991:290.
[12]Fan XX,Li N,Wu JL,et al.Celastrol induces apoptosis in gefitinib-resistant non-small cell lung cancer cells via caspasesdependent pathways and Hsp90 client protein degradation[J].Molecules,2014,19(3):3508-3522.
[13]岳原亦,张 扬,张一奇.Caspase家族与细胞凋亡[J].中国医疗前沿,2011,6(6):25-26.
[14]周艺群,谷志远.线粒体与细胞凋亡[J].解剖科学进展, 2006,12(1):60-62.
[15]Ola MS,Nawaz M,Ahsan H.Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J].Mol Cell Biochem,2011,351(1/2):41-58.
[16]郎海滨.Bcl-2家族蛋白与线粒体凋亡路径研究进展[J].国外医学:卫生学分册,2004,31(2):88-91.
[17]Xu JY,Zhou M,Ouyang J,et al.Gambogic acid induces mitochondria-dependent apoptosis by modulation of Bcl-2 and Bax in mantle cell lymphoma JeKo-1 cells[J].Chin J Cancer Res,2013,25(2):183-191.
Induction effect of benzene on apoptosis of mouse bone marrow cells through mitochondrial-dependent apoptosis pathway and its mechanism
YU Guang-yan1,SONG Xiang-fu1,ZHAO Shu-hua1,LIU Xiao-mei1,SUN Zhi-wei1,2
(1.Department of Occupational and Environmental Health,School of Public Health,Jilin University, Changchun 130021,China;2.Department of Hygienic Toxicology,School of Public Health,Capital Medical University,Beijing 100069,China)
ObjectiveTo establish mouse poisoning model by inhaling benzene,and to investigate the induction effect of benzene on the apoptosis of mouse bone marrow cells and its mechanism,and to provide an experimental basis for study on bone marrow toxicity mechanism.Methods24 male mice were randomly divided into four groups (n=6).The mice in one group were exposed to ambient air(control group)and the mice in the other three groups were exposed to different doses(400,800,1 600 mg·m-3)of benzene(low,middle and high doses of benzenegroups)for 15 d in the respective inhalation chambers.At the end of the experiment,the mice were killed.The bone marrow of the mice was obtained.The pathological changes of the bone marrow cells of the mice in various groups were observed under light microscope with HE staining.The apoptotic rates and mitochondrial membrane potential(MMP)of the mice in various groups were detected by flow cytometry,and the expressions of mitochondrial-deperdent apoptosis related gene proteins were determined with immunohistochemistry method.ResultsThe number of distal and central cells in different doses of benzene groups were significantly reduced,and accompanied by blood sinus expansion in high dose of benzene group.The apoptotic rates of the cells in middle and high doses of benzene groups were obviously higher than that in control group(Ρ<0.01),and there were also significant differences between high dose group and low,middle doses of benzene groups(Ρ<0.05).The MMP was significantly decreased with the increasing of benzene doses,and there were significant differences between middle,high doses of benzene groups and control group(Ρ<0.05).The number of Bax,CytC positive cells in different doses of benzene groups and the number of Caspase-9,Caspase-3 positive cells in middle and high doses of benzene groups were significantly increased compared with control group(Ρ<0.05);the number of Bcl-2 positive cells in different doses of benzene groups was decreased(Ρ<0.05),and number of Bcl-2 positive cells in middle and high doses of benzene groups was decreased compared with low dose of benzene group(P<0.05).ConclusionBenzene with certain dose can induce the apoptosis of mouse bone marrow cells,and promote the expressions of mitochondrial apoptosis related gene proteins.Benzene-induced apoptosis through mitochondrialdependent apoptosis pathway may be an important mechanism of bone marrow toxicity induced by benzene.
benzene;apoptosis;mitochondrial membrane potential;apoptosis gene protein
R114;R363
A
2013-11-09
国家安监总局计划项目资助课题(08-067);中央高校基本科研业务费专项基金资助课题(450060481119)
于光艳(1976-),女,吉林省吉林市人,讲师,医学博士,主要从事工业及环境毒理学研究。
孙志伟(Tel:010-83911507,E-mail:zwsun@hotmail.com)
1671-587Ⅹ(2014)05-0943-04
10.13481/j.1671-587x.20140507

