石油降解单菌株及混合菌降解产物分析
花 莉, 彭香玉, 范 洋, 解井坤
(陕西科技大学 资源与环境学院, 陕西 西安 710021)
0 引言
石油是一种成分极其复杂的混合物,并且不同来源的原油的成分具有很大区别.石油中的烃类一般可分为两类:饱和烃类(直链烷烃、支链烷烃、环烷烃等)和不饱和烃类(烯烃、炔烃、单环芳烃、多环芳烃、杂环芳烃等)[1].微生物降解就是利用石油烃类作为碳源,经过一系列氧化、还原、分解、合成等生化作用,将石油污染物矿化转变为无害的无机物质CO2和 H2O的过程.
Kiesele[2]在研究细菌和霉菌对石油降解能力时,发现细菌Acinetobactercalcoaeticus只能降解C22~C30的石油烃并且对石油有乳化作用;而Serratiamarcescens只降解C20~C28的石油烃并且对石油具有较大吸附能力;霉菌Candidatropicalis能降解 C12~C32的石油物质,还具有较大的乳化石油的能力.
不同微生物对不同石油烃的成分有不同的降解能力,或者在降解过程中起着不同的作用.Lee等[3]研究发现环己烷能被Rhodococcussp. EC1降解;Chakraborty等[4]发现在提供硝酸盐电子受体情况下,DechloromonasRCB能降解苯;Cerqueira等[5]发现将多种能降解含油污泥的菌混合投加后降解效果有明显的提高.
基于石油组分的复杂性及单菌株降解物质的有限性,本文以中国石油化工集团公司0#柴油为唯一碳源,通过分析单菌株及其混合菌的降解代谢产物来研究石油烃的降解机制,从而为筛选功能微生物提供理论基础.
1 材料与方法
1.1 菌种来源
(1)居植物柔武士菌(Raoultellaplanticola),在 GenBank中序列登录号为KC753502,以下简称为R.planticola.
(2)粘质沙雷氏菌(Serratiamarcescens),在GenBank中序列登录号为KC753507,以下简称为S.marcescens.
(3)蜡状芽孢杆菌(Bacilluscereus),在GenBank中序列登录号为KC753503,以下简称为B.cereus.
(4)克雷伯氏菌(Klebsiellavariicola),在GenBank中序列登录号为KC753504,以下简称为K.variicola.
上述4株单菌,由本实验室从中国石油长庆石化公司附近的油泥中分离筛选鉴定所得.混合菌按照前期响应面优化混合菌配比实验结果配制,其中R.planticola、S.marcescens、B.cereus、K.variicola等的高浓度菌液(OD590=0.5)分别按接种量4%、2%、2%、2%等的比例组合.
1.2 培养基
(1)原油培养基[6]:(NH4)2SO45 g,KCl 1.1 g,NaCl 5 g,FeSO4·7H2O 0.028 g,KH2PO41.5 g,K2HPO41.5 g,MgSO4·7H2O 0.5 g,微量元素 5 mL,蒸馏水1 L,柴油 10 g,调pH 7.2,121 ℃灭菌20 min.
微量元素液成分( g· L-1) 包括ZnSO4·7H2O 0.29 g,CaCl20.24 g,CuSO4·5H2O 0.25 g,MgSO4·7H2O 0.17g.
(2)富集培养基[7]:蛋白胨10 g,酵母膏5 g, NaCl 10 g,蒸馏水1 L,调pH 为7.2,121 ℃灭菌20 min.
1.3 降解率的测定
将4单菌株及其混合菌制成菌悬液,以相同接种量加入到100 m L 原油培养基中,做3个平行试验,放入30 ℃摇床中( 转速为120 r·min-1) 培养5天,然后用重量法测定残余柴油的含量[8].以不接菌的培养液为对照,用四氯化碳回收残余原油,滤液过滤到已称重的圆底烧瓶中,除去菌悬液,旋蒸后干燥,称重,采用如下计算公式:
降解率=(m1-m2)/m1×100%
式中:m1为对照组的残油质量,g;m2为样品残油质量,g.
1.4 残油组分GC-MS分析
将残油萃取液用CCl4定容至100 mL,取1 mL移至进样瓶中用于GC-MS检测.GC-MS运行条件为:
(1)色谱条件[9]
色谱柱为 HP-5 ms 石英毛细管柱(30 m×0.25 mm×0.25μm);载气:He;进样模式:分流,分流比为 50∶1;采样时间:1.00 min;柱前压:8.2 psi;进样口温度:250 ℃;起始温度:60 ℃,保持 2.0 min,以 20.0 ℃·min-1升至 300 ℃,保持 10 min;进样量 1μL.
(2)质谱条件
传输线温度:250 ℃;阱温:220 ℃;电离方式:EI;电离能:70 eV;扫描模式:全扫描;扫描质量范围:2~1 050 amu.
2 结果与讨论
2.1 单菌株和混合菌的降解比较
以柴油为唯一碳源,在5天的降解实验中,各单菌株及混合菌对柴油降解效率如图1所示,依次为:混合菌>K.variicola>B.cereus>S.marcescens>R.planticola.在投加单一菌时,R.planticola、S.marcescens、B.cereus、K.variicola等的降解率均不高,分别为41.83%、48.39%、49.29% 和54.87%.混合菌的降解率为64.27%,比单菌株降解更为有效.
实验所用的柴油成分复杂,包括烷烃、烯烃、环烷烃、芳香烃和多环芳烃等.一种细菌可能只对其中的某种或有限的几种组分起作用,因而对不同类污染物的利用具有一定的局限性.Mukred 等[10]研究表明,混合菌能降解长链脂肪族化合物,而单菌株只能降解短链或中长链的脂肪族化合物;叶淑红等[11]发现混合菌在石油烃的降解中能够充分发挥各菌种之间的协同作用,比单菌株降解更为有效.
因此,为了更深入地了解单菌株及混合菌在降解石油烃中发挥的作用及其降解途径,本论文对单菌株及混合菌培养5天后的降解产物进行了GC-MS分析.

图1 单菌株及混合菌对柴油的降解
2.2 降解代谢产物分析
经GC-MS分析,得到了单菌株及混合菌降解产物总离子流色谱图(见图2所示).气相色谱分离后的各峰经质谱扫描后得到质谱图,经过质谱计算机数据系统检索,并查对有关质谱和气相色谱资料,综合各项分析并对各色谱峰加以确认.选定的不加菌对照组的6种主要组分如图2(a)所示,以此来研究单菌株及混合菌对柴油的降解途径.
2.2.1 支链烯醇的降解
微生物降解直链烷烃时,可对单末端、双末端和次末端进行氧化.降解过程为:石油降解菌将直链烷烃氧化为醇,醇经过脱氢酶氧化变为醛,醛氧化变为脂肪酸,脂肪酸通过β-氧化降解为乙酰辅酶A,后者或进入三羧酸循环,分解成CO2和H2O,并释放出能量,或进入其他生化过程[12].
支链烷烃与直链烷烃降解途径相似.但相对于直链烷烃而言,支链的存在会增加微生物氧化降解的阻力.这是因为氧化分解的部位主要是在直链上发生,而靠近侧链的一端较难发生氧化反应.烷烃的支链降低了分解速率,使含有支链结构的烃类降解速度慢于相同碳数的直链烃类[13].

(a) 不加菌对照组图谱 (b) R.planticola降解产物图谱

(c) S.marcescens降解产物图谱 (d) B.cereus降解产物图谱

(e) K.variicola降解产物图谱 (f) 混合菌降解产物图谱图2 单菌株及混合菌降解产物GC-MS图谱
针对图2(a)中11.615 min出现带有甲基支链的Z,Z-2-甲基-3,13-十八碳二烯醇(2-Methyl-Z,Z-3,13-octadecadienol),经过5天培养,在R.planticola和K.variicola降解产物中只发现(Z,Z)-9,12-十八碳二烯酸(9,12-Octadecadienoic acid (Z,Z)-).故可推测支链烯烃醇的微生物降解途径与支链烷烃相似,可能先脱除甲基的支链,减少微生物氧化降解阻力,然后使原来靠近侧链一端的羟基能发生与直链烷烃相似的氧化途径,氧化为羧基并产生某些双键的位移.当混合菌中发现中间产物Z,E-3,13-十八碳二烯醇(Z,E-3,13-Octadecadien-1-ol)时,可以肯定R.planticola和K.variicola具有脱烷基作用,能加速石油中支链烃的降解.

2.2.2 (Z)-9-十八烯醛的降解
由图2(c)15.060 min和图2(d)14.735 min降解产物中丙二醇-油酸酯(Propyleneglycol monoleate)的出现可知,S.marcescens、B.cereus及混合菌等具有把醛基氧化为羧酸的功能.

2.2.3 烯烃的降解
对于水油两相反应,长链烯烃因其较差的水溶性而使反应活性较差,因此,通常利用表面活性剂形成的胶束作用来增加烯烃的水溶性,同时烯烃增溶到胶束中后,有利于在末端双键参与配位而引入羰基[14].
不同微生物对1-十六碳烯(1-Hexadecene)降解程度不同.由图2(c)14.206 min可知S.marcescens只能双键发生位移生成内烯烃的中间产物(顺-11-十六碳烯醛);图2(b)13.936 min发现R.planticola能在此基础上继续脱氢生成二烯烃中间产物(顺,顺-7,10-十六碳二烯醛);分别在图2(d)、图2(e)和图2(f)中依次有B.cereus、K.variicola及混合菌能生成终产物15-甲基-11-十六烯酸甲酯.单菌株与混合菌降解产物都被引入羰基,说明可能存在表面活性剂的促进作用,这与前期研究4种单菌株都具有较强的产表面活性剂能力相符[15].
Schink[16]在不饱和烃的厌氧降解开拓性研究中,检测到了1-十六碳烯矿化产物醋酸盐.这与本研究中B.cereus降解产物中发现乙酸酐相类似.Grossi等[17]发现在硫酸盐还原菌(D.aliphaticivorans)厌氧作用下会氧化1-十六碳烯C-1处的双键形成伯醇,并在C-2,C-3,或在饱和端近顶端碳[C-(ω-1)]上增加碳单元形成带甲基的支链.在降解产物中发现B.cereus和K.variicola能使终产物近顶端碳甲基化,可说明B.cereus和K.variicola可能有厌氧条件下降解1-十六碳烯的潜力.

1-十九碳烯(1-Nonadecene)能分别在R.planticola、S.marcescens及K.variicola等作用下转化为Z-4-十九烯醇乙酸酯(Z-4-Nonadecen-1-ol acetate).这说明上述单菌株可能先将烯烃代谢为不饱和醇后产生某些双键的位移.但在图2(d)和图2(f)中没有发现降解产物,可能是由于B.cereus的抑制作用导致,混合菌中没有发现1-十九碳烯降解.

2.2.4 炔烃的降解
Tavassoli等[18]利用原油中分离的微生物降解沥青质,培养20天后,沥青质红外光谱分析中C≡C峰消失.而本研究中图2(e)14.470 minK.variicola及图2(f)15.217 min混合菌培养5天后其降解产物中都发现有Z-6-十五烯醇-乙酸酯,而其它单菌株中未发现降解产物.这说明K.variicola可以用于短期内降解沥青质,减轻油田生产过程中沥青质引起的堵塞油井、出油管线及地面设施等现象.

2.2.5 环烷烃的降解
环烷烃在石油馏份中占有较大比例.对于不含支链的环烷烃的降解,其与链烃的次末端降解途径相似:首先氧化产生环烷醇,接着脱氢得酮,然后氧化得内酯,或直接开环,生成脂肪酸[19].实际上,B.cereus和K.variicola纯培养5天后降解图谱检测出13-十四碳烯-1-醇乙酸酯,如图2(d)14.167 min和图2(e)14.156 min所示.可推测环十四烷先被氧化成环烷醇,然后在临近的β位发生C-C键断裂形成烯醇,接着与游离的醋酸形成酯盐.混合菌中可能受到环烷烃的抑制作用而未发现此降解产物.

单菌株及混合菌对6种物质的降解情况,如表1所示.K.variicola可以降解列举物质中的5种,属于优势菌种.单菌株及混合菌株对1-十六碳烯都有一定程度地降解,B.cereus和混合菌中却未发现1-十九碳烯降解产物,这说明同种类型烯烃中,分子量越大越难被微生物利用.
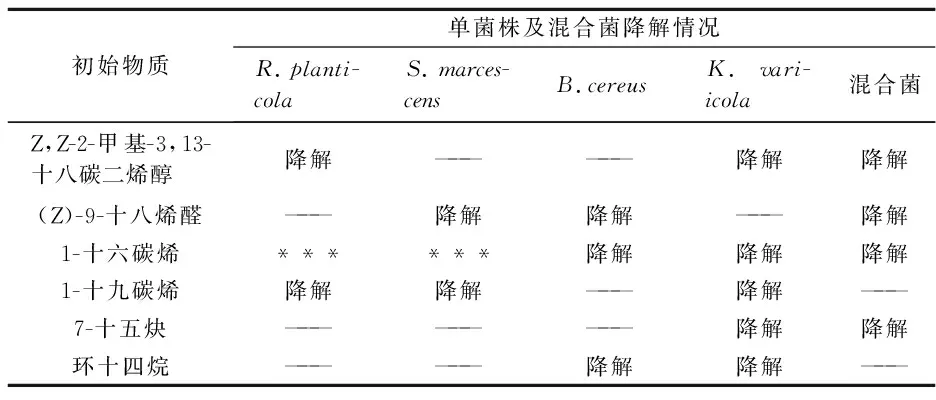
表1 单菌株及混合菌对6种物质降解情况
注:—— 表示未发现降解产物; ***表示中间体.
3 结论
在以柴油为唯一碳源的培养基中,K.variicola是优势菌种,培养5天降解率高达54.87%;R.planticola降解率最低,仅为41.83%;混合菌株降解率为64.27%,相比单菌株的降解率,有明显地提高.
从4种单菌株及混合菌不同程度地降解1-十六碳烯可知,1-十六碳烯的氧化代谢途径为:菌株首先把1-十六碳烯末端氧化并产生双键位移,生成顺-11-十六碳醛或顺-7-十六碳醛,然后经历脱氢酶作用生成顺,顺-7,10-十六碳二烯醛,最后被氧化和甲基化为15-甲基-11-十六烯酸甲酯.
不同微生物对不同石油烃的成分具有不同的降解能力.R.planticola和K.variicola具有脱烷基功能,对一定的支链烃有降解效果;S.marcescens和B.cereus能氧化不饱和醛基;R.planticola和S.marcescens只能初步氧化1-十六烯,而B.cereus和K.variicola可以氧化1-十六烯为终产物羧酸;R.planticola、S.marcescens和K.variicola可以降解1-十九碳烯;K.variicola可以降解炔烃,其它3种单菌株均无此功能;B.cereus和K.variicola可以降解环烷烃.
[1]Shah K.Petroleum hydrocarbon pollution and its biodegradation[J].International Journal of Chemtech Applications,2013,2(3):63-68.
[2]Kiesele L U.Efficient and cost-effective purification of groundw ater polluted by polycyclic aromatic hydroearbons experience with a cokeplant hazardous waste site[J].Altlasten Spektrum,1997,6(5):214-217.
[3]Yi T,Lee E H,Ahn Y G,et al.Novel biodegradation pathways of cyclohexane by rhodococcus sp.EC1[J].Journal of Hazardous Materials,2011,191(1):393-396.
[4]Chakraborty R,O Connor S M,Chan E,et al.Anaerobic degradation of benzene,toluene,ethylbenzene,and xylene compounds by Dechloromonas strain RCB[J].Applied and Environmental Microbiology,2005,71(12):8 649-8 655.
[5]Cerqueira V S,Hollenbach E B,Maboni F,et al.Biodegradation potential of oily sludge by pure and mixed bacterial cultures[J].Bioresource Technology,2011,102(23):11 003-1 1010.
[6]王 鑫,郭书海,孙铁珩,等.稠油高效降解菌的降解特性及其应用[J].环境工程学报,2009,3(4):586-590.
[7]肖 兵,杨德玉,史荣久,等.一株高效表面活性剂产生菌的筛选及其活性产物的结构与性质[J].生态学杂志,2013,32(3):779-786.
[8]崔志松,郑 立,杨佰娟,等.两种海洋专性解烃菌降解石油的协同效应[J].微生物学报,2010,50(3):350-359.
[9]Zhang L,Shen C,Liu R.GC-MS and FI-IR analysis of the bio-oil with addition of ethyl acetate during storage[J].Bioenergy and Biofuels,2014,2(3):1-6.
[10]Mukred A M,Hamid A A,Hamzah A,et al.Development of three bacteria consortium for the bioremediation of crude petroleum-oil in contaminated Water[J].OnLine Journal of Biological Sciences,2008,8(4):73-79.
[11]叶淑红,丁 鸣,马 达,等.微生物修复辽东湾油污染湿地研究[J].环境科学,2005,26(5):143-146.
[12]宋志文,夏文香,曹 军.海洋石油污染物的微生物降解与生物修复[J].生态学杂志,2014,23(3):99-102.
[13]张信芳.海洋石油污染的微生物降解过程及生态修复技术展望[J].环境科学与管理,2012,37(5):97-99.
[14]何珍红,侯震山,王永垒,等.水溶性钯膦络合物催化 1-辛烯的氢羧基化反应[J].分子催化,2011,25(5):406-414.
[15]花 莉,洛晶晶,彭香玉,等.产表面活性剂降解石油菌株产物性质及降解性能研究[J].生态环境学报,2013,22(12):1 945-1 950
[16]Schink B.Degradation of unsaturated hydrocarbons by methanogenic enrichment cultures[J].FEMS Microbiology Letters,1985,31(2):69-77.
[17]Grossi V,Cravo Laureau C,Méou A,et al.Anaerobic 1-alkene metabolism by the alkane-and alkene-degrading sulfate reducer desulfatibacillum aliphaticivorans strain CV2803T[J].Applied and environmental microbiology,2007,73(24):7 882-7 890.
[18]Tavassoli T,Mousavi S M,Shojaosadati S A,et al.Asphaltene biodegradation using microorganisms isolated from oil samples[J].Fuel,2012,93:142-148.
[19]张光军,方 萍.红球菌在石油烃类物质降解中的作用[J].环境科学与技术,2013,36(2):93-99.

