烟气汞液相脱除试验及传质-反应动力学研究
石 宙, 吴 江, 何 平, 代学伟, 张帅博, 邬 宇
(上海电力学院 能源与机械工程学院,上海200090)
由于汞(Hg)具有剧毒性,对人体健康危害较大,燃煤烟气汞作为污染物引起越来越多的关注[1].美国环保署(EPA)确定燃煤电厂排放的汞对公众健康造成巨大危害[2],约占美国人为汞排放量的三分之一,并于2011年颁布了严格的燃煤电厂烟气汞排放标准,我国也于2011年颁布了燃煤电厂烟气汞排放标准(限值0.03mg/m3[3]).在燃煤烟气中,汞的存在形态有3种:零价元素汞(Hg0)、氧化态汞(Hg2+)和颗粒态汞(HgP).其中,Hg0为主要形态,且最难脱除[4].燃煤电厂现有大气污染物减排技术与设备(如静电除尘器(ESP)、布袋除尘器(FF)和烟气湿法脱硫系统(WFGD))对Hg2+和 HgP具有一定的脱除效果,但是对Hg0的脱除效果较差.
WFGD可以捕获近90%的Hg2+,与活性炭喷射技术相比,在达到相同水平汞脱除率时,利用WFGD脱汞被认为具有更好的经济效益[5-7].WFGD较高的Hg2+脱除率表明,将Hg0氧化为Hg2+将有助于利用WFGD提高燃煤电厂烟气汞的总体脱除率.因此,许多学者开始关注将Hg0氧化为Hg2+的技术,并希望在WFGD中实现Hg0、SO2和NO的联合脱除[5].常用的氧化剂有 KMnO4、K2S2O8、Fenton、NaClO、NaClO2和 H2O2等[8-10],学者们曾采用不同氧化剂进行了烟气汞脱除性能的研究.赵毅等[10]以NaClO2溶液作为吸收剂,利用鼓泡反应器进行了单质汞的吸收试验,结果表明:酸性NaClO2溶液可实现72.9%的 Hg0脱除效率.Xu等[9]以Ag+和Cu2+作为催化剂,利用鼓泡反应器进行了K2S2O8溶液氧化并吸收气相Hg0的试验,结果表明:随着K2S2O8溶液浓度的增加及 Ag+、Cu2+催化剂剂量的增加,Hg0的脱除效率呈升高趋势,且Cu2+的催化效果好于Ag+.另外,其研究还表明高温会对氧化产生不利影响,在中性条件下Hg0的脱除效果好于酸性或碱性条件下,在Ag+、Cu2+存在的条件下,pH值的影响可以忽略,较高的Hg0入口浓度也会使得 Hg0更易脱除.Fang等[8]采用氧化剂对汞的氧化进行了研究,认为氧化剂对烟气汞脱除效果的排序为KMnO4>NaClO2>NaClO>K2S2O8>H2O2.KMnO4溶液是强化剂,能与多种无机物和有机物发生反应,美国EPA方法29中用于吸收汞的吸收剂为KMnO4溶液[11],燃煤烟气汞OHM(Ontari Hydro Method,安大略方法,美国EPA推荐的烟气汞采样标准方法)采样过程中也采用KMnO4作为元素汞的吸收溶液[12],针对其降解有机物方面也有较多研究[13].但是到目前为止,有关Hg0与KMnO4反应机理的研究文献还比较少[5,10].
笔者对不同条件下Hg0在鼓泡反应器中的脱除进行了试验研究,探讨了Hg0与KMnO4的反应机理.
1 试验部分
1.1 试验试剂及装置
采用的试剂:高锰酸钾(KMnO4),分析纯;浓硫酸(H2SO4),分析纯;氢氧化钠(NaOH),分析纯.试剂均购自上海沪华玻璃仪器有限公司,未进行进一步纯化处理.
试验装置如图1所示,作为模拟烟气的压缩空气被分为2路,其流量分别由质量流量计(CS200型)控制,总体积流量保持在1.7L/min.其中,体积流量为0.2L/min的一路气体作为载气进入U形玻璃管,将汞渗透管挥发出的零价元素汞(Hg0)携带出来,与另一路气体在混气罐中均匀混合.从混气罐出来的气体经三通阀和二通阀的调节后分别进入鼓泡反应器和旁路,反应后的气体或旁路气体经过2个硅胶瓶干燥后进入VM3000型烟气在线测汞仪(德国Mercury Instruments),分析完的气体经过尾气吸收瓶后排空.试验系统中的管路全部采用Teflon(特氟龙)管.
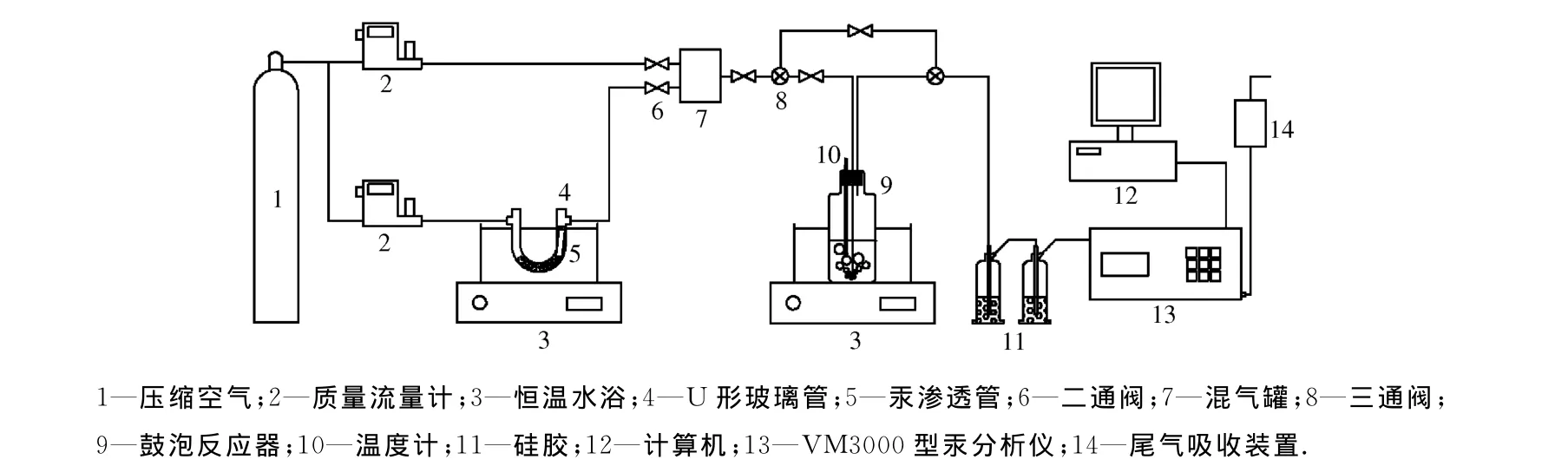
图1 零价元素汞液相脱除试验系统示意图Fig.1 Experimental setup for Hg0removal by KMnO4solution
1.2 试验方法
称取一定质量的高锰酸钾(KMnO4),将其溶解,测定其初始pH值.在溶液中加入0.05mol/L的H2SO4溶液或0.1mol/L的NaOH溶液来调节KMnO4溶液的pH值,使其达到试验所需pH值.汞渗透管在不同的水浴温度下产生不同质量浓度的汞,分别设定汞发生装置和鼓泡反应器的水浴温度至试验所需值,保持旁路二通阀打开,反应器支路的二通阀关闭.待汞质量浓度值稳定后,试验开始,取200mL反应液通过一次加液的方法加入鼓泡反应器中,打开反应器支路的二通阀,并关闭旁路阀门,同时开始计时,汞质量浓度值由汞分析仪测量后输出至计算机.进、出口Hg0质量浓度采用VM3000型烟气在线测汞仪测定.
Hg0脱除率的计算如下
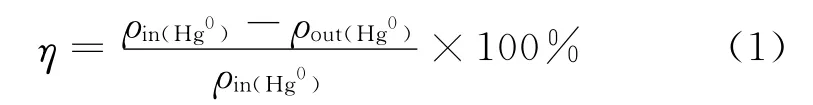
式中:ρin(Hg0)为反应器入口 Hg0的质量浓度,μg/m3;ρout(Hg0)为反应器出口 Hg0的质量浓度,μg/m3.
2 结果与讨论
2.1 KMnO4溶液初始浓度对Hg0脱除率的影响
在气体体积流量为1.7L/min、汞渗透管温度t1为55℃、反应器温度t2为55℃及KMnO4溶液初始pH值为6.32的条件下,考察了KMnO4溶液初始浓度对Hg0脱除率η的影响,结果见图2.由图2可知,当KMnO4溶液初始浓度分别为0.05 mmol/L、0.50mmol/L、2.50mmol/L、5.00mmol/L和25.00mmol/L时,在各组试验进行大约20 min后,Hg0的脱除率η分别达到20.6%、36.2%、78.7%、100%和100%;在各组试验进行1h后,Hg0的脱除率η分别达到22.1%、38.4%、88.4%、100%和100%.Hg0脱除率η随着KMnO4溶液初始浓度的升高而逐渐升高,且随着KMnO4溶液初始浓度的升高,Hg0氧化脱除速率也呈增长趋势.这可能是由于当KMnO4溶液初始浓度升高时,Hg0与KMnO4之间的碰撞增加[8],气相传质阻力减小,从而提高了Hg0的脱除率.气相传质阻力与气液相传质系数比有关,气液相传质系数比的计算结果将在下文讨论.
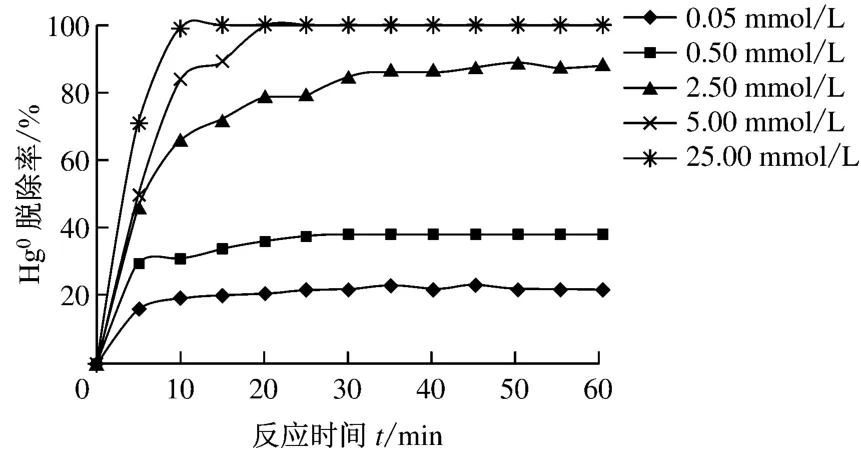
图2 KMnO4溶液初始浓度对Hg0脱除率的影响Fig.2 Effect of initial KMnO4concentration on the Hg0 removal efficiency
2.2 pH值对Hg0脱除率的影响
在气体体积流量为1.7L/min、汞渗透管温度t1为55℃、反应器温度t2为55℃及KMnO4溶液初始浓度为0.05mmol/L的条件下,考察了KMnO4溶液pH值对Hg0脱除率η的影响.由前面试验结果可知,当KMnO4溶液初始浓度为25.00 mmol/L时,Hg0的脱除率最高,为100%,改变pH值对Hg0脱除率基本没影响;而当KMnO4溶液初始浓度为0.05mmol/L时,Hg0脱除率最小,为避免过量的KMnO4对本组试验产生干扰,故选取KMnO4溶液初始浓度为0.05mmol/L.图3给出了pH值对Hg0脱除率的影响.由图3可以看出,当pH值为1.08时,Hg0脱除率最高,为69.3%;当pH 值分 别 取2.00、3.91、5.89、7.11、8.16、9.95、10.91 和11.80时,Hg0脱除率分别为 34.4%、26.9%、24.6%、22.1%、24.1%、22.9%、19.9% 和19.2%.可见,在pH值小于11.80时,随着pH值的升高,Hg0脱除率呈下降趋势,但是当pH值进一步升高到12.94时,Hg0脱除率又有所上升,为28.5%.其原因可能是在强碱条件下KMnO4将溶液中的OH-氧化为羟基自由基·OH[11],而·OH具有强氧化性,可将Hg0氧化脱除.
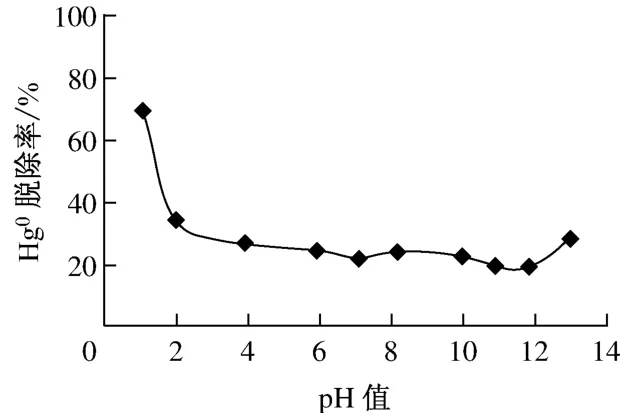
图3 pH值对Hg0脱除率的影响Fig.3 Effect of pH value on the Hg0removal efficiency
在不同pH值条件下,Hg0的脱除率不同,这是由于不同pH值条件下Hg0与KMnO4发生不同反应,KMnO4转移的电子数和相应的标准电势也不同.根据试验结果和文献资料,Hg0与KMnO4可能发生的反应如下[8,14]:
在强酸性条件(pH≤3.5)下,MnO-4|Mn2+标准电极电势为EΘ=1.51V,Hg0与KMnO4发生如下反应

在弱酸性条件(3.5<pH≤7.0)下,MnO-4|MnO2标准电极电势为EΘ= 1.68V,Hg0与KMnO4发生如下反应

在中性或弱酸性条件(7.0<pH≤12.0)下,MnO-4|MnO2的标准电极电势为EΘ=0.588V,Hg0与KMnO4发生如下反应
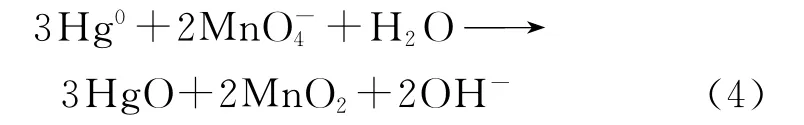
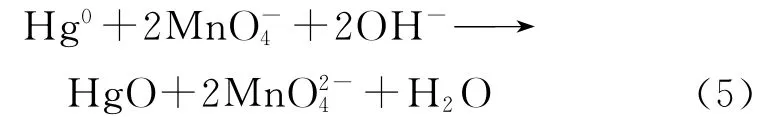
对于任一半电池反应,能斯特方程[15]如下
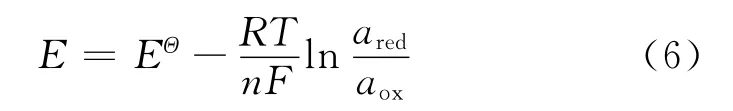
式中:EΘ为标准电极电势,V;R为理想气体常数8.314 472J/(K·mol);T 为绝对温度,K;n为电极反应中电子转移物质的量,mol;F为法拉第常数96.487kJ/(V·mol);a为氧化型和还原型物质的活度;下标red表示还原型物质;下标ox表示氧化型物质.
在常温(25℃)下,有以下关系式
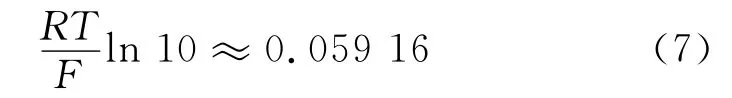
因此,能斯特方程可简化为
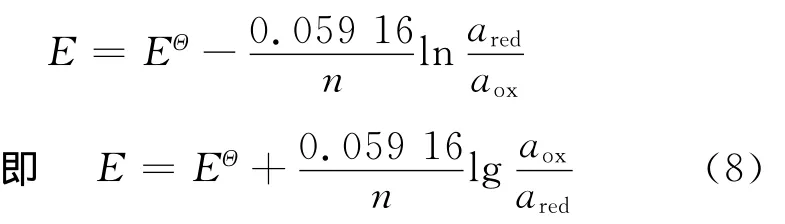
根据式(2)~式(8)可得不同pH值条件下电极电势E的计算式如下:
当pH≤3.5时
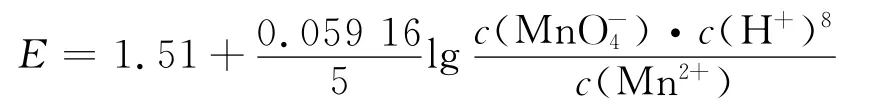
当3.5<pH≤7.0时
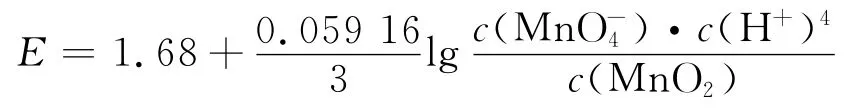
当7.0<pH≤12.0时
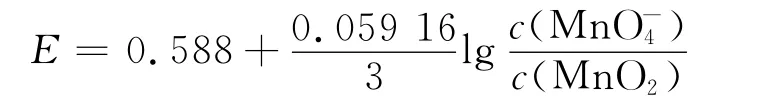
当pH>12.0时
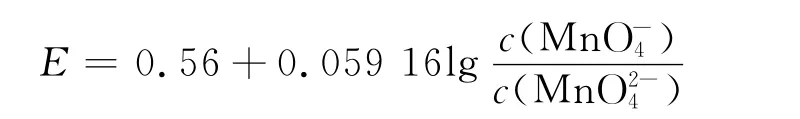
由此可见,KMnO4电极电势随着H+浓度的增加而增加,因此在强酸性条件下Hg0的脱除率比在中性和强碱性条件下高.
2.3 反应温度对Hg0脱除率的影响
在气体体积流量为1.7L/min、汞渗透管温度为55℃、KMnO4溶液初始pH值为6.32、KMnO4溶液初始浓度为0.50mmol/L的条件下,考察了反应温度对Hg0脱除率η的影响,结果示于图4.由图4可见,当反应温度t2由25℃升高至55℃时,Hg0脱除率由52.9%下降至38.8%,可见反应温度的升高对Hg0的氧化脱除具有不利影响.其原因可能是由于反应温度升高,导致液相传质阻力增大,使得Hg0的脱除率降低.
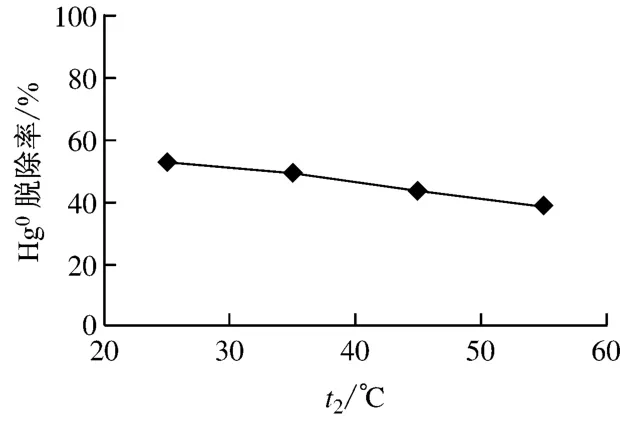
图4 反应温度对Hg0脱除率的影响Fig.4 Effect of reaction temperature on the Hg0removal efficiency
3 传质-反应动力学研究
为进一步验证KMnO4溶液氧化吸收Hg0的特性,根据试验数据进行了传质-反应动力学研究.
3.1 传质-反应动力学理论
3.1.1 Hg0吸收速度N(Hg0)
根据试验得到的Hg0脱除率和气相质量平衡,得到Hg0的吸收速度为[16]

式中:Q为气体体积流量,L/min;M 为Hg0的相对分子质量,200.59;A 为气液比相界面积,1/m;V 为吸收液的体积,mL.
3.1.2 气相传质系数 KG(Hg0)
气相传质系数计算式[17]如下
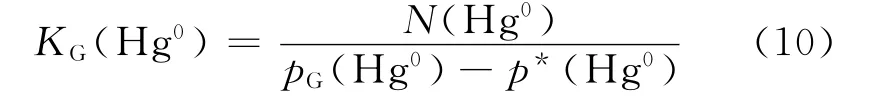
式中:p*(Hg0)为与液相主体中 Hg0的浓度cL(Hg0)相平衡的气相分压,Pa;pG(Hg0)为气相主体中Hg0的分压,Pa.
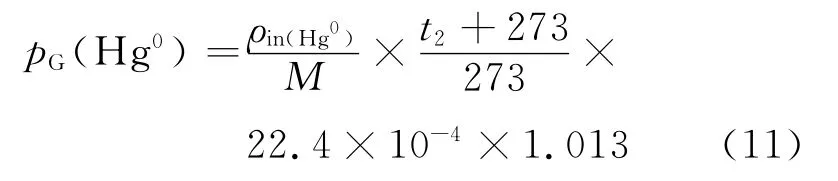
3.1.3 反应增强因子E
反应增强因子的计算式[16]如下
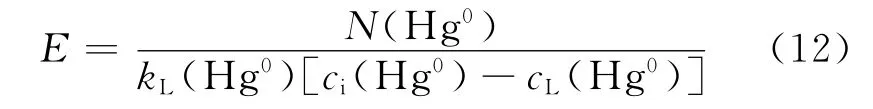
式中:kL(Hg0)为 Hg0在水中的液相传质系数,m/s;cL(Hg0)为液相主体中 Hg0的浓度,mol/m3;ci(Hg0)为相界面处 Hg0的浓度,mol/m3.
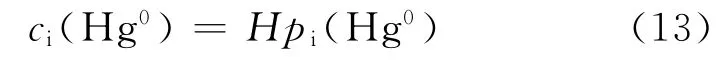
式中:H 为 Hg0的溶解度系数,mol/(Pa·L);pi(Hg0)为相界面处 Hg0的分压,Pa.
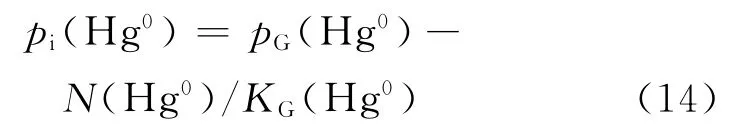
式中:KG(Hg0)为Hg0在N2中的气相传质系数,mol/(s·m2·Pa).
3.2 计算结果与讨论
反应溶液中 KMnO4过量,故cL(Hg0)=0,p*(Hg0)=0,其他参数见表1[14,17-19].
根据试验结果,计算相关动力学参数,求解方法为:反应温度取328K时,KMnO4溶液初始浓度取值为0.05mmol/L、0.50mmol/L、2.50mmol/L、5.00mmol/L和25.00mmol/L,反应温度取298K时,KMnO4溶液初始浓度取0.50mmol/L,将表1中数值和反应温度以及KMnO4溶液初始浓度带入式(9)~式(14),求得的结果见表2.由表2可知,随着KMnO4溶液初始浓度的升高,反应增强因子E、Hg0吸收速度N(Hg0)和Hg0的气液相传质系数比KG/kL均增大.反应增强因子E增大,表明化学反应对传质吸收的影响增大;Hg0的气液相传质系数比KG/kL增大,表明液膜阻力减小.反应温度t2升高,反应增强因子E增大,但Hg0的气液相传质系数比KG/kL减小,表明反应温度升高,增大了液膜阻力,不利于KMnO4吸收Hg0反应的进行,从而导致Hg0脱除率降低.

表1 Hg0的物性参数和传质参数Tab.1 Physical property parameters and mass transfer parameters of Hg0
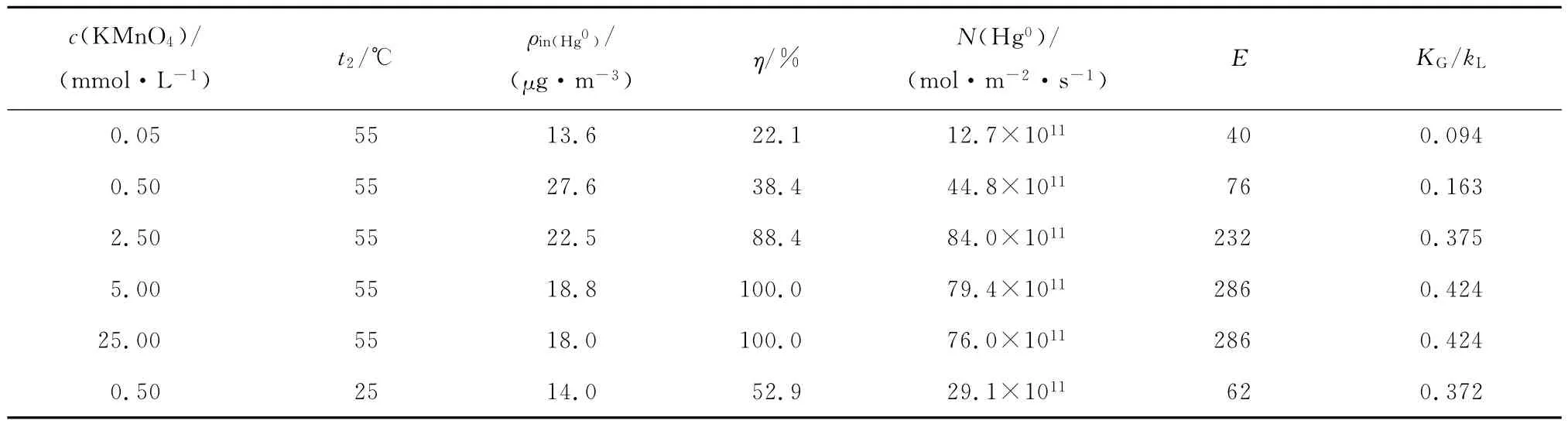
表2 传质-反应动力学计算结果Tab.2 Calculation results of relevant mass transfer-reaction kinetic parameters
4 结 论
(1)采用KMnO4溶液作为吸收液进行模拟烟气Hg0吸收脱除试验时,KMnO4溶液的初始浓度、pH值和反应温度是影响Hg0脱除率的重要因素,提高KMnO4溶液初始浓度和降低pH值均可提高Hg0的脱除率,提高反应温度不利于Hg0的脱除.
(2)Hg0与KMnO4的反应为复杂的气液传质反应过程,提高KMnO4溶液初始浓度,反应增强因子E和Hg0的气液相传质系数比KG/kL增大,表明化学反应对传质吸收的影响增大且液膜阻力减小,从而使Hg0脱除率提高;提高反应温度,Hg0的气液相传质系数比KG/kL减小,表明温度升高,增大了液膜阻力,不利于反应的进行,从而导致Hg0脱除率降低.
[1]WO Jingjing,ZHANG Meng,CHENG Xiaoya,et al.Hg2+reduction and re-emission from simulated wet flue gas desulfurization liquors[J].Journal of Hazardous Materials,2009,172(2/3):1106-1110.
[2]OMINE Naruhito,ROMERO Carlos E,KIKKAWA Hirofumi,et al.Study of elemental mercury re-emission in a simulated wet scrubber[J].Fuel,2012,91(1):93-101.
[3]环境保护部.GB 13223—2011火电厂大气污染物排放标准[S].北京:中国环境科学出版社,2011.
[4]GALBREATH Kevin C,ZYGARLICKE Christopher J.Mercury speciation in coal combustion and gasification flue gases[J].Environmental Science & Technology,1996,30(8):2421-2426.
[5]HOU Jiaai,SUN Mingyang,SHAMS Ali Baig,et al.Effect of heavy metals on the stabilization of mercury(II)by DTCR in desulfurization solutions[J].Journal of Hazardous Materials,2012,217-218:224-230.
[6]NOLAN Paul S,REDINGER Kevin E,AMRHEIN Gerald T,et al.Demonstration of additive use for enhanced mercury emissions control in wet FGD systems[J].Fuel Processing Technology,2004,85(6/7):587-600.
[7]王鹏,吴江,任建兴,等.飞灰未燃尽碳对吸附烟气汞影响的试验研究[J].动力工程学报,2012,32(4):332-337.WANG Peng,WU Jiang,REN Jianxing,et al.Experimental study on influence of unburned carbon in fly ash on mercury adsorption in flue gas[J].Journal of Chinese Society of Power Engineering,2012,32(4):332-337.
[8]FANG Ping,CEN Chaoping,TANG Zijun.Experimental study on the oxidative absorption of Hg0by KMnO4solution[J].Chemical Engineering Journal,2012,198-199(1):95-102.
[9]XU Xinhua,YE Qunfeng,TANG Tingmei,et al.Hg0oxidative absorption by K2S2O8solution catalyzed by Ag+and Cu2+[J].Journal of Hazardous Materials,2008,158(2/3):410-416.
[10]赵毅,刘松涛,要杰,等.亚氯酸钠溶液脱除Hg0及传质-反应动力学研究[J].中国科学:技术科学,2010,40(5):532-539.ZHAO Yi,LIU Songtao,YAO Jie,et al.Sodium chlorite solution removal of Hg0and mass transfer-reaction kinetics study[J].Scientia Sinica:Technologica,2010,40(5):532-539.
[11]HARA N.Capture of mercury vapor in air with potassium permanganate solution[J].Industrial Health,1995,13(6):243-251.
[12]卢平,吴江,潘伟平.860MW煤粉锅炉汞排放及其形态分布的研究[J].动力工程,2009,29(11):1067-1072.LU Ping,WU Jiang,PAN Weiping.Mercury emission and its speciation from flue gas of a 860MW pulverized coal-fired boiler[J].Journal of Power Engineering,2009,29(11):1067-1072.
[13]HUANG Kunchang,HOAG G E,CHHEDA P,et al.Chemical of oxidation of trichloroethylene with potassium permanganate in a porous medium[J].Advances in Environmental Research,2002,7(1):217-229.
[14]叶群峰,王成云,徐新华,等.高锰酸钾吸收气态汞的传质-反应研究[J].浙江大学学报:工学版,2007,41(5):831-870.YE Qunfeng,WANG Chengyun,XU Xinhua,et al.Mass transfer-reaction of Hg0absorption in potassium permanganate[J].Journal of Zhejiang University:Engineering Science,2007,41(5):831-870.
[15]傅献彩.物理化学[M].北京:人民教育出版社,2005.
[16]叶群峰.吸收法脱除模拟烟气中气态汞的研究[D].杭州:浙江大学,2006.
[17]CLEVER H L,JOHNSON S A,DERRICK M E.Solubility of mercury and mercury salts in water and aqueous solutions[J].Journal of Physical and Chemical Reference Data,1985,14(3):637-639.
[18]LIDE D R.CRC handbook of chemistry and physics[M].75th ed.Cleveland:CRC press,1994.
[19]SITARAMAN R,IBRAHIM S H,KULOOR N R.A generalized equation for diffusion in liquids[J].Journal of Chemical and Engineering Data,1996,42(12):3559-3562.
