紫杉醇联合5-Aza-dC对非小细胞肺癌细胞NCI-H446生长抑制作用的研究
曲红梅,姜艳辉,孙伟,朱新冰
(辽河油田总医院急诊科1、普外科2,辽宁盘锦124010)
·论著·
紫杉醇联合5-Aza-dC对非小细胞肺癌细胞NCI-H446生长抑制作用的研究
曲红梅1,姜艳辉2,孙伟1,朱新冰2
(辽河油田总医院急诊科1、普外科2,辽宁盘锦124010)
目的 探讨紫杉醇(PAC)联合DNA甲基化酶抑制剂5-氮杂-2'-脱氧胞苷(5-Aza-dC)对非小细胞肺癌细胞NCI-H446增殖迁徙及侵袭能力的影响。方法将人小细胞肺癌细胞NCI-H446给予紫杉醇及5-Aza-dC干预处理,根据药物干预方式的不同分为对照组、紫杉醇组及联合用药组;应用CCK-8法检测各组NCI-H446细胞增殖能力的差异;划痕实验和Transwell实验检测各组NCI-H446细胞迁移和侵袭能力的差异。结果CCK-8结果显示PAC及5-Aza-dC均可抑制NCI-H446细胞的增殖活性,且呈时间依赖性。48 h后紫杉醇组及联合用药组NCI-H446细胞的增殖能力较对照组明显减弱(P<0.01);划痕实验结果显示划痕形成24 h后,对照组划痕愈合率为(69.15±0.837)%。而在紫杉醇组划痕处愈合率为(47.30±0.783)%;联合用药组划痕愈合率为(43.45±0.862)%。紫杉醇组及联合用药组NCI-H446细胞在迁移能力方面较对照组差异有统计学意义(P<0.01);Transwell实验结果显示对照组NCI-H446细胞转染穿过基质胶的细胞数量为(151.4±6.88)个,紫杉醇组为(66.8±5.17)个,联合用药组为(40.2±4.55)个。紫杉醇组及联合用药组NCI-H446细胞的侵袭能力较对照组差异有统计学意义(P<0.01)。结论5-Aza-dC作为化疗增敏剂可增加非小细胞肺癌细胞NCI-H446对紫杉醇的敏感性,从而提高紫杉醇对非小细胞肺癌的化疗效果。
非小细胞肺癌;5-Aza-dC;紫杉醇;化疗增敏剂
全球范围内无论是男性或女性,非小细胞肺癌(NSCLC)均是导致癌症相关死亡的首要原因,其恶性程度高,常对化疗产生耐药或复发。尽管早期患者可以经手术完全切除病灶,但是ⅠA期患者5年死亡率仍有33%,ⅢA期患者达77%[1]。临床试验己经证实非小细胞肺癌患者在完全切除术后接受辅助化疗可以改善生存。目前,紫杉醇是NSCLC化疗方案中的一线药物,单药对NSCLC的有效率为21%~24%[2]。本研究通过检测紫杉醇联合DNA甲基化酶抑制剂5-氮杂-2'-脱氧胞苷(5-Aza-dC)对人小细胞肺癌细胞(NCI-H446)增殖、迁移和侵袭能力的影响,初步探讨5-Aza-dC作为化疗增敏剂联合紫杉醇在NSCLC化疗中应用的可行性。
1 材料与方法
1.1 细胞培养小细胞肺癌细胞系NCI-H446细胞系来自中国医科大学细胞生物教研室,细胞单层贴壁生长于含10%胎牛血清、NaHCO2浓度2 g/L、青霉素G浓度100 U/L、链霉素浓度100 μ g/L RPMI-1640培养液中,在37℃、5%CO2恒温密闭式培养箱中培养,隔天换液,取对数生长期细胞进行试验。
1.2 实验分组及药物干预5-氮杂-2'-脱氧胞苷为Sigma公司产品,紫杉醇注射液为美国百时美施贵宝公司产品。实验分组:(1)对照组:同期培养不加药的NCI-H446细胞。(2)紫杉醇组:NCI-H446细胞加50 nmol/L紫杉醇培养72 h。(3)联合用药组:NCI-H446细胞加50 nmol/L紫杉醇及5 μ mol/L 5-aza-dC共同培养72 h。
1.3 观察指标与检测方法
1.3.1 NCI-H446细胞的增殖抑制率采用CCK-8法检测药物干预前后NCI-H446细胞的增殖抑制率变化。将处于对数生长期的NCI-H446细胞接种于96孔培养板内。每孔含培养液100 μl,含细胞约2.5~3×104个。每孔加入10 μl CCK-8溶液(碧云天,上海,中国)作用2 h后,采用酶联免疫检测仪450 nm处测量各孔的光密度值(OD)值。最后计算出紫杉醇(PAC)组和联合用药组对NCI-H446细胞的增殖抑制率。实验重复3次,取均值计算增殖抑制率。增殖抑制率=[对照组OD值-实验组OD值/对照组OD值]×100%。实验重复3次,取其平均值进行分析。
1.3.2 NCI-H446细胞迁移能力采用划痕实验检测药物干预对NCI-H446细胞迁移的影响。分别于六孔板中的每孔中加入对数期生长的对照组、紫杉醇组和联合用药组NCI-H446细胞约5×105个细胞,加入血清培养基培养。待细胞贴壁达到80%以上时,用无菌200 μl枪头居中划一伤痕。磷酸盐缓冲液(PBS)洗去处划下的细胞,加入无血清培养基,37℃、5% CO2恒温培养箱培养,于0、24 h计数并拍照,实验重复3次,取其平均值进行分析
1.3.3 NCI-H446细胞侵袭能力采用Transwell实验检测药物干预对NCI-H446细胞侵袭能力的影响。铺Matrigel胶后选择对数生长期的各组NCI-H446细胞消化后制成单个细胞悬液,计数后于Transwell小室上层小室内每室分别加入细胞悬液,37℃、5%CO2孵箱中培养24 h后用4%多聚甲醛固定20 min,吉姆萨染色10 min。光镜下随机选取5个视野(×200)计数穿过小室底膜的细胞数,评价细胞迁移能力,实验重复3次,取其平均值进行分析。
1.4 统计学方法采用SPSS17.0统计软件对实验数据进行处理,检测数据以均数±标准差(±s)表示,采用Student's t-test进行统计学分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 紫杉醇及紫杉醇联合5-aza-dC抑制NCI-H446细胞增殖CCK-8法检测结果显示,在24 h测对照组OD值为(1.774±0.113),紫杉醇组为(1.717±0.327),联合用药组为(1.698±0.282)。经统计学分析,各组差异均无统计学意义(P>0.05);在48 h测对照组OD值为(2.453±0.365),紫杉醇组为(2.154±0.327),联合用药组为(2.056±0.182)。经统计学分析,紫杉醇组及联合用药组较对照组差异有统计学意义(P<0.05)。在72 h测对照组OD值为(2.548±0.264),紫杉醇组为(2.043±0.287),联合用药组为(1.686±0.177)。经统计学分析,紫杉醇组及联合用药组较对照组差异有显著统计学意义(P<0.01)。其中药物作用72 h计算紫杉醇组增殖抑制率为(19.8±0.134)%,联合用药组增殖抑制率为(33.8±0.151)%。两组差异有统计学意义(P<0.05)。联合用药较单独应用紫杉醇对NCI-H446细胞有更强的增殖抑制作用,见图1。

图1 CCK-8法检测各组药物干预对NCI-H446细胞增殖的影响。
2.2 紫杉醇及紫杉醇联合5-aza-dC均能抑制NCI-H446细胞迁移能力划痕实验结果显示,对照组依然具有较强的迁移能力,划痕后24 h,划痕处愈合率为(69.15±0.837)%,而在紫杉醇组划痕处愈合率为(47.30±0.783)%,联合用药组划痕愈合率为(43.45±0.862)%。结合对照组的实验结果,经统计学分析,可以证实紫杉醇组及联合用药组均对NCI-H446细胞的迁移能力有影响。差异有显著统计学意义(P<0.01),见图2。
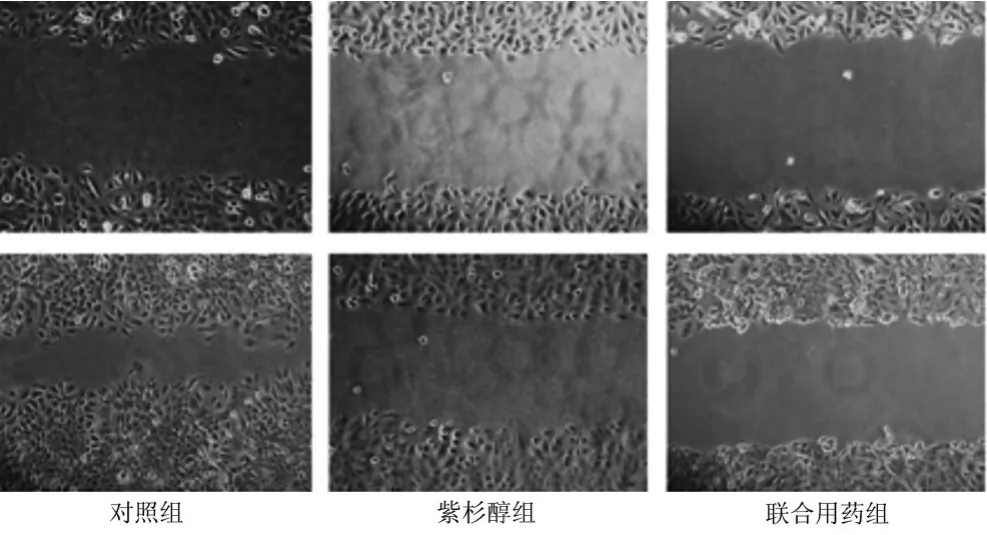
图2 划痕实验检测各组药物干预对NCI-H446细胞迁移能力的影响
2.3 紫杉醇及紫杉醇联合5-aza-dC均能抑制NCI-H446细胞侵袭能力Transwell实验检测结果显示,24 h后,对照组NCI-H446细胞转染穿过基质胶的细胞数量为(151.4±6.88)个,显著高于紫杉醇组(66.8±5.17)个和联合用药组(40.2±4.55)个。这进一步表明紫杉醇及紫杉醇联合5-aza-dC可抑制NCI-H446细胞的侵袭能力(P<0.01)。并且,紫杉醇联合5-aza-dC较单独应用紫杉醇对NCI-H446细胞有更强的抑制细胞侵袭的作用(P<0.01),见图3。
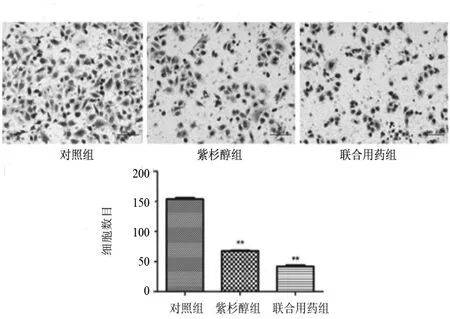
图3 Transwell实验检测各组药物干预对NCI-H446细胞侵袭能力的影响
3 讨论
随着分子生物学技术的发展,国内外学者对肿瘤发生、发展、转移的机制进行了大量基因水平的基础研究,发现基因功能与表达模式异常是癌症的主要特征。日益增多的研究表明,DNA甲基化(DNA methylation)、组蛋白修饰(Histone modification)、染色质重塑(Chromatin remodeling)以及microRNAs介导的基因沉默等表观遗传调控方式的异常与肿瘤的发生发展密切相关[3]。目前普遍认为DNA异常甲基化是除缺失与突变外导致肿瘤抑制基因失活的第三种机制。有研究显示肿瘤抑制基因发生甲基化是胃癌形成过程中的频繁事件[4]。表遗传调控易于修正的特性,使得表遗传调控相关药物成为肿瘤治疗中的一个重要领域。DNA甲基转移酶(DNA methyltransferases,DNMTs)在几乎所有肿瘤细胞中都高度表达,各种肿瘤抑制基因启动子区常处于高甲基化状态,因此,基于DNMT抑制剂的药物在临床试验以及实验室研究中得到了广泛重视。阿扎胞苷(5-azacytidine)、5-氮杂-2'-脱氧胞苷(5-Aza-2'-deoxycytidine,DAC)等胞嘧啶类似物在DNA复制、RNA合成过程中能够进入核酸分子内部,并以共价结合的方式与DNMTs相互作用,从而抑制核酸分子的甲基化,恢复各种肿瘤抑制基因的表达,从而达到治疗肿瘤的作用[5]。基于DNMTs抑制剂的高效性,2004年美国食品和药物管理局(Food and Drug Administration, FDA)首次批准DNA甲基转移酶抑制剂阿扎胞苷(5'-azacytidine)用于治疗骨髓异常增生综合征,随后又于2006年批准5-氮杂-2'-脱氧胞苷(5-Aza-2'-deoxycytidine)进入骨髓异常增生的临床治疗[6]。但是,在实体瘤的治疗应用却寥寥无几,主要有两方面原因:(1)5-Aza-2,-deoxycytidine药物的半衰期极短,难以在实体瘤中形成有效的血药浓度。(2)对实体瘤有效的浓度往往会导致严重的全身毒副作用。这正是表遗传学调控相关药物在实体瘤中的应用瓶颈。如何使表遗传学调控相关药物能够与化疗药物完美的结合使化疗药物发挥最大效果是表遗传学治疗领域的研究热点。
本研究中,我们利用可以将5-Aza-2,-deoxycytidine短期、小剂量的应用于人小细胞肺癌细胞系NCI-H446,达到降低肺癌细胞抑癌基因启动子区甲基化水平,提高抑癌基因的表达水平,起到对化疗药物增敏的作用,同时联合应用紫杉醇,提高紫杉醇对NCI-H446细胞在增殖、迁移、侵袭方面的抑制作用。类似的研究还有Cheetham等[7]的研究证实,在结肠癌细胞中应用5-Aza-2,-deoxycytidine联合5-氟尿嘧啶可以提高结肠癌细胞对5-氟尿嘧啶的敏感性,达到更好的化疗效果。Hu等[8]的研究也证实5-Aza-2,-deoxycytidine可以提高子宫内膜癌对激素治疗的敏感性。
然而,表遗传治疗方法在实体肿瘤中的临床应用依然还有很长的路要走。肿瘤组织中通常同时存在多种表遗传调控的变化,单一使用一种抑制剂很难从根本上改善肿瘤患者的症状。与此同时,由于表遗传调控几乎参与生物体内所有的生物学过程,各种修饰酶的作用也特别广泛,各种抑制剂的使用也会带来意想不到的副作用[9]。此外,各类抑制剂在个体内的稳定性较差、药物代谢时间较短也是影响其使用效果的一个重要原因[10]。因而,如何设计、开发高效稳定,同时避免强烈副作用的表遗传治疗相关药物成为表遗传治疗的关键问题。随着肿瘤表基因组研究中的不断深入,必然将揭示更多的尚未所知的表遗传调控变化,从而为表遗传调控相关药物在肿瘤治疗中的应用开辟新的方向。
[1]Blinman P,Alam M,Duric V,et al.Patients'preferences for chemotherapy in non-small-cell lung cancer:a systematic review[J].Lung Cancer,2010,69(2):141-147.
[2]侯恩存,张海燕.NP方案与TP方案治疗晚期非小细胞肺癌的临床研究[J].重庆医学,2009,38(3):323-324.
[3]Ferrari R,Pellegrini M,Horwitz GA,et al.Epigenetic reprogramming by adenoviruse1a[J].Science,2008,321(5892):1086-1088.
[4]Kang GH,Lee S,Kim JS,et al.Profile of aberrant CpG island methylation along the multistep pathway of gastric carcinogenesis[J]. Lab Invest,2003,83(5):635-641.
[5]Gowher H,Jeltsch A.Mechanism of inhibition of DNA methyltransferases by cytidine analogs in cancer therapy[J].Cancer Biol Ther, 2004,3(11):1062-1068.
[6]刘志坚,孙英丽.癌表观遗传调控与癌症治疗[J].中国生物化学与分子生物学报,2011,27(4):310-315.
[7]Cheetham S,Tang MJ,Mesak F,et al.SPARC promoter hypermethylation in colorectal cancers can be reversed by 5-Aza-2,deoxycytidine to increase SPARC expression and improve therapy response [J].British Journal of Cancer,2008,98(11):1810-1819.
[8]Hu Q,Yu L,Chen R,et al.5-aza-2'-deoxycytidine improves the sensitivity of endometrial cancer cells to progesterone therapy[J]. Int J Gynecol Cancer,2012,22:951-959.
[9]Botrugno OA,Santoro F,Minucci S.Histone deacetylase inhibitors as a new weapon in the arsenal of differentiation therapies of cancer [J].Cancer Lett,2009,280(2):134-144.
[10]Sebova K,Fridrichova I.Epigenetic tools in potential anticancer therapy[J].Anticancer Drugs,2010,21(6):565-577.
Inhibitory effect of Paclitaxel combined with 5-Aza-dC on non-small cell lung cancer cell line NCI-H446.
QU Hong-mei1,JIANG Yan-hui2,SUN Wei1,ZHU Xin-bing2.Department of Emergency1,Department of General Surgery2, Liaohe Oilfield General Hospital,Panjin 124010,Liaoning,CHINA
ObjectiveTo investigate the effect of Paclitaxel(PAC)combined with DNA methyltransferase inhibitor 5-aza-2'-deoxycytidine(5-Aza-dC)on the proliferation,invasion and migration of on non-small cell lung cancer(NSCLC)cell line NCI-H446.MethodsNSCLC cell lines NCI-H446 were treated with PAC and 5-Aza-dC, and divided into three groups:control group,PAC group and combined group.NCI-H446 cell's proliferation ability was analyzed by CCK-8 assay,while the migration and invasion abilities were assessed by wound-healing assay and Matrigel invasion assay.ResultsCCK-8 assay indicated that NCI-H446 cells treated with PAC and 5-Aza-dC exhibited growth retardation.48 h after treatment,the proliferation ability of PAC group and combined group was significantly reduced compared with that of the control group(P<0.01).24 h after wound formation,the wound healing rate of control group was(69.15±0.837)%,compared with(47.30±0.783)%in the PAC group and only(43.45±0.862)%in the combined group.TheseResultsshowed cell migration in PAC group and combined group was significantly reduced,compared with the control group(P<0.01).Matrigel invasion assay showed that the numbers of cells penetrating Matrigel and adhering to the membrane in the control,PAC,and combined groups was(151.4±6.88),(66.8±5.17), (40.2±4.55),respectively,which indicated that cell invasion in PAC,and combined groups were significantly reduced (P<0.01).Conclusion5-Aza-dC can enhance the chemosensitivity of NSCLC cell line NCI-H446 to PAC,and thus improve the chemotherapeutic effect of PAC for NSCLC.
Non-small cell lung cancer(NSCLC);5-Aza-dC;Paclitaxel;Chemosensitizer
R734.2
A
1003—6350(2014)21—3130—04
10.3969/j.issn.1003-6350.2014.21.1229
2014-02-19)
曲红梅。E-mail:zhuxinjiang55@126.com

