水处理工艺中氟喹诺酮类物质分布的检测
徐勇鹏,王 媛,田家宇,王 冬,崔 鹏,陶 辉
水处理工艺中氟喹诺酮类物质分布的检测
徐勇鹏1,2,王 媛2,田家宇2,王 冬2,崔 鹏2,陶 辉3
(1.城市水资源开发利用(北方)国家工程研究中心,150090哈尔滨;2.哈尔滨工业大学市政环境工程学院,150090哈尔滨;3.河海大学环境学院,210098南京)
环境中残留的氟喹诺酮类物质(FQs)对人体健康构成威胁,自来水厂对阻断FQs进入饮用水中具有关键作用.选取长江、太湖、大溪水库和松花江水源水及江苏省A、B和C水厂的工艺出水探索同时检测诺氟沙星、环丙沙星、恩诺沙星和氧氟沙星的方法,并分析FQs在水处理工艺流程中的迁移规律.结果表明,长江水中FQs的质量浓度在51~129 ng/L,太湖水中65~204 ng/L,大溪水库中62~248 ng/L,松花江水中61~165 ng/L.水处理工艺出水FQs残留结果表明,常规水处理工艺对FQs的去除率在20%~40%,起主导作用的是混凝沉淀过程,采用臭氧-活性炭工艺去除率可达20%~60%.
氟喹诺酮;水处理工艺;固相萃取;液质联用
氟喹诺酮类(FQs)药物由于具有抗菌谱广、抗菌作用强等优点成为医学开发的热点药物之一.[1].目前,该类药物已经达到滥用的水平,环境中残留的FQs会对人体健康构成威胁,同时对植物和微生物界也存在极大的安全威胁.这类药物可被部分吸收和去除,但还有大量的化合物排放到环境中,目前国内外各水体中均检测到FQs的痕量存在.Yiruhan等[2]发现诺氟沙星、环丙沙星、洛美沙星及恩诺沙星在广州自来水厂中质量浓度为1~676 ng/L,澳门的自来水中这几种物质的质量浓度在2~37.5 ng/L.自来水厂在阻断FQs进入饮用水中具有关键作用.因此,建立高效精确的检测方法检测我国水源水及饮用水处理工艺中FQs的质量浓度,以掌握各种净水工艺对FQs的影响,全面评价水中FQs对人体健康的风险性.本研究以进厂原水和各处理工艺单元出水为对象,利用固相萃取和液质联用的分析手段,研究了4种FQs在不同水处理工艺中的消减规律,以期为保护人体健康及相关政策法规的制定提供依据.
1 实 验
1.1 主要试剂
恩诺沙星(ENR,99.8%)、环丙沙星(CIP,99.8%)、诺氟沙星(NOR,98.5%)、氧氟沙星(OFL,99.9%)及沙拉沙星(SAR,99.8%)均为色谱纯,购自Sigma试剂(中国)公司;冰乙酸为分析纯,由百灵威仪器试剂公司生产;甲醇和乙腈均为色谱纯,购自美国TEDIA公司;磷酸为分析纯,天津市博迪化工有限公司生产.标准储备液均为500 mg/L,置于100 mL棕色容量瓶中于4℃冰箱中低温避光贮藏.超纯水为Milli-Q纯水仪制得.
1.2 实验仪器及条件
Supelco 12管固相萃取装置(美国Supelco公司),Oasis HLB萃取小柱(美国Waters公司),OA -SYS型氮吹仪(Organomation Associores.Jnc),PHS-3C型精密pH计(上海雷磁仪器厂),玻璃砂芯过滤器(上海楚定仪器有限公司),FA1004电子分析天平(上海精密科学仪器有限公司),SHB-IV型双A循环水真空泵(上海楚定仪器有限公司),Milli-Q型超纯水机(美国Millipore公司),恒温干燥箱(上海一恒科学仪器有限公司),安捷伦6520Q-TOF质谱仪(安捷伦科技公司),waters setry-C8色谱柱(5 μm,4.6×250 mm i.d.).
色谱条件:waters setry-C8色谱柱,柱温30℃;流速0.4 mL/min;3 mmol/L乙酸(含体积分数为13.2%的乙腈)为流动相A,Milli-Q超纯水为流动相B,流动相A和B的起始体积比为81∶19,30 min内匀速线性梯度变化到53%,最后2 min内升到起始比例;UV280 nm波长检测;进样量10 μL.
质谱条件:离子源为ESI源,采用正离子扫描,干燥气温度为3 500℃;气体流速为9 L/min;喷雾压力为206.7 kPa;毛细管电压为3 500 V;检测破碎电压为85 V.
1.3 样品采集与处理
采集长江、太湖、大溪水库和松花江水源水以及江苏省A、B和C水厂的混凝沉淀后出水(简称沉后水)、过滤后出水(简称滤后水)和消毒后出厂水(简称出厂水).长江、太湖、大溪水库和松花江水源水的采样点分别在南京段、无锡段、溧阳段和哈尔滨段;水厂采样点均为水厂常规水质指标检测的专设取样点,在同一个月内取两次水样,且间隔2 d,样品采集后密封保存,当天完成实验处理.
取回静置后用0.45 μm的玻璃纤维滤膜过滤待用,水样预处理采用国际上最常用的固相萃取法.选用Oasis HLB固相萃取小柱.将supelco12管、固相萃取装置、HLB萃取小柱、缓冲装置、真空泵按顺序连接好,用2 mL甲醇、2 mL水依次活化SPE小柱后,通过大容量采样管将其与水样(2 L)连接;启动真空泵,调节真空压力以控制萃取流速在6.0 mL/min,待水样全部过柱后,用5 mL磷酸(调整pH=3.0)、5 mL水依次淋洗小柱;真空干燥(45℃)小柱5 min后,用4 mL甲醇洗脱,洗脱液用氮气在30℃吹干,用甲醇定容至1 mL后加入0.5 mL 100 μg/L的SAR内标物进行定量检测.每次实验同时处理与分析12个样品,在每次测定以上样品的同时校正工作曲线.
1.4 方法检测限及线性范围
在空白样品中加混合标样,分别配制1、2、5、8、10、50、100、200、400、500 μg/L一系列混合样品,按对实际水样处理的步骤进行处理与检测,得到方法对4种目标物的检测限为2~5 μg/L,线性范围为2~500 μg/L,线性相关系数为0.98~0.99.
1.5 回收率及精密度
在去离子水、松花江水中分别加标50 ng/L和100 ng/L目标物质,目标物的回收率分别为77%~112%、81%~108%,且表现出良好的重现性,计算出的回收率相对标准偏差均小于10%,具有较好的精密度,能满足实际水样中目标物质的痕量检测和分析.
2 结果与讨论
2.1 我国部分水源水中FQs分布
我国部分水源水中FQs检测值见表1.在长江水中,ENR的质量浓度较高,达129 ng/L,CIP和OFL质量浓度相当,分别为66和51 ng/L,NOR未检出,可能是该地区NOR的使用量较少的原因;在太湖水中,OFL的质量浓度最高,达204 ng/L左右,其次CIP为148 ng/L,ENR为96 ng/L左右,NOR质量浓度较低,为65 ng/L;在大溪水库水中,4种物质的质量浓度整体上较高,其中CIP和ENR分别高达207和248 ng/L,OFL质量浓度为110 ng/L,NOR最低,为62 ng/L;松花江水中,CIP和OFL的质量浓度都比较高,分别达148和165 ng/L,其次为NOR,质量浓度为117 ng/L,ENR质量浓度最低,为61 ng/L左右.另有研究表明,珠江广州河段OFL质量浓度为53~108 ng/L,NOR质量浓度为117~251 ng/L[3];苏仲毅[4]也在九龙江口及厦门近岸海域检测到ng级的氟喹诺酮物质;香港维多利亚港附近OFL和NOR的质量浓度分别只有5~16和9~28 ng/L[5].相比Foazio M J[6]调查的美国25个地区49处水源水中CIP、ENR和NOR的质量浓度均在20~30 ng/L,我国内地大部分河流中氟喹诺酮类抗生素物质残留情况较严重.
同时,不同水源水的残留量反映出不同地区使用药物的种类和数量也有不同,诺氟沙星(NOR)的使用量在各地区都比较少,最高的地区为哈尔滨(水源为松花江);环丙沙星(CIP)的使用量范围最广,在太湖、大溪水库、松花江中的残留量都很高;恩诺沙星(ENR)在长江、大溪水库中的残留量较高,说明恩诺沙星在该地区使用量较大;氧氟沙星(OFL)跟恩诺沙星正好相反,在长江、大溪水库中残留量低,在太湖和松花江中的残留水平高.总之,我国水源水中氟喹诺酮类抗生素物质的环境残留十分明显,不同地区使用药物的种类和数量也有所不同.
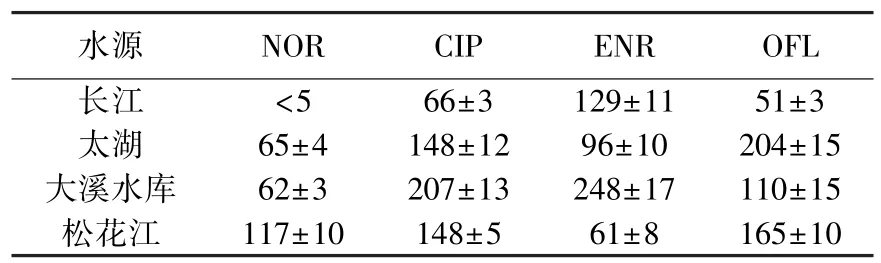
表1 我国部分水源水中FQs的检测值ng·L-1
2.2 水处理工艺出水FQs的残留水平
江苏省A水厂以长江水为水源,常规水处理工艺采用隔板絮凝池、平流沉淀池、普通快滤池、氯气消毒.各工艺出水中FQs的残留结果见图1,图中未显示浓度部分均为低于检测限.目标物经过水处理工艺均有去除,原水中CIP和OFL质量浓度较低,分别只有66和51 ng/L,经混凝沉淀和过滤工艺后两种物质的质量浓度均降至定量限以下;ENR在原水中质量浓度为129 ng/L,经混凝沉淀、过滤和消毒工艺后质量浓度仍在85 ng/L.
江苏省B水厂原水取自太湖贡湖的南泉水源,常规处理工艺采用机械搅拌反应池、平流沉淀池、普通快滤池和清水池,氯气消毒,一期深度处理工艺选用西门子公司超滤膜净水系统,二期深度处理选用臭氧-生物活性炭工艺.水样检测结果见图2.各水处理工艺对目标物均具有一定的去除效果,原水中OFL的质量浓度最高,为204 ng/L,经混凝沉淀工艺后降至133 ng/L,经过滤工艺后进一步降至84 ng/L,经臭氧-生物活性炭和膜滤工艺后质量浓度均在定量限以下;原水中CIP质量浓度次之,为148 ng/L,经混凝沉淀和过滤工艺后质量浓度降至98 ng/L,在臭氧出水中质量浓度为61 ng/L,在炭滤出水、膜滤出水和出厂水中质量浓度均降至定量限以下;原水中NOR和ENR质量浓度较低,分别只有65和96 ng/L,在炭滤工艺后分别降至6和30 ng/L,在膜滤出水和出厂水中质量浓度均在定量限以下.
江苏省C水厂水源地为大溪水库,基本工艺流程为混凝、气浮、砂滤和加氯消毒.其水样检测结果见图3.原水中ENR质量浓度最高,为248 ng/L,经气浮和过滤工艺后质量浓度分别降至171和92 ng/L,在出厂水中质量浓度为46 ng/L;CIP和OFL在原水中质量浓度分别为207和110 ng/L,经气浮、过滤和消毒工艺后分别为31和32 ng/L;原水中NOR质量浓度最低,只有62 ng/L,经气浮和过滤工艺后,质量浓度分别为44和7 ng/L,出厂水中检测值降到5 ng/L以下.
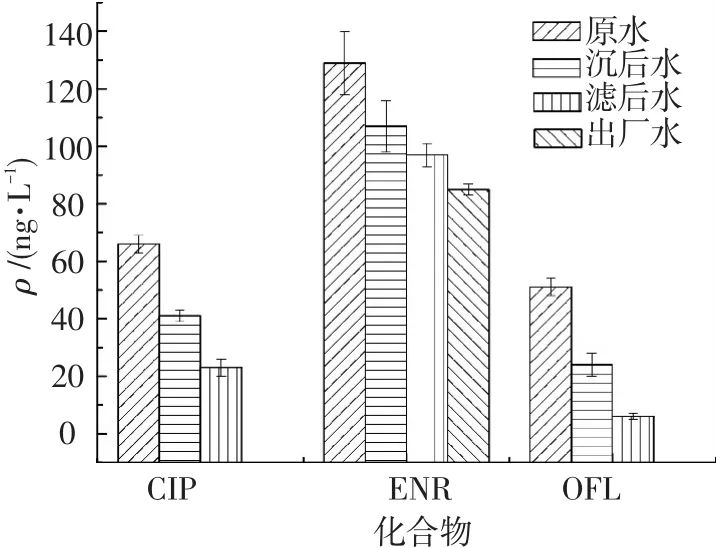
图1 A水厂目标物在各取样点质量浓度变化

图2 B水厂目标物在各取样点质量浓度变化
2.3 水处理工艺对FQs消减效能分析
以上各水厂工艺对目标物的去除比率见表2,去除比率是每个单元去除目标物的能力占全系统去除率的比例.其中,混凝沉淀工艺对OFL的去除比率最高,为34%~53%,对CIP和ENR的去除比率分别为17%~37%和17.62%~17.71%;混凝气浮工艺对NOR、CIP、ENR和OFL的去除比率分别为29.03%、28.02%、31.05%和38.18%;过滤工艺对4种目标物的去除比率分别为26%~44%、19%~43%、7%~32%和23%~36%;消毒工艺对4种目标物的去除比率分别为24.19%、15%~20%、8%~19%和7%~10%;臭氧-生物活性炭对4种目标物的去除比率分别为33.92%、62.84%、19.35%和39.21%.由此可知,给水处理厂的常规工艺对氟喹诺酮类抗生素具有去除效果,但去除并不彻底,且各工艺对不同的物质表现出的去除效果也不相同.
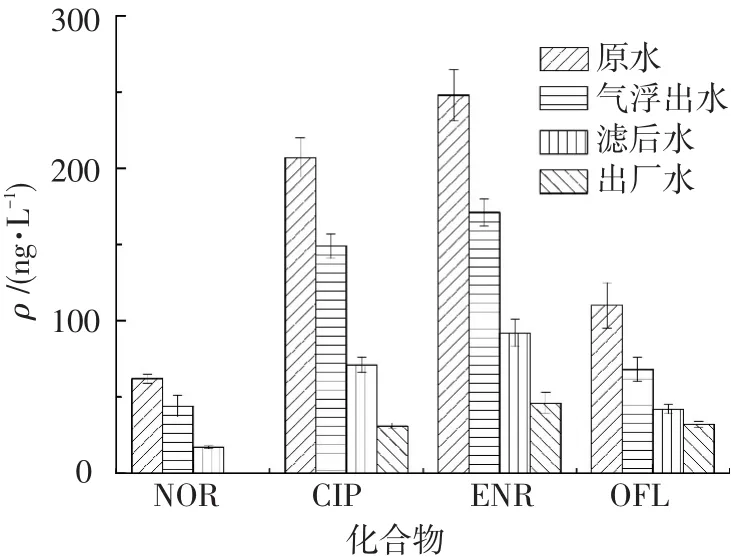
图3 C水厂目标物在各取样点质量浓度变化
A水厂采用隔板絮凝-平流沉淀工艺,CIP和OFL进水浓度较低,但该工艺对两种物质的去除比率很高.B水厂采用的是折板絮凝-平流沉淀工艺,其中NOR进水浓度最低,只有65 ng/L,去除比率却达30.78%.显然混凝沉淀工艺对FQs的去除比率相对较高,可能是由于在混凝过程中抗生素物质会吸附颗粒物,通过相互静电作用形成絮体,从而在沉淀过程中被去除.另外,不同水厂也有差别,可能与投加混凝剂的种类和剂量有关.相关研究很少,很难对其影响做出评价.另有研究表明,pH、水温以及抗生素的物化特性都会对混凝沉淀过程中抗生素的去除产生影响[7].Adames等[8]采用2 mg/L的混凝剂聚合氯化铝对密西西比河水进行实验室模拟混凝实验,结果对抗生素只有20%~30%的去除率,表明实际工程中混凝沉淀对抗生素的去除效率高于实验室研究.
普通快滤池与V型滤池相比,在进水浓度较低的情况下,V型滤池对NOR和CIP的去除比率较高.B水厂普通快滤池对ENR的去除比率较高,但是从A水厂去除效果看,普通快滤池对ENR的去除比率并不高,而对CIP和OFL的去除比率较高,这表明同一种工艺在不同的水厂实施时也会有差别,可能与滤料、反冲洗等条件有关.滤池的基本功能就是去除经过沉淀工艺后剩余的絮体,溶解性抗生素并未被有效去除,而是通过滤料对其吸附作用得到去除.Rooklidge等.[9]在实验室研究砂滤对多段饮用水中4类抗生素(μg/L)的去除效果,对于吸附常数较高的泰乐霉素和甲氧苄氨嘧啶去除率大于99.9%,对吸附常数较低的磺胺类和林肯霉素去除率仅为4%和25%,推测氟喹诺酮类抗生素吸附常数可能较低.
A和C水厂均采用液氯消毒.在氯消毒过程中,自由余氯作为氧化剂可以氯化降解抗生素物质,同时往往会导致氯化副产物的产生.有研究表明,FQs的氯化降解可能是由于哌嗪环上去质子化了的N4原子与HOCl表现出明显的反应性[10].另外,不同水厂氯化降解FQs的效果表现出差异性可能与水的pH及加氯量有关.Ye等[11]在实验室(水厂取样,1 L富集,SPE-LC-MS前处理检测)研究发现水源水经氯消毒后,水中含有的24种抗生素物质仅能检测到7种,大多数被完全去除,说明实际工程中的氯消毒去除与实验理想条件下的结果有一定差距.
B水厂的臭氧-活性炭工艺对FQs的去除比率相对较高,原因可能是臭氧对此类抗生素物质具有降解作用[12],同时活性炭也具有较强的吸附能力[13].臭氧氧化过程中,抗生素物质会与氧分子分解产生的羟基自由基反应,羟基自由基产生的速率与水的碱度和TOC质量浓度有关.有研究表明,FQs上的氨基与臭氧表现出较高的反应性[14],而且反应速率与pH有关[15].活性炭对抗生素物质的吸附主要是通过疏水作用和离子交换过程,吸附能力随Kow值的增大而增大[16].Adams等[8]采用Missouri河水研究活性炭吸附对抗生素的去除效果,在投加量分别为10和20 mg/L时,去除率分别达49%~73%和65%~100%,表明实际工艺中通过改变活性炭投加量等条件能进一步增强活性炭吸附技术的去除效果.与常规工艺不同的是,这些深度处理工艺对低浓度的氟喹诺酮物质也有很好的去除效果,其处理后水样中目标物的质量浓度低于纳克级,因此,深度处理工艺对氟喹诺酮类物质的去除具有广泛的应用前景.
对比发现气浮-V型滤池过滤-液氯消毒组合工艺对4种目标物的整体去除比率较高,对物质没有选择性,组合工艺对NOR、CIP、ENR和OFL的去除比率分别为96.77%、85.02%、81.45%、70.91%;其中气浮对4种物质的去除比率在28.02%~38.18%,V型滤池对4种物质的去除比率在23.64%~43.55%,液氯消毒对4种物质的去除比率在5.17%~24.19%.而絮凝沉淀-普通快滤池-液氯消毒对物质的去除效果具有选择性,如整个工艺对NOR的去除比率不到35%.
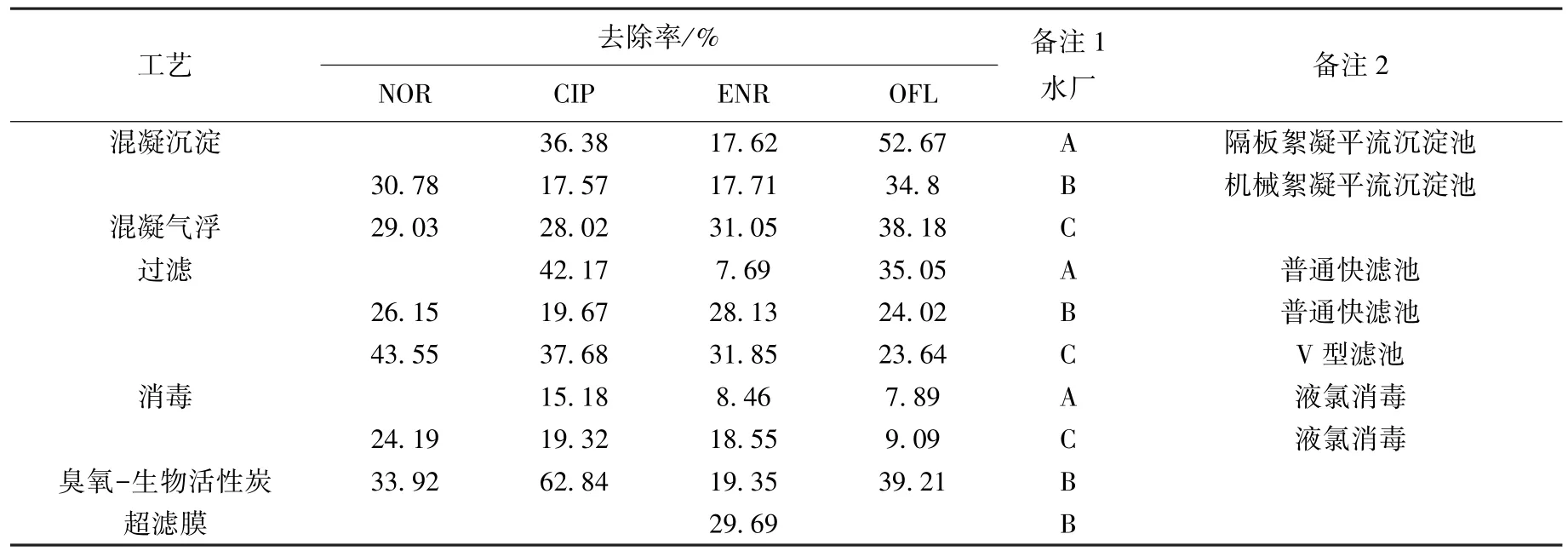
表2 各处理工艺对目标物的去除率
3 结 论
1)我国部分水体中氟喹诺酮类抗生素物质的残留情况较为明显,太湖、长江、大溪水库以及松花江水中的残留值相当,在51~248 ng/L的水平.不同水源水的残留量反映出不同地区使用药物的种类和数量也有不同.
2)常规水处理工艺对氟喹诺酮类物质均有去除,但是去除不完全,其中混凝-沉淀工艺有相对较高的去除比率,同一种工艺在不同的水厂实施时也有差别.各地水厂出水中,氟喹诺酮类物质的质量浓度较低,约在几纳克至几十纳克.臭氧-活性炭工艺无论氟喹诺酮物质进水浓度的高低,都表现出较高的去除效果,具有广阔的应用前景.
3)气浮-V型滤池-液氯消毒组合工艺对4种目标物的整体去除比率较高,对物质没有表现出选择性;混凝沉淀-普通快滤池-液氯消毒工艺对物质的去除效果表现出选择性.
[1]戴自英.实用抗菌药物学[M].北京:人民卫生出版社,1992.
[2]YIRUHAN.Determination of four fluoroquinolone antibiotics intapwaterinGuangzhouandMacao[J]. Environmental Pollution,2010.158(7):2350-2358.
[3]徐维海.典型抗生素类药物在珠江三角洲水环境中的分布、行为与归宿[D].广州:中国科学院研究生院,2007.
[4]苏仲毅.环境水样中24种抗生素残留的同时分析方法及其应用研究[D].厦门:厦门大学,2008.
[5]徐维海,张干,邹世春,等.香港维多利亚港和珠江广州河段水体中抗生素的质量浓度特征及其季节变化[J].环境科学,2006,27(12):2458-2462.
[6]FOCAZIOMJ.Anationalreconnaissancefor pharmaceuticalsandotherorganicwastewater contaminants in the United States-II Untreated drinking water sources[J].Science of the Total Environment, 2008,402(2/3):201-216.
[7]JNATHAN T A,FAISAL I H,TUIKI M A.Chemical coagulation-basedprocessesfortraceorganic contaminant removal:current state and future potential[J].Journal of Environmental Management,2012,111: 195-207.
[8]ADAMS C,WA Y,LOFTIN K,et al.Removal of antibioticsfromsurfaceanddistilledwaterin conventional watertreatment processes[J].Environment Engineering,2002,128(3):253-260.
[9]ROOKLIDGE S J,MINER T A,NELSON P O. Antimicrobial contaminant removal by multistage slow sand filtration[J].Journal American Water Works Association,2005,97(12):92-95.
[10]BING L,TONG Z.pH significantly affects removal of trace antibiotics in chlorination of municipal wastewater[J].Water Research,2012,46(11):3703-3713.
[11]YE Z Q,WEINBERG H S,MEYER M T.Trace analysis of trimethoprim and sulfonamide,macrolide,quinolone,and tetracycline antibiotics in chlorinated drinking water using liquid chromatography electrospray tandem mass spectrometry[J].Analytical Chemistry,2007,79(3):1135-1144.
[12]刘欣然,马艳.高级氧化法去除水中药物和个人护理用品的研究进展[J].四川环境,2010,29(3):73-78.
[13]曲晓妍,李鼎,沈爱莲.臭氧生物活性炭深度处理饮用水中抗生素的研究[J].水科学与工程技术,2010,5(1):33-35.
[14]URS von G.Ozonation of drinking water:part I. oxidation kinetics and product formation[J].Water Research,2012.37(7):1443-1467.
[15]VIENO N M,HARKKI H,TUHKANEN T.Occurrence of pharmaceuticals in river water and their elimination in a pilot-scaledrinkingwatertreatmentplant[J]. Environmental Science and Technology,2007,41(14): 5077-5084.
[16]SNYDER S A,WESTERHOFF P,YOON Y.Pharmaceuticals,personal care products,and endocrine disruptors in water:im-icationsforthewaterindustry[J]. Environmental Engineering Science,2003,20(5):449-469.
(编辑 刘 彤)
Simultaneous determination of fluoroquinolones in drinking water treatment processes
XU Yongpeng1,2,WANG Yuan2,TIAN Jiayu2,WANG Dong2,CUI Peng2,Tao Hui3
(1.National Engineering Research Center of Urban Water Resources,150090 Harbin,China;2.School of Municipal and Environmental Engineering,Harbin Institute of Technology,150090 Harbin,China;3.College of Environment,Hohai University,210098 Nanjing,China)
An investigation was performed for the simultaneous determination of norfloxacin(NOR),ciprofloxacin(CIP),enrofloxacin(ENR),and ofloxacin(OFL).The developed method was successfully applied to analyze the fate of Fluoroquinolones(FQs)in water treatment processes.Four FQs were found in Yangtze River,Taihu Lake,Dasi Reservoir,Songhua River,and drinking water treatment processes of A,B and C in Jiangsu.Analyses of samples from Yangtze River,Taihu Lake,Dasi Reservoir and Songhua River indicated that FQs were present at concentrations of 51-129,65-204,62-248 and 61-165 ng/L,respectively.FQs residues in water treatment processes show that the removal efficiency of conventional water treatment processes is between 20%and 40%,and the coagulation-sedimentation process plays a dominant role.The removal efficiency of ozone-activated carbon process is about 20%-60%.
fluoroquinolones;water treatment processes;solid phase extraction;LC-MS/MS(Q-TOF)
X502
A
0367-6234(2014)06-0025-05
213-01-15.
国家自然科学基金资助项目(51108118);黑龙江省留学归国科学基金项目(LC2012C28);哈尔滨工业大学校基金资助项目(HIT.2003.40).
徐勇鹏(1976—),女,博士,副教授.
徐勇鹏,xuyongpeng123@163.com.

