60Coγ射线照射后豚鼠耳蜗细胞凋亡相关基因及蛋白表达分析*
谢利红 钟华林 孙贝蒂 孙凯 廖婷 唐安洲
感音神经性聋是头颈部恶性肿瘤放疗后的常见并发症,影响患者的生存质量[1,2]。有学者认为,内耳细胞凋亡可能是放疗后感音神经性聋发生的细胞机理[3]。细胞凋亡是一个非常复杂的过程,其启动受到精确调控,Caspase 9、Caspase 8、Caspase 3是近年来发现的半胱氨酸天冬氨酸蛋白酶(Caspase)的重要家族成员,是细胞凋亡的重要蛋白[4],这些蛋白受相关基因的调控,Bax基因是Bcl-2家族中诱发细胞凋亡的重要基因,激活Caspase 9;Fas是介导死亡受体途径凋亡的重要基因,使Caspase 8激活,从而引起一系列下游的Caspase级联反应,诱发细胞凋亡。本研究的前期工作中发现60Co γ射线照射可引起豚鼠听功能损害及耳蜗螺旋神经节细胞凋亡[5]。本实验拟进一步研究60Co γ射线对豚鼠耳蜗细胞凋亡相关基因和蛋白表达的影响,探讨60Co照射对耳蜗的损伤机理,为防治放疗引起的感音神经性聋提供参考。
1 材料与方法
1.1实验动物及分组 健康白化豚鼠60只(普通级,购自湖南开福区东创科技服务部),体重250~350 g,雌雄不限。随机分为照射组与对照组,对照组12只不进行照射,照射组48只,以右耳为照射耳,予60Coγ射线一次性照射70 Gy,于照射后第1、4、7和14天各处死豚鼠12只,其中每个时间点随机选2个耳蜗行中轴切片及HE染色,取6个耳蜗行RT-PCR检测,4个耳蜗行蛋白印迹法(western blot,WB)检测。
1.260Coγ射线照射方法 豚鼠用1%戊巴比妥钠(3.5 μl/g)麻醉,固定后,用GWXJ80型60Co远距离治疗机对豚鼠右耳耳颞部做一次性60Coγ射线照射70 Gy[6],辐射深度2.0 cm,照射范围为2 cm×2 cm,源皮距80 cm,自制铅板遮盖非照射部位。
1.3耳蜗中轴切片HE染色 对照组动物及照射组动物于照射后第1、4、7、14天麻醉后,断头经腹侧取听泡,暴露耳蜗并在蜗尖钻孔,推镫骨底板脱位,刺破圆窗膜,用4%多聚甲醛固定液灌流固定后,再放入固定液4 ℃固定24 h以上。用10% EDTA脱钙10~14天,梯度酒精脱水,二甲苯透明,石蜡包埋,耳蜗中轴切片并行HE染色。
1.4逆转录聚合酶链式反应(RT-PCR) (1)耳蜗总RNA提取:①动物处死后,快速取出右侧听泡,剥离耳蜗,置于4 ℃预冷的PBS中(pH7.4),在解剖显微镜下去除蜗壳,将Corti器、血管纹、螺旋神经节、螺旋韧带等结构置于1.5 ml的EP管中,加1 ml Trizol剪碎后充分匀浆,置室温10 min;②加氯仿0.2 m1,振荡15秒,置室温5 min; ③4 ℃,10 000转离心10 min; ④仔细吸取上层水相,移至另一离心管;⑤加入0.5 m 1异丙醇,混匀,放置15 min;⑥4 ℃,10 000转离心10 min,弃上层液相;⑦加75%乙醇1 ml;⑧充分洗涤沉淀,4 ℃,5 000转离心5 min;⑨沉淀溶于无Rnase水中。(2)逆转录合成cDNA第一链:① 将一个无菌Ep管置冰上,并在其中依次加入:总RNA(RNA 2 μg/A260值)μl, Oligo(dT) 5 μl,最后加DEPC水至13.5 μl;② 混合后置于70 ℃温箱内5 min;③ 放置冰上3 min后混匀;④ 加入以下试剂: 5×扩增缓冲液5 μl,2.5 Mm DNTPS 5 μl,M-Mlu(200 μg/μl)1 μl,Rnase inhibitor 0.5 μl;⑤ 混匀37 ℃水浴箱2小时;⑥ -20 ℃冰箱保存。(3)PCR扩增反应:引物见表1。

表1 Fas、Bax、Bcl-2引物序列及其片段
Fas:94 ℃ 5 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min, 30个循环72 ℃ 5 min,4 ℃保存;
Bax:95 ℃ 5 min ,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min, 30个循环,72 ℃ 5 min,4 ℃保存;
Bcl-2:95 ℃ 5 min, 95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min, 30个循环,72 ℃ 5 min,4 ℃保存;
β-actin:95 ℃ 5 min, 95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min, 30个循环,72 ℃ 5 min,4 ℃保存。
(4)电泳:① 1.5%琼脂糖凝胶制备;②将胶放入盛有0. 5×TBE缓冲液的电泳槽中;③ 点样:将嗅酚兰2 μl和PCR产物8 μl混合,小心加入到梳孔中,180 V电压(6 V/cm), 60~90 min;④紫外灯照射下观察电泳情况,用凝胶图像分析系统观察、分析实验结果。
测出Fas、Bax、Bcl-2基因及β-actin产物的灰度值,并计算目的基因与β内参产物灰度值的比值,以此比值作为各组mRNA的相对表达量。
1.5Western bolot检测 (1)从-80 ℃冰箱内取出已解剖的耳蜗组织,加入细胞裂解液1 ml,匀浆后离心,将上清移至另一预冷的EP管中,按碧云天BCA蛋白浓度测定试剂盒测定蛋白含量后,将剩余蛋白样品加入等体积的2×SDS上样缓冲液,沸水中煮5分钟,冷却后分装样品,-20 ℃保存;(2)制胶:制备15%SDS-PAGE分离浓缩胶,4 ℃保存过夜;(3)加样,依次加入标准品和待分析样品,为避免边缘效应,可在未加的孔中加入等量的样品缓冲液;(4)SDS-PAGE电泳,加样完毕,盖好电泳槽的盖子,采用恒压浓缩胶80 V,分离胶120 V,电泳直至溴酚染料前沿下至凝胶末端处,即停止电泳;(5)从电泳装置上卸下凝胶玻璃板,用去离子水冲洗干净;(6)免疫印迹操作-转膜;(7)一抗孵育洗涤;(8)二抗孵育洗涤;(9)暗房内用发光剂发光,显影,定影,扫描,用凝胶图像处理系统分析目标条带的灰度值。
1.6统计学方法 应用SPSS 13.0统计软件,采用单因素方差分析对数据进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1耳蜗形态学改变 对照组耳蜗组织结构正常,未出现变性萎缩等异常改变,而照射组照射后耳蜗组织结构均出现了不同程度的损伤,并随着照射后时间的延长,组织结构的损伤加重(图1)。
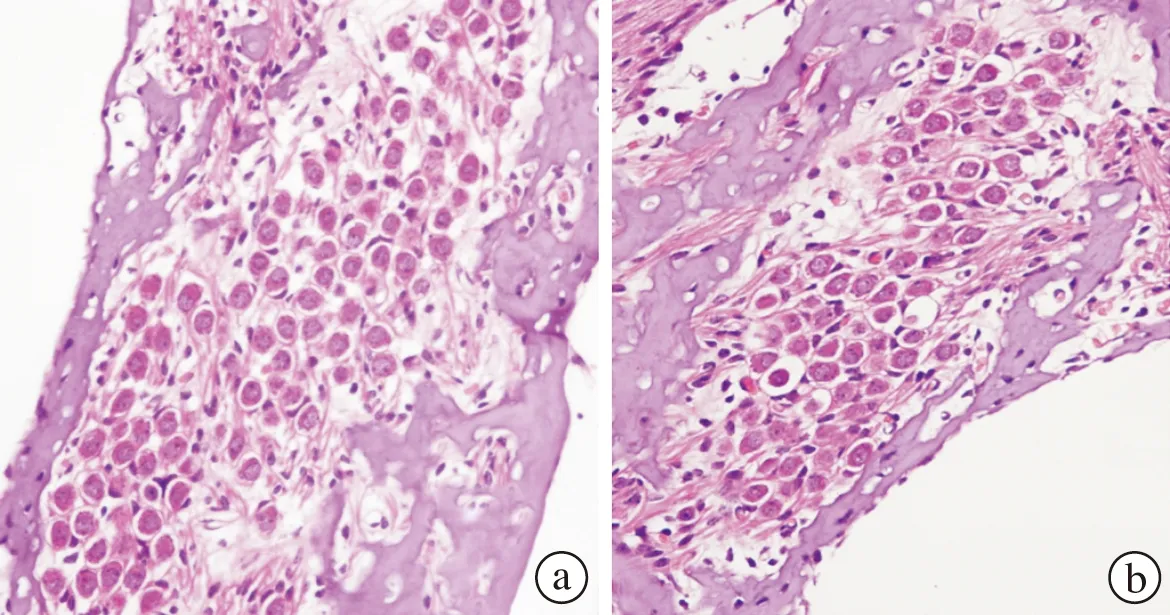

图1 各组耳蜗HE染色图
a、c、e分别为对照组螺旋神经节细胞、Corti器、血管纹,其结构正常,无萎缩。b为照射后第4天SGC出现较明显的萎缩。d为照射后14天Corti器出现明显塌陷,毛细胞缺失改变。f为照射后14天血管纹出现轻微水肿、空泡形成(HE×400)
2.2各组耳蜗细胞凋亡相关基因的表达 各组耳蜗组织经RT-PCR扩增后产物电泳分别可见250(Fas)、177(Bax)、261 bp(Bcl-2)处条带,对照组豚鼠耳蜗中可见少量Fas、Bax、Bcl-2表达,照射组可见Fas mRNA表达上调,其中照射后第1、4天与对照组比较差异有统计学意义(P<0.05、P<0.01);照射后第1、4天Bax mRNA表达与对照组比较差异有统计学意义(P<0.01);照射后各不同时间Bcl-2 mRNA表达与对照组比较差异无统计学意义(P>0.05);照射后第4天Bax/Bcl-2 的比值与对照组比较差异有统计学意义(P<0.05)(表2)。
2.3各组耳蜗Caspase 3、8、9蛋白的表达 经WB检测,对照组豚鼠耳蜗中可见少量Caspase 3、8、9蛋白的表达,照射组可见Caspase 3、Caspase 9的表达上调,其中照射后第1、第4、14天与对照组比较,差异有统计学意义(P<0.05、P<0.01)。照射后第1、4、7天Caspase 8表达与对照组比较差异有统计学意义(P<0.01)(表3)。

表2 对照组及照射组照射后不同时间耳蜗中凋亡相关基因的相对表达量
注:与对照组比较,*P<0.05,**P<0.01

表3 对照组及照射组照射后不同时间耳蜗Caspase3、Caspase8、Caspase9蛋白的相对表达量
注:与对照组比较,*P<0.01
3 讨论
头颈部肿瘤放疗常用的射线如电子射线、β射线、γ射线以及快中子射线等均能引起听觉系统的损伤,放疗后感音神经性聋呈显著的剂量相关性[7]。在电离辐射引起内耳损伤的动物实验中,有模拟临床放疗设计的多次少剂量分割辐射,能更好地模拟临床,缺点是造模时间长;有单次大剂量辐射的内耳损伤动物模型,可在短时间内造成明显的内耳急性损伤,其优点是造模时间短,可缩短动物实验研究的时间。单次大剂量照射40 Gy并不引起听力明显的变化[8],多次分割照射(每天一次2 Gy,每周5次)大于50 Gy时可引起较明显的听力改变[9,10]。李荧等[10]报道给予豚鼠一次性70 Gy照射后第3天其听功能损害以轻中度为主,到第2周后出现比较明显的中重度听功能损失。本研究前期工作参照以上学者的照射方法和剂量,制造急性耳蜗损伤的动物模型,发现一次性给予豚鼠耳颞部70 Gy照射后第14天时出现中度听力损失,并引起耳蜗细胞形态学的改变及出现螺旋神经节细胞的凋亡[11,5]。本研究结果显示,60Coγ射线一次性照射70 Gy后第4天,螺旋神经节细胞明显萎缩,在第14天Corti器明显塌陷,血管纹出现轻微的水肿。
细胞凋亡是生物体正常发育和生命活动中的一种不可缺少的调节机制[12,13],是由于内外环境变化或死亡信号触发以及在基因调控下所引起的细胞主动死亡过程。但在一些有害因素的刺激下,凋亡机制调节过度,引起过多的细胞凋亡,则可能导致机体疾病、畸形甚至死亡[13,14]。死亡受体途径和细胞内凋亡途径(线粒体途径)是细胞凋亡的两条主要途径[14~19],其中Caspase是发挥重要作用的凋亡效应蛋白,在与凋亡有关的十余种Caspase蛋白中,Caspase 8是Fas介导的细胞外凋亡途径的重要的启动子,Bax基因是Bcl-2家族中重要的促凋亡的基因,Bcl-2是该家族中抑制凋亡的基因,Bax通常与Bcl-2形成二聚体,Bax/Bcl-2比率决定细胞是否进入凋亡通路,并活化细胞内凋亡途径的重要启动子Caspase 9[18],Caspase 3位于Caspase 8和Caspase 9的下游,是细胞凋亡的执行者,并最终执行对细胞的程序性死亡[18,19]。
前期研究发现,螺旋神经节细胞在照射后不同时间点均有凋亡因子阳性表达上调[11],表明60Coγ射线可以引起耳蜗细胞的凋亡改变,豚鼠听功能的改变可能与耳蜗细胞的凋亡有关。本研究结果显示,60Coγ射线照射后在引起耳蜗损伤的早期,凋亡基因及凋亡蛋白在耳蜗中的表达上调,在照射后第7、14天凋亡蛋白仍持续表达上调。推测,在60Coγ射线刺激下,耳蜗细胞表面的死亡受体Fas接受胞外的死亡信号而引起Caspase 8的活化启动,Bax的表达上调可引起Caspase 9启动子的启动,位于Caspase 8和Caspase 9下游的Caspase 3是细胞凋亡的最终执行者,引起耳蜗细胞的程序性死亡。当然,细胞凋亡是一个非常复杂的过程,60Coγ射线照射所致的耳蜗细胞凋亡的具体机制还需进一步研究。
4 参考文献
1 Yilmaz YF, Aytas FI, Akdogan O, et al. Sensorineural hearing loss after radiotherapy for head and neck tumors[J]. Otol Neurotol,2008, 29 : 461.
2 Schultz C, Goffi-Gomez MV, Pecora Liberman PH, et al. Hearing loss and complaint in patients with head and neck cancer treated with radiotherapy[J]. Arch Otolaryngol Head Neck Surg,2010, 136:1 065.
3 何子毅,孟庆勇.电离辐射与细胞凋亡[J].国外医学放射医学核医学分册,2004,28:90.
4 Jendrossek V. The intrinsic apoptosis pathways as a target in anticancer therapy[J]. Curr Pharm Biotechnol,2012, 13:1 426.
5 谢利红,唐安洲,尹时华,等.60Co照射对豚鼠听力及耳蜗螺旋神经节细胞Caspase表达的影响[J].听力学及言语疾病杂志,2012,20:32.
6 Akmansu H, Eryilmaz A, Korkmaz H, et al. Ultrastructural and electrophysiologic changes of rat cochlea after irradiation[J]. The Laryngoscope,2004, 114:1 276.
7 王家东,丁大连,金西铭,等.一次性大剂量60钴辐射对豚鼠耳蜗影响的实验研究[J].听力学及言语疾病杂志,1999, 7:141.
8 Low WK, Tan MG, Chua AW, et al. 12th Yahya cohen memorial lecture: the cellular and molecular basis of radiation-induced sensori-neural hearing loss[J]. Ann Acad Med Singapore, 2009, 38: 91.
9 崔广帅,金大玉,邢巍巍,等.电离辐射对听功能影响的实验研究[J].听力学及言语疾病杂志,2010,18:65.
10 李荧,郭广威,苏纪平. 经圆窗膜给地塞米松改善放射致豚鼠内耳损害的研究[J].中华放射医学与防护杂志,2009, 29 : 590.
11 谢利红,唐安洲,尹时华,等.乙酰半胱氨酸在豚鼠放疗后耳蜗损伤中的防护作用[J].中华医学杂志,2012,92:989.
12 张建海,赫俊虎,王俊东,等. 细胞凋亡的生理意义及其检测技术[J].中国动物检疫,2004,21:43.
13 周义德,丁大连,郑宏良,等.强脉冲噪声导致的豚鼠耳蜗毛细胞凋亡及P53蛋白的表达[J].中华耳鼻咽喉头颈外科杂志,2011,46:54.
14 Richa RR, Sinha R. Apoptosis: molecular mechanisms and pathogenicity[J]. EXCLL Journal, 2009, 8:155.
15 Kim BM, Chung HW. Desferrioxamine (DFX) induces apoptosis through the p38-caspase8-Bid-Bax pathway in PHA-stimulated human lymphocytes[J]. Toxicol Appl Pharmacol, 2008, 228:24.
16 Menges CW, Altomare DA,Testa JR. FAS-associated factor 1 (FAF1): diverse functions and implications for oncogenesis[J]. Cell Cycle, 2009, 8:2 528.
17 Yamashita D, Minami SB, Kanzaki S, et al. Bcl-2 genes regulate noise-induced hearing loss[J]. J Neurosci Res, 2008, 86:920.
18 李光明,谢青,周霞.线粒体细胞色素C与细胞凋亡[J].国外医学流行病学传染病学分册,2003,30:26.
19 Golden EB, Pellicciotta I, Demaria S, et al. The convergence of radiation and immunogenic cell death signaling pathways[J]. Front Oncol,2012, 2:88.

