大鼠听皮层发育关键期胶质纤维酸性蛋白表达及听功能变化*
张志敏 华清泉 杨琨 吴莎
出生后早期,人和哺乳动物的听觉系统尚未发育成熟,在解剖和功能上具有相当大的可塑性,能够根据环境变化作出适应性的改变,功能和结构逐渐成熟,这段时间是听觉中枢发育的关键期。大鼠出生后听觉发育的关键期从第12天开始, 到第30天结束,而出生后的前28天以内是其听皮层发育的关键期[1~3]。星形胶质细胞(astrocyte,AST)是中枢神经系统中体积最大、数量最多、分布最广的一种胶质细胞,其数量几乎占到大脑总细胞数的50%,胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是星形胶质细胞成熟的特异性标志[4]。神经细胞发生、发育的全过程AST均发挥重要作用[5,6],AST影响神经元突触可塑性及相关机制的研究在现代神经科学研究中已成为关注的焦点[7~10]。本研究拟通过观察大鼠在听觉发育关键期听性脑干反应(ABR)的变化特点及GFAP的表达变化,进一步探讨星形胶质细胞在听皮层发育关键期可塑性中的作用。
1 材料与方法
1.1实验动物及分组 选择清洁级健康SD大鼠幼鼠50只,随机分为出生后第14、21、28、35和42天组,每组10只。所有动物均在SPF级动物房内饲养。
1.2ABR检测方法 各组大鼠腹腔注射0.5%戊巴比妥钠(50 mg/kg)麻醉后,在隔声屏蔽室内用TDT电生理工作站(美国 TDT公司)发声、放大、检测、记录click声诱发的双侧ABR反应阈。记录电极刺入头颅矢状缝与两外耳道连线交点头皮下, 参考电极放置在耳后皮下, 接地电极放置在大鼠鼻尖部皮下。交替短声刺激, 声源距外耳孔1.0 cm, 刺激间隔为0.1 ms, 滤波带通为100~2 000 Hz, 扫描时间为10 ms, 强度范围为20~110 dB SPL,叠加次数512 次, 以可以引出波Ⅲ的最小刺激强度为ABR反应阈。
1.3各组大鼠听皮层脑组织切片 各组大鼠完成ABR测试后,分别在1%的戊巴比妥钠(40 mg/kg)腹腔内注射麻醉下,开胸经左心室插管至升主动脉,快速灌注生理盐水冲洗至肝脏发白,然后用4%多聚甲醛灌注。固定30~40分钟后即断头处死,去除颅盖骨,取出脑组织块,固定于4%多聚甲醛24小时。根据大鼠脑立体定位图谱[11]对听皮层进行定位,在通风橱内用手术刀截取听皮层脑组织修平整并放脱水盒内,梯度酒精脱水,常规石蜡包埋制片。
1.4免疫组化染色检测各组大鼠听皮层GFAP表达 一抗为GFAP(兔抗)抗体(武汉谷歌生物科技有限公司,货号GB13038),二抗采用两步法抗兔/鼠通用型免疫组化试剂盒(DAKO,货号K5007)。按两步法抗兔/鼠通用型免疫组化试剂盒操作步骤进行免疫组化实验(一抗按1∶100比例稀释,湿盒内4 ℃孵育过夜;二抗为组化试剂盒内与一抗相应种属,HRP标记,室温孵育50 min)。
每组内每张切片在皮层随机挑选至少10个200倍视野进行拍照。拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。应用Image-Pro Plus6.0软件,选取相同的棕黄色作为判断所有照片阳性的统一标准,对每张照片进行分析,得出每张照片阳性的累积光密度值(IOD), 以每组所有照片的平均值代表该组的IOD值。
1.5Western blot分析各组大鼠听皮层GFAP表达 各组每只大鼠取50 mg听皮层组织,用冷TBS洗涤2~3次,去除血污,剪成小块置于匀浆器,加入10倍组织体积RIPA buffer冰上彻底匀浆, 将匀浆液转移至1.5 ml离心管中,振荡。冰浴30 min,期间用移液器反复吹打,确保细胞完全裂解。12 000 rpm/min离心5 min,收集上清采用Bradford法测定蛋白浓度。
Western blot法检测各组大鼠听皮层GFAP的含量,在蛋白标本中加入上样缓冲液后进行电泳,转移至PVDF膜。将转好的膜于室温下脱色摇床上用5%的脱脂牛奶(0.5%TBST配)封闭1 h,稀释一抗,4 ℃过夜,用TBST在室温下脱色摇床上洗三次,每次5 min,将二抗用TBST稀释3 000倍,室温下孵育30 min后,用TBST在室温下脱色摇床上洗三次,每次5 min,将膜蛋白面朝上与发光液充分接触,1~2 min后,去尽残液,包好,放入暗匣中曝光,最后用显影、定影试剂进行显影和定影。将胶片进行扫描存档,Alpha软件处理系统分析目标带的光密度值,以GFAP光密度值与对应内参actin光密度值的比值表示蛋白表达水平。
1.6统计学方法 应用SPSS13.0统计软件对各组实验数据进行t检验。
2 结果
2.1各组大鼠ABR反应阈比较 由表1可见,随着大鼠天龄逐渐增加,其ABR反应阈逐渐下降,其中,第14、21及28天组间差异有统计学意义(P<0.05),第28天组与第35天组间差异有显著统计学意义(P<0.01),而第35天组与第42天组ABR反应阈差异无统计学意义(P>0.05)。
2.2各组大鼠听皮层GFAP的表达比较 免疫组化染色结果显示随着大鼠出生后天龄逐渐增加,GFAP表达逐渐增强,其中第35天组与第42天组相比差异有统计学意义(P<0.05),其余各组间两两相比差异有显著统计学意义(P<0.01)(表1、图1);Western blot检测结果(图2)显示第14、21、28、35和42天组大鼠GFAP蛋白表达水平分别为1.00±0.06、3.07±0.07、4.92±0.05、6.88±0.03、8.92±0.04,各组间两两比较差异均有统计学意义(P<0.05)。

组别ABR反应阈(dB SPL)GFAP平均累积光密度值(IOD)第14天组 1 084.5±4.97474.36±234.56第21天组 1 070.5±3.69*1 465.93±474.96△△第28天组 1 058.5±5.80*2 163.06±353.36△△第35天组1 037.0±4.83** 6572.01±808.88△△第42天组1 035.5±3.697 244.37±932.90△
注:*与第14天组及组间比较,P<0.05;**与第28天组比较,P<0.01;△与第35天组比较,P<0.05;△△与第14天组及各组间比较,P<0.01
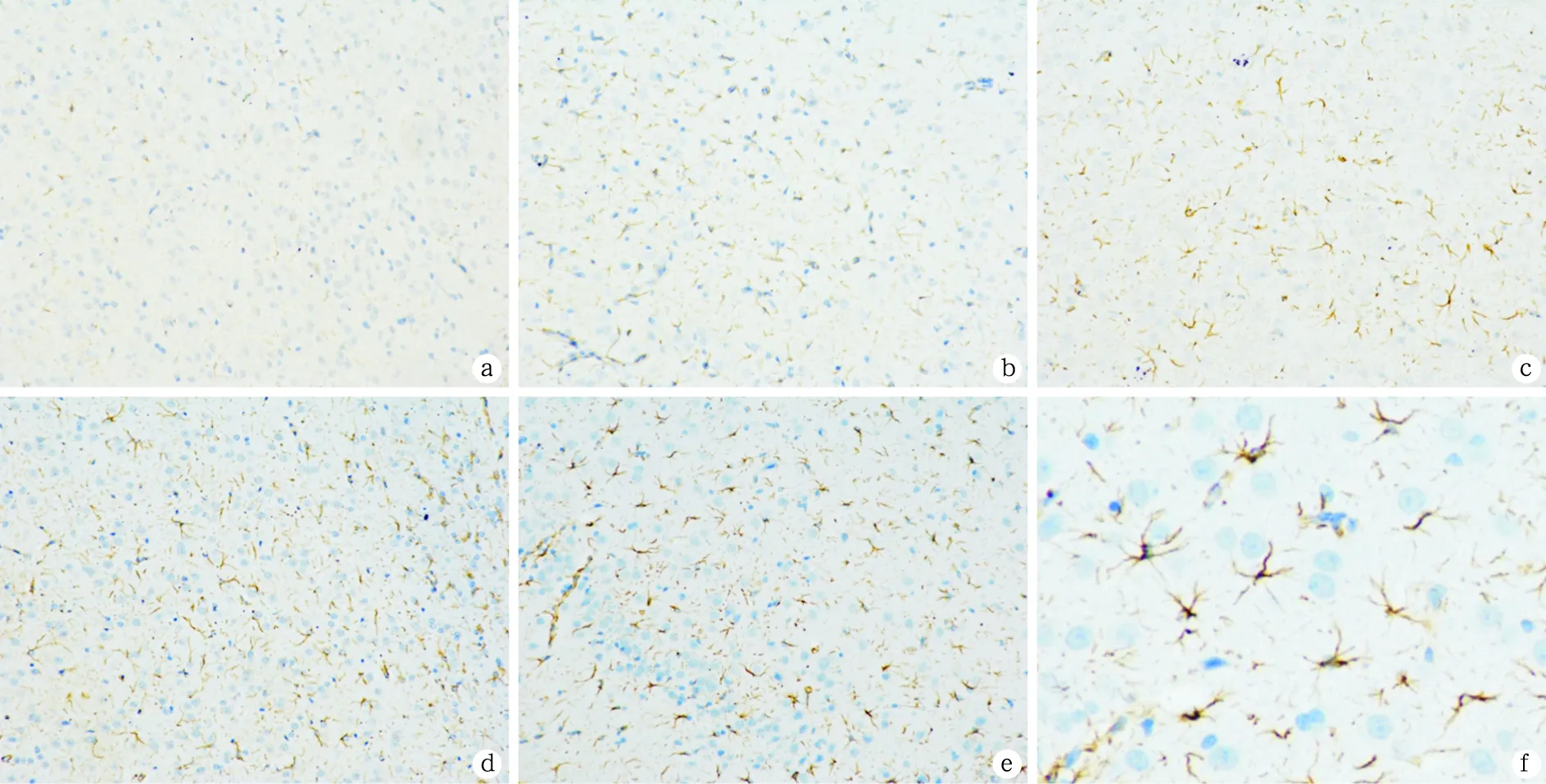
图1 各组大鼠听皮层GFAP表达(免疫组化染色×200)
a、b、c、d、e分别为第14、21、28、35和42天组大鼠听皮层GFAP的表达,f为听皮层GFAP阳性表达的星形胶质细胞局部放大图

图2 Western blot检测各组大鼠听皮层GFAP蛋白表达水平
3 讨论
研究证实,运动、视觉、嗅觉、体感及听觉等系统的发育均存在关键期[12],早期声环境的改变可对大鼠听觉的发育产生重要影响[13,14]。星形胶质细胞是中枢神经系统内数量最多,分布最广的胶质细胞,不仅对神经元具有绝缘、营养、保护和支持作用,而且在中枢神经系统损伤和修复过程中也具有重要的作用[15,16];诸多研究表明,胶质细胞在中枢神经系统发育过程中直接影响了突触形成及其功能的完善;Prfieger等[17]发现,当把分离纯化的大鼠视网膜神经节细胞(retinal ganglion cells,RGCs)在无胶质细胞的培养基中培养时,RGCs形成的突触虽然超微结构正常但自发性突触活动较少,且在突触传递中失败率高;而与胶质细胞共同培养的RGCs,其自发性突触后电流的频率和强度均显著增加,而且极少出现传递失败;进一步的研究表明,星形胶质细胞和少突胶质细胞,无论其是否与RGCs直接接触,都能明显增加RGCs自发的兴奋性突触后电流(excitatory postsynaptic currents,EPSCs)的平均频率和强度;Ullian等[18]报道在有AST条件下培养的RGCs突触总数是无AST培养的RGCs的7倍,此外,从培养基中移除AST后6天,RGCs的突触数量减少至原来的l/4,同时突触前、后对应分子的免疫反应性消失,表明AST不仅明显增加突触稳定性,而且是维持突触所必需的;谭来勋等[19]通过研究AST在神经系统发育成熟过程中突触可塑性的调控规律,发现AST在大鼠海马神经元突触形成及其功能完善过程中可能发挥了重要作用。
GFAP作为星形胶质细胞的中间丝和细胞骨架蛋白,被认为是反映星形胶质细胞的可靠指标[20],GFAP表达增多主要表现在星形胶质细胞体积增大和数量增多,星形胶质细胞可以通过这种体积和数量的变化来改变其与神经元之间的生理联系,进而影响突触的可塑性,发挥其对神经信息的调节作用[21],促进听觉中枢神经网络系统的的发育成熟及完善。从文中结果看,随着出生后天龄的增加,大鼠ABR反应阈逐步下降,同时,其听皮层GFAP表达逐渐增强,而且在其出生后第28~35天即大鼠听觉发育关键期结束时,ABR反应阈下降与GFAP表达增强均有一个跨越。这种大鼠听功能的不断完善(ABR反应阈逐渐下降)与听皮层GFAP表达增强相藕联现象提示,在大鼠听觉发育关键期,星形胶质细胞可能参与其听皮层的发育成熟过程,星形胶质细胞可能通过数量的增多及功能的完善使大鼠的听功能逐步发育完善,其具体机制有待进一步研究。
4 参考文献
1 Games KD, Winer JA. Layer V in the rat auditory cortex: projections to the inferior colliculus and cintralateral cortex[J].Hear Res, 1988, 34: 1.
2 Nakahara H , Zhang LI, Merzenich MM. Specialization of primary auditory cortex processing by sound exposure in the critical period[J]. Proc Natl Acad Sci USA, 2004, 101:7170.
3 Zhang LI, Bao S, Merzenich MM. Disruption of primary auditory cortex by synchronous auditory inputs during a critical period[J]. Proc Natl Acad Sci USA, 2002,99:2309.
4 于常海,赵睿.承载期望的“星”:星形胶质细胞[J].科学(上海),2007,59:13.
5 Eng LF,Vanderthaeghen JJ,Bignami A,et al.An acidic Protein isolated from fibrous astrocytes[J].Brain Res,1971,28:351.
6 薛庆善,郭畹华.大鼠大脑皮质星形胶质细胞的体外培养及其促神经突起生长作用研究[J].神经解剖学杂志,1996,02:151.
7 Azcoitia I, Santos-Galindo M, Arevalo MA, et al. Role of astroglia in the neuroplastic and neuroprotective actions of estradiol[J]. Eur J Neurosci,2010,32:1995.
8 Magistretti PJ. Neuroglial metabolic coupling and plasticity[J]. Exp Physiol,2011, 96:407.
9 Gamrani H,Elgot A,El Hiba O,et al. Cellular plasticity in the supraoptic and paraventricular nuclei after prolonged dehydration in the desert rodent Meriones Shawi: Vasopressin and GFAP immunohistochemical study[J]. Brain Res,2011, 1375:85.
10 Henneberger C, Rusakov DA. Synaptic plasticity and Ca2+signalling in astrocytes[J].Neuron Glia Biol,2010, 6:141.
11 包新民,舒斯云.大鼠脑立体定位图谱[ M].北京:人民卫生出版社,1991.34~38.
12 Hensch TK. Critical period regulation [J]. Annu Rev Neurosci, 2004,27:549.
13 Bures Z, Grecova J , Popelar J, et al . Noise exposure during early development impairs the processing of sound intensity in adult rats[J] . Eur J Neurosci, 2010, 32: 155.
14 Leibovici M, Safieddine S, Petit C. Mouse models for human hereditary deafness[J] . Curr Top Dev Biol, 2008, 84: 385.
15 Dong Y,Benveniste EN.Immune function of astroeytes[J].Glia,2001,36:180.
16 朱长庚.星形胶质细胞[J].解剖学报,1990,21:441.
17 Prfieger FW, Barres BA. Synaptic efficacy enhanced by glial cells in vitro[J]. Science,1997, 277:1684.
18 Ullian E, Sapperstein SK, Christopherson KS, et al., Control of synapse number by glia[J].Science, 2001, 291:657.
19 谭来勋,孙圣刚,段申汉,等.大鼠海马星形胶质细胞对突触可塑性的影响[J].卒中与神经疾病, 2005,12:158.
20 Stallcup WB,Beasley L.Bipotential glial precursor cells of the optic nerve express the NG2 proteoglycan[J].J Neurosci,1987,7:2737.
21 寇盛斌,吕来清,潘三强,等.大鼠在学习记忆时内侧隔核星形胶质细胞GFAP表达的变化[J].解剖学研究, 2004,26:245.
——关键期

