经兔耳动脉与经股动脉插管行肝动脉造影的比较研究
武贝,高杨,席玮,张秀明,郭震,张静渊,余辉,朱步銮,陈世晞,陈骏
·实验研究Experimental research·
经兔耳动脉与经股动脉插管行肝动脉造影的比较研究
武贝,高杨,席玮,张秀明,郭震,张静渊,余辉,朱步銮,陈世晞,陈骏
目的评价经兔耳中央动脉插管行肝动脉造影的可行性,并与经股动脉入路比较。方法将28只健康大白兔随机分成经股动脉入路组14只和耳中央动脉入路组14只(左耳7只,右耳7只)。用泰尔茂穿刺套管针行动脉穿刺,外套管留作后续插管的鞘,以1.8 F微导管行肝动脉插管。了解两种方法插管的成功率,比较两组总的操作时间和每一步操作时间,观察术后动物的生存质量。结果两组动物均成功完成肝动脉造影。经股动脉组所需剃毛时间为(54.0±13.0)s,经耳动脉组不需此步骤。经股动脉组和经耳动脉组获得动脉入路时间分别为(585.0±249.0)s和(83.0±41.0)s,组间差异有统计学意义(P<0.001);肝动脉造影时间分别为(230.5±86.0)s和(257.0±82.0)s,组间差异无统计学意义(P= 0.260 2);修复入路时间分别为(211.0±83.0)s和(90.0±0.0)s,组间差异有统计学意义(P<0.001),总操作时间分别为(1 125.5±199.0)s和(419.5±134.0)s,组间差异有统计学意义(P<0.001)。术后,经股动脉组动物穿刺侧下肢活动受限,经耳动脉组动物无明显异常。结论经兔耳动脉入路行肝动脉造影可行。与经股动脉入路相比,经耳动脉插管的操作时间短、创伤小、且不会留下肢体残疾。
肝动脉造影;动脉;放射学,介入性;动物实验
兔是介入诊疗较常用的实验动物之一,适合于肿瘤性及血管性疾病的介入诊疗实验研究[1]。传统的兔肝动脉造影通过局部解剖暴露一侧股动脉作为入路,该方法操作相对复杂、耗时且术后易留下兔肢体残疾。有文献报道经兔耳中央动脉入路的可行性[2-4]。在此基础上,本实验采用泰尔茂套管穿刺针行耳动脉穿刺入路,套管留作导管鞘,进而以微导管行肝动脉造影。整个操作过程一步完成,无需置入传统的血管鞘以及导丝和导管的反复交换。该方法操作时间短、成功率高、创伤小,可用于兔经动脉介入诊疗的实验研究。
1 材料与方法
1.1 材料
1.1.1 实验动物28只健康大白兔,普通清洁级,雌雄不限,体重2.5~3.0 kg,由东南大学动物实验中心提供[许可证号:SYXK(苏)2010-0004]。
1.1.2 实验器材影像设备:PHILIPS平板FD20 DSA机。实验用相关器械:直剪、直镊、止血钳、有齿镊、无齿镊、持针器、缝合圆针、三角针,0号、2号、5号缝合丝线、玻璃分针、18 G穿刺套管针、0.014英寸×180 cm PTCA导丝(Asahi Intecc,Tokyo,Japan)、1.8 F×130 cm微导管(Terumo,Tokyo,Japan)等。对比剂及药物:碘佛醇注射液(320 mgI/ ml,江苏恒瑞医药股份有限公司),苯巴比妥钠(100 mg/支),肝素(12 500 U/支),青霉素(80万u/支),2%利多卡因注射液,地塞米松注射液(5 mg/支)等。
1.2 方法
将实验兔随机分为经股动脉入路组14只和经耳中央动脉入路组14只。所有实验兔术前禁食36 h,禁水12 h[5],术前0.5 h肌注青霉素80万u,地塞米松2mg。术后所有实验兔连续3 d肌注青霉素80万u。
1.2.1 经耳动脉入路14只实验兔中,插管经左耳中央动脉入路7只、经右耳中央动脉入路7只。操作步骤:①以苯巴比妥钠100mg/kg经耳缘静脉推注麻醉。②实验兔俯卧位,局部乙醇消毒。耳中央动脉位于兔耳的中心位置,与耳缘平行走行[6]。18 G套管针经皮穿刺兔耳动脉,穿刺针的外套管进入血管腔,边向前推套管,边退出针芯,少量肝素抗凝,外套管留做鞘,尾部用三通帽封住,外鞘管胶布固定。记录操作时间为穿刺入路时间。③移除三通帽引入1.8 F微导管和0.014英寸的导引导丝入耳中央动脉(图1)。注入约1m l对比剂获得从颈动脉到胸主动脉的路图,手动操纵导丝入肝固有动脉,然后跟进微导管手推对比剂行肝动脉造影(图2a)。记录时间为肝动脉插管时间。④从耳中央动脉拔除微导管和血管鞘,穿刺点人工压迫约90 s。预实验及正式实验提示,兔耳中央动脉入路完全压迫止血均约需90 s,因此,将90 s作为经耳中央动脉入路修复穿刺口所需时间。
1.2.2 经股动脉入路操作步骤:①麻醉同经耳动脉入路,右腹股沟区剃毛,并记录时间。②实验兔仰卧位,右腹股沟区消毒、铺巾,局部皮下注射2%利多卡因3 ml,沿股动脉搏动纵行作一3 cm长切口,逐层分离皮下组织、筋膜、肌肉组织,玻璃分针分离股动脉鞘,暴露股动脉。2支2-0丝线分别置于右股动脉近端和远端的下方,结扎远端丝线,用18 G穿刺针直视下穿刺股动脉,待穿刺针的外鞘管进入血管腔,退出针芯,少量肝素抗凝后外鞘管留作鞘,其尾部用三通帽封住。结扎近端丝线,固定外套管鞘。记录穿刺进入股动脉的时间。③移除三通帽,引入1.8 F的微导管系统,将导管超选入肝固有动脉,手推对比剂行肝动脉造影(图2b)。记录经股动脉行肝动脉造影时间。④拔出微导管和外鞘管,结扎股动脉,用无菌生理盐水将手术切口冲洗干净,依次逐层缝合皮下组织和皮肤,局部消毒。记录切口修复时间。
1.3 统计学分析
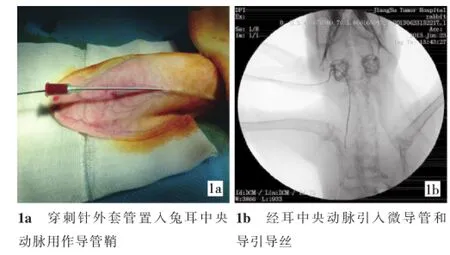
图1 经耳动脉入路插管
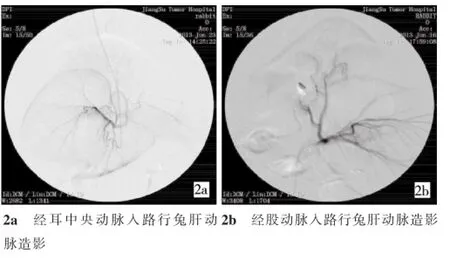
图2 经耳中央动脉和经股动脉入路兔肝动脉造影
采用SPSS软件进行统计分析。两组间操作的总时间和每一步所花费的时间用两个独立样本的非参数检验比较(W ilcoxon秩和检验)。经耳动脉入路组中经左耳和右耳行肝动脉造影所需时间也用两个独立样本的非参数检验比较(Wilcoxon秩和检验)。P<0.05为差异有统计学意义。
2 结果
经耳中央动脉入路组中,左耳动脉穿刺7只兔,2只因动脉内膜撕裂或皮下血肿而改为右侧耳动脉穿刺,并成功(计入右耳动脉入路组),故右耳动脉穿刺共9只均成功。
经耳动脉入路的获取动脉入路、修复入路以及手术操作总时间明显比经股动脉入路短,组间差异有统计学意义(P<0.05),而两组间肝动脉造影时间差异无统计学意义(P>0.05,表1)。
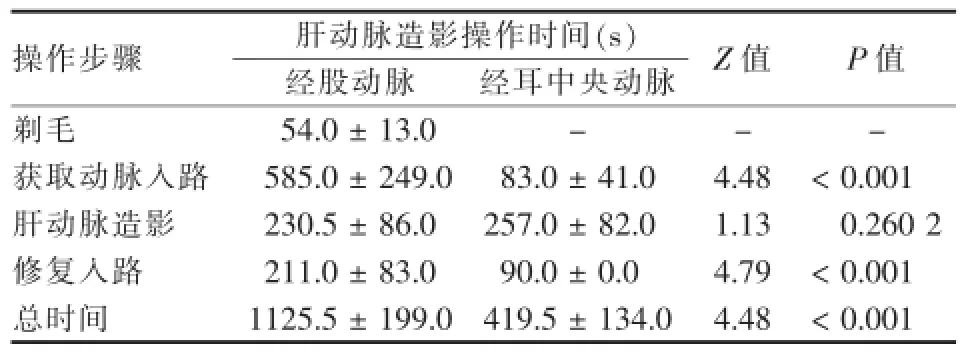
表1 经耳中央动脉和股动脉行兔肝动脉造影操作时间比较(M±Q)
在经耳动脉入路组中,左、右耳中央动脉行肝动脉造影时间分别为197~325 s,平均(257.0± 66.0)s和212~425 s,平均(266.0±189.0)s,二者间差异无统计学意义(Z=0.83,P=0.405 2)。
经股动脉组中有3只动物合并腹股沟区伤口局部少许渗液、脓肿形成,发生率21.4%(3/14)。
3 讨论
一般而言,大多数学者行兔肝动脉造影采用经股动脉入路[1,7-9],然而经股动脉入路需要剃除腹股沟区皮毛、切开皮肤、分离暴露兔股动脉、术后结扎穿刺侧股动脉、缝合修复切口并抗感染,故而手术时间相对较长,需较深的麻醉深度,术后一侧下肢因活动受限而残疾影响兔的生存质量,且限制了后续实验重复行肝动脉造影的次数[3,10]。
Karnabatidis等[4]介绍一种经耳中央动脉入路行兔血管内介入操作的方法代替经股动脉入路。他们采用传统的Seldinger穿刺技术[11],经耳中央动脉插入4 F血管鞘,然后再行相关的后续操作。然而,我们在预实验中发现,兔耳中央动脉内径比较细小,插入4 F血管鞘极易引起动脉撕裂、内膜剥离,技术难度相对较大,需操作者有很丰富的手术经验,置管成功率难以保证。我们对此操作技术进行了改良,穿刺针穿刺耳动脉成功后,直接将穿刺针的外套管前推入耳动脉并留作导管鞘,从而简化了操作步骤,缩短操作时间,操作技术上更加简便易行。穿刺针的外套管可以顺利通过本实验采用的直径1.8 F微导管。我们在预实验中发现,大多数情况下外套管能通过直径2.7 F微导管的前段部分,因而基本能满足动脉造影、药物灌注、血管栓塞等血管内介入诊疗操作的需要。
Figueiredo等[12]报道兔腹腔动脉开口位置相对固定,主要在胸12下1/3至腰1上1/3平面高度。有报道26.6%腹腔动脉开口于腰1椎体水平腹主动脉前壁及左前壁,74.4%开口于腰1、2椎间隙水平[1]。经耳中央动脉顺行插管时腹腔动脉和腹主动脉间成锐角,而该夹角在经股动脉组的逆行性插管时则成钝角。本实验的经验和数据表明经耳动脉入路与经股动脉入路都能顺利将导管插入腹腔动脉,不受腹腔动脉和腹主动脉夹角的影响,且两组在肝动脉造影时间方面无明显差异。本实验采用的是1.8 F微导管和J形头微导丝。如果有研究者需要用较粗大的导管,如4 F以上导管,则不同路径插管的难度和时间可能会有不同,需要在另外的实验中探索、证明。
虽然,经耳中央动脉入路与经股动脉入路行肝动脉造影所需时间差异无统计学意义,但在总的手术操作时间上,经耳中央动脉组比经股动脉组明显缩短,这是由于经耳动脉组穿刺部位不需剃毛,无需局部切开皮肤暴露动脉和修复动脉入路。有学者在猪模型研究中也得到相似结果,经耳中央动脉穿刺置管的时间比经股动脉短[2]。因为经耳中央动脉入路无需切开皮肤且总操作时间短,故而也比经股动脉入路承受更浅的麻醉深度。
由于从颈总动脉到胸主动脉间相对直行的路径,左耳中央动脉曾被认为是比较合适的血管穿刺入路[4]。然而,本实验研究结果提示经左、右耳中央动脉入路都能顺利地行肝动脉造影,两组操作时间差异无统计学意义(P=0.405 2)。
总之,与经股动脉入路一样,经耳动脉入路也可以用于行兔肝动脉造影。经耳动脉入路操作简便,手术时间短,动物所受创伤小,生存质量高。本实验改进的插管方法基本能满足一般介入诊疗实验要求。经股动脉入路则更容易置入传统的血管鞘,因而更适合内径较大的介入器械如支架或者球囊导管等血管性疾病的动物研究。在实际工作中,研究者可根据不同的实验目的灵活选用这两种方法。
[1]江雄鹰,罗荣光,黄金华,等.兔VX2肝癌模型建立与经兔股动脉微导管超选择性肝左动脉插管技术的探讨[J].介入放射学杂志,2011,20:214-217.
[2]Bass LM,Yu DY,Cullen LK.Comparison of femoral and auricular arterial blood pressure monitoring in pigs[J].Vet Anaesth Analg,2009,36:457-463.
[3]Miskolczi L,Nemes B,Cesar L,etal.Contrast injection via the central artery of the left ear in rabbits:a new technique to simplify follow-up studies[J].Am J Neuroradiol,2005,26:1964-1966.
[4]Karnabatidis D,Katsanos K,Diamantopoulos A,et al. Transauricular arterial or venous access for cardiovascular experimental protocols in animals[J].J Vasc Interv Radiol,2006,17:1803-1811.
[5]刘煌,李冉冉,陈文有,等.VX2肝癌兔肝动脉联合门静脉插管模型的建立及其手术方法的比较[J].肝胆外科杂志,2012,20:225-228.
[6]Ninomiya H.The vascular bed in the rabbit ear:microangiography and scanning electron microscopy of vascular corrosion casts[J].Anat Histol Embryol,2000,29:301-305.
[7]Kim HJ,Shin JH,Kim TH,et al.Efficacy of transarterial embolization with Arsenic trioxide oil emulsion in a rabbit VX2 liver tumormodel[J].JVasc Interv Radiol,2009,20:1365-1370.
[8]Mostafa EM,Ganguli S,Faintuch S,et al.Optimal strategies for combining transcatheter arterial chemoembolization and radiofrequency ablation in rabbit VX2 hepatic tumors[J].JVasc Interv Radiol,2008,19:1740-1748.
[9]Lee KH,Liapi E,Vossen JA,et al.Distribution of Iron oxidecontaining Embosphere particles after transcatheter arterial embolization in an animalmodel of liver Cancer:evaluation with Mr imaging and implication for therapy[J].JVasc Interv Radiol,2008,19:1490-1496.
[10]Liddell RP,Patel TH,Weiss CR,et al.Endovascularmodel of rabbit hindlimb ischemia:a platform to evaluate therapeutic angiogenesis[J].JVasc Interv Radiol,2005,16:991-998.
[11]Seldinger SI.Catheter replacement of the needle in percutaneous arteriography.A new technique[J].Acta Radiol,2008,434:47-52.
[12]Figueiredo M,Silva BX,Cardinot TM,et al.Celiac artery in New Zealand Rabbit:anatomical study of its origin and arrangement for experimental research and surgical practice[J]. Pesq Vet Bras,2008,28:237-240.
Hepatic artery angiography in experimental rabbits via transauricular arterial access:comparison
study w ith transfem oral arterial access
WU Bei,GAO Yang,XIWei,ZHANG Xiu-ming,GUO Zhen,
ZHANG Jing-yuan,YU Hui,ZHU Bu-luan,CHEN Shi-xi,CHEN Jun.Department of Radiology,Jiangsu Provincial Cancer Hospital,Nanjing,Jiangsu Province 210009,China
CHEN Jun,E-mail:13813939190@139.com
ObjectiveTo evaluate the feasibility of transauricular arterial access for hepatic artery angiography in a rabbit model,and to compare this access with transfemoral arterial access.M ethods Twenty-eight healthy rabbits were random ly divided into transauricular arterial access group(n=7 for left ear;n=7 for right ear)and transfemoral arterial access group(n=14).TERUMO entry needle was used to puncture artery,and then the outer p lastic cannula was used as a sheath for subsequent catheterization.Hepatic artery catheterization was performed with a 1.8 Fmicrocatheter.The procedure consisted of shaving the hair,obtaining arterial access,performing hepatic artery angiography and repairing the access site.The success rate of catheterizationswas analyzed.The total operation time and the time needed for each step were compared between the two groups.The survival quality of animals was determined after procedures.Results Hepatic artery angiography was successfully accomplished in all rabbits of both groups.The time required for shaving was(54.0±13.0)s in the transfemoral access group,while shavingmeasure was unnecessary in the transauricular arterial access group.The time needed to obtain arterial access,to perform hepatic artery angiography,to repair the access site and to perform the entire procedure in the transfemoral access group and in the transauricular access group were(585.0± 249.0)s and(83.0±41.0)s,respectively(P<0.000 1);(230.5±86.0)s and(257.0±82.0)s,respectively(P=0.260 2);(211.0±83.0)and(90.0±0.0)s,respectively(P<0.000 1);and(1125.5±199.0)and(419.5±134.0)s,respectively(P<0.000 1).The animals of transfemoral arterial access group suffered from restricted motion of lower extremity after angiography,while the animals of transauricular arterial access group showed no obvious abnormal activity.Conclusion Hepatic artery angiography via transauricular arterial access is technically feasible.The major advantages of transauricular arterial access,when compared with transfemoral arterial access,are shorter operation time for catheterization,less-invasive and no extremity disability left.(JIntervent Radiol,2014,23:329-332)
hepatic artery angiography;artery;radiology,interventional;experimental animal
R735.7
B
1008-794X(2014)-04-0329-04
2013-09-04)
(本文编辑:侯虹鲁)
国家自然科学基金面上项目(81271677)
10.3969/j.issn.1008-794X.2014.04.014
210009南京江苏省肿瘤医院放射科
陈骏E-mail:13813939190@139.com

