分散固相萃取—高效液相色谱检测花生中咪唑乙烟酸残留
谷珊山,李广领,郭梅燕,陈锡岭
(河南科技学院,河南新乡453003)
分散固相萃取—高效液相色谱检测花生中咪唑乙烟酸残留
谷珊山,李广领,郭梅燕,陈锡岭
(河南科技学院,河南新乡453003)
确立了花生籽粒样品中咪唑乙烟酸残留的甲醇涡旋提取、PSA净化的分散固相萃取样品前处理程序,建立并优化了高效液相色谱样品检测方法.结果显示:在确定的色谱条件下,咪唑乙烟酸在0.05~10.0 mg/L质量浓度范围内与对应的色谱峰面积线性响应良好,其回归方程为y=4.003 8x-0.275 6(R2=0.999 5),方法的检出限(LOD)为0.016 mg/L.咪唑乙烟酸0.05、0.10和0.50 mg/kg 3个添加水平的平均回收率均在85%以上,RSD均小于10%,方法的检测限(LOQ)为0.036 mg/kg.表明所建立残留样品前处理方法和高效液相色谱检测方法简便、经济、快速、灵敏,适于花生中咪唑乙烟酸残留量的检测.
咪唑乙烟酸;花生;分散固相萃取;高效液相色谱法;残留分析
咪唑乙烟酸(imazethapyr)属咪唑啉酮类除草剂,化学名称为5-乙基-2-(4-异丙基-4-甲基-5-氧代-2-咪唑啉-2-基)-3-吡啶羧酸,是美国氰胺公司于1984年成功研制的一种具有较强残留活性的广谱内吸选择性苗后除草剂[1-2],广泛应用于花生和大豆田中杂草的防除.其作用机制是通过抑制乙酰乳酸合成酶(ALS)的活性,导致蛋白质合成的混乱,从而干扰杂草体内DNA的合成和细胞的生长而杀死植物[3].目前,随着咪唑乙烟酸使用量和使用范围的不断扩大,其在农作物中的残留和对人类造成的危害备受关注.美国、日本和澳大利亚于2006年先后制定了严格的花生籽粒中咪唑乙烟酸的最大残留限量(MRL)标准[4],因此对花生籽粒及以其为原料的次级加工品的进出口贸易带来了极大的冲击[5].目前,关于咪唑乙烟酸的残留检测研究多集中于土壤、水、杂草植株和大豆等方面[3,6-12].国内外关于咪唑乙烟酸残留的前处理方法多采用液液萃取[13]、加速溶剂萃取[8]、微波辅助提取[9,12]和固相萃取技术[6,14-15]等,这些方法操作步骤繁琐、耗时,且有机溶剂消耗量大.本文拟通过系统的研究,以基质固相分散萃取(MSPD)为理论基础,建立具有快速、简单、廉价、有效、可靠、安全等特点的花生籽粒咪唑乙烟酸残留的QuEChERS(quick,easy,cheap,effective,rugged,safe)样品前处理方法和高效液相色谱检测方法,以满足花生籽粒中咪唑乙烟酸残留的检测要求.
1 材料与方法
1.1 主要仪器、试剂和样品
Agilent-1260型HPLC(配有自动进样器和紫外检测器),KH19A型离心机(湖南凯达科学仪器有限公司),EA10048型电子分析天平(上海佑科仪器仪表有限公司),涡旋仪,研钵.AR级甲醇、冰乙酸、氯化钠等,HPLC级乙腈,咪唑乙烟酸标准品(纯度99.0%,德国Dr.Ehrenstorfer GmbH公司),N-丙基乙二胺(PSA)(天津博纳艾杰尔科技有限公司).
所用花生籽粒来源于河南科技学院实验田,实验田内5 a内未施用咪唑乙烟酸.
1.2 标样溶液的配制
准确称取2 mg咪唑乙烟酸标准品,用色谱级纯乙腈溶解并定容至200 mL,得质量浓度为10 mg/L的标准储备液,于4℃冰箱中保存.取适量标准储备液用乙腈逐级稀释成质量浓度为0.05、0.10、0.50、1.00、5.00和10.00 mg/L的系列标准工作溶液待用.
1.3 样品前处理方法
准确称取5 g研磨过筛的花生籽粒样品于50 mL聚四氟乙烯具塞离心管中,加入V(甲醇)∶V(体积分数为1%的冰乙酸水溶液)=10∶1的提取液15 mL,涡旋提取5 min,加入6 g氯化钠,涡旋提取1 min, 4 000 r/min离心10 min;取上清液2 mL于2 mL聚四氟乙烯具塞离心管中,加入50 mg PSA,涡旋提取1 min,5 000 r/min离心5 min;取上清液过0.22 μm滤膜,待测.
1.4 检测条件优化
以Agilent ZORBAX Extend-C18柱(250 mm×4.6 mm,i.d=5 μm)为分离分析柱,通过选择流动相的种类、pH、比例及流速和柱温,改善分离分析效果,最终确定实验条件下样品中咪唑乙烟酸残留的最佳色谱分离分析条件.
2 结果与分析
2.1 样品前处理条件和检测条件的确定
实验发现,咪唑乙烟酸添加样品采用ZORBAX Extend-C18柱,柱温40℃,流动相为VA(体积分数为0.05%的冰乙酸乙腈溶液)∶VB(体积分数为0.4%的冰乙酸水溶液)=40∶60,流动相流速1.0 mL/min,检测波长254 nm,进样量10 μL,可获得花生籽粒样品中咪唑乙烟酸稳定、良好的分离效果.
图1为采用1.3中前处理技术制备的分析样品和采用上述色谱检测条件对样品的检测结果.在此条件下咪唑乙烟酸的出峰时间为6.972 min.
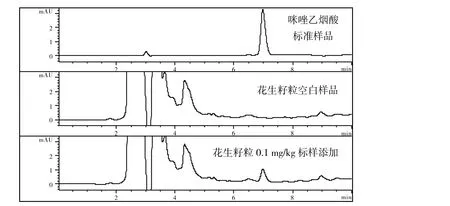
图1 优化条件下样品中添加咪唑乙烟酸的色谱Fig.1 Chromatogram of Imazethapyr in the sample under the optimal chromatographic conditions
2.2 分析方法的线性相关性
将质量浓度为0.05、0.10、0.50、1.00、5.00和10.00 mg/L的咪唑乙烟酸系列标准工作溶液,按照2.1所述方法进样检测,各浓度分别重复进样3次.结果显示,不同质量浓度的咪唑乙烟酸与所对应色谱峰面积呈现良好的线性响应关系,其回归方程为y=4.003 8x-0.275 6(R2=0.999 5)(见图2).以3倍S/N计算得该方法的LOD为0.016 mg/L.

图2 优化色谱条件下不同浓度咪唑乙烟酸的响应曲线Fig.2 Calibration Curve of Imazethapyr under the optimal chromatographic conditions
2.3 分析方法的回收率
采用模拟添加法,对空白样品进行0.05、0.10和0.50 mg/L 3个添加水平的加标回收率实验,各添加水平均做5个平行处理.添加后涡旋3 min使其与样品充分混合,静置30 min,使其达到物理吸附平衡,然后根据1.3所述前处理方法和优化的色谱检测条件进行提取、净化、检测,计算相应的添加回收率及相对标准偏差.结果见表1.
由表1添加回收率实验数据可以看出,花生籽粒样品中咪唑乙烟酸3个添加水平的平均回收率均在85%以上,且各添加水平3次重复处理间的RSD均小于10%,说明该方法的准确性、重复性良好.以10倍S/N计算得该方法的LOQ为0.036 mg/kg.
2.4 基质效应分析
对空白样品按1.3所述前处理方法进行提取净化后按1 mg/L标准溶液浓度进行添加,配制样品的基质标样,与等浓度溶剂标样对比测定,计算其基质效应[16].结果表明,样品基质的基质因子为9.6,基质效应不明显.
3 结论
本文根据分散固相萃取的基本原理,采用酸化甲醇为花生籽粒样品中咪唑乙烟酸残留的提取溶剂,以PSA为提取液的基质分散吸附净化材料,利用高效液相色谱-紫外检测器对花生籽粒样品中咪唑乙烟酸残留样品前处理和残留量分析方法进行了系统研究.结果表明,该样品前处理技术操作简便、提取溶剂用量少、省时省力、净化效果好,高效液相色谱检测方法线性范围宽、检测灵敏度高,花生籽粒中咪唑乙烟酸残留分析方法准确可靠,可满足咪唑乙烟酸在花生籽粒中残留定量检测要求.同时,本研究也为该除草剂在花生田的科学合理使用提供了理论依据和可靠的技术支持.
[1]Wepplo P J,Shaner D L.Imidazolinone Herbicides[M].Princeton:Academic Press,1991:15-29.
[2]赵爽,叶非.咪唑啉酮类除草剂的应用及降解[J].植物保护,2009,35(2):15-19.
[3]王学东,欧晓明,樊德方.林业除草剂咪唑烟酸在土壤、水及杂草植株中的残留检测[J].农药学学报,2002,4(1):89-92.
[4]潘灿平.最新农药残留限量标准手册[M].北京:中国计量出版社,2006:263
[5]周艳明,张寒松.花生中咪唑乙烟酸残留量的测定方法[J].农药,2009,48(12):906-908.
[6]张昌朋,刘新刚,徐军,等.固相萃取-超高效液相色谱-串联质谱法测定土壤中咪唑乙烟酸的残留量[J].农业环境科学学报,2010,29(10):2041-2044.
[7]Xiang W S,Su S Q,Wu Y Q,et al.Trace residue analysis of the herbicide imazethapyr in soil by gas chromatography-nitrogen/ phosphorous detector[J].Journal of Northeast Agricultural University,1997,4(1):73-77.
[8]陈婷婷,崔兆杰,李强,等.加速溶剂萃取-高效液相色谱法测定土壤中咪唑乙烟酸残留量[J].分析实验室,2007,26(9):95-98.
[9]Stout S J,Dacunha A R,Allardice D G.Microwave-assisted extraction coupled with gas chromatography/electron capture negative chemical ionization mass spectrometry for the simplified determination of imidazolinone herbicides in soil at the ppb level[J]. Analytical Chemistry,1996,68(4):653-658.
[10]Stout S J,daCunha A R,Picard G L,et al.Rapid,direct determination of imidazolinone herbicides in water at the 1 ppb level by liquid chromatography/electrospray ionization mass spectrometry and tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry,1996,44(8):2182-2186.
[11]赵云和,杨靖华,段玉玺,等.咪草烟在大豆田土壤中的残留动态[J].农药,2007,46(10):696-698.
[12]Stout S J,daCunha A R,Picard G L,et al.Microwave-assisted extraction coupled with liquid chromatography/electrospray ionization mass spectrometry for the simplified determination of imidazolinone herbicides and their metabolites in plant tissue[J]. Journal of Agricultural and Food Chemistry,1996,44(11):3548-3553.
[13]李成,锁然,王凤池,等.高效液相色谱-串联质谱法同时测定红小豆中残留的6种咪唑啉酮类除草剂[J].色谱,2008,26(6):726-730.
[14]马婧玮,陈黎,王金芳,等.SPE-HPLC法测定土壤中咪唑乙烟酸的残留量[J].农药,2007,46(12):843-845.
[15]李成,锁然,王凤池,等.固相萃取-高效液相色谱法同时检测红小豆中咪唑啉酮类除草剂[J].中国食品学报,2008,8(5):142-147.
[16]许鹏军,高晓莎,陶晡,等.分散固相萃取-气相色谱四极杆质谱联用测定9种果品中的螺螨酯残留[J].分析化学, 2008,36(11):1515-1520.
(责任编辑:邓天福)
Determination of imazethapyr residue in peanut by HPLC-UVD with dispersive SPE
Gu Shanshan,Li Guangling,Guo Meiyan,Chen Xiling
(Henan Institute of Science and Technology,Xinxiang 453003,China)
A method was developed for the determination of the imazethapyr residue in peanut by using QuEChERS and HPLC-UVD.The imazethapyr residue in peanut sample was vortex extracted by the methanol and purified by PSA,and than analyzed by using HPLC-UVD with Agilent ZORBAX Extend-C18 column.The chromatographic conditions of analysis were critically optimized and the results showed good linearity in the ranges from 0.05 to 10.0 mg/L(y=4.003 8x-0.275 6,R2=0.999 5).The detection limit of the method was 0.016 mg/L.And the average recoveries of imazethapyr in peanut samples were all above 85%at three spiking levels of 0.05,0.1 and 0.5 mg/kg with relative standard deviations all under 10%.Limit of quantification of imazethapyr in peanut was 0.036 mg/kg.The method is simple,economic,efficient and sensitive,and it is suitable for the determination of imazethapyr residues in peanut.
imazethapyr;peanut;dispersive SPE;high performance liquid chromatography;residue analysis
S481+.8
A
1008-7516(2014)02-0031-04
10.3969/j.issn.1008-7516.2014.02.008
2014-02-18
公益性行业(农业)科研专项(201203098);河南省教育厅科学技术研究重点项目(13B210003)
谷珊山(1987-),女,河南焦作人,硕士研究生.主要从事农药残留分析研究.
陈锡岭(1962-),男,河南滑县人,教授,硕士生导师.主要从事农药环境毒理学研究.

