祁连山冻土区水合物DK3和DK6钻孔中微生物脂肪酸特征及意义
焦 露, 苏 新*, 黄 霞, 刘浩东, 何 浩, 蒋宏忱, 王永莉
1)中国地质大学(北京)生物地质与环境地质教育部重点实验室, 北京 100083; 2)中国地质大学(北京)海洋学院, 北京 100083; 3)中国地质科学院矿产资源研究所, 北京 100037; 4)中国地质大学(武汉)生物地质与环境地质教育部重点实验室, 湖北武汉 430000; 5)中国科学院地质与地球物理研究所气体地球化学重点实验室, 甘肃兰州 730000
祁连山冻土区水合物DK3和DK6钻孔中微生物脂肪酸特征及意义
焦 露1, 2), 苏 新1, 2)*, 黄 霞3), 刘浩东1, 2), 何 浩2), 蒋宏忱4), 王永莉5)
1)中国地质大学(北京)生物地质与环境地质教育部重点实验室, 北京 100083; 2)中国地质大学(北京)海洋学院, 北京 100083; 3)中国地质科学院矿产资源研究所, 北京 100037; 4)中国地质大学(武汉)生物地质与环境地质教育部重点实验室, 湖北武汉 430000; 5)中国科学院地质与地球物理研究所气体地球化学重点实验室, 甘肃兰州 730000
利用脂肪酸法分析祁连山冻土带水合物区 DK3(含水合物)与 DK6(不含水合物)钻孔岩心中微生物多样性。本研究获得C12到C24二十六种脂肪酸(FA), 可以分成直链饱和脂肪酸(SSFA), 支链饱和脂肪酸(BSFA), 单键不饱和脂肪酸(MUFA), 环丙烷脂肪酸(CFA)和多键不饱和脂肪酸(PUFA)五大类型, 其中SSFA相对含量最高。由于特异性的脂肪酸指示特异性的微生物类群, 得出两根岩心中微生物类群主要由革兰氏阳性菌、革兰氏阴性菌和真菌组成。运用PAST(Palaeontological statistics, version 1.21)软件对已获得的脂肪酸进行主成分分析和聚类分析, 得出DK3与DK6岩心的微生物组成并无显著性差异, 但是DK3岩心中含水合物层位与不含水合物层位微生物组成有差异, DK6岩心中有水合物异常的层位与无异常的层位有差异。发现C16:1和C18:1这两类脂肪酸与甲烷异常有很好的对应关系, 从另一方面证明了水合物异常影响微生物组成分布。本次研究首次获得冻土沉积物中FA组成特征, 丰富了FA的分布范围, 研究结果扩大了真菌的分布深度, 具体机理有待更多的实验证明。
脂肪酸; 微生物多样性; 天然气水合物; 祁连山冻土带
天然气水合物通常赋存在海洋陆坡、深海、深湖以及永久冰土带(Kvenvolden et al., 1980)。祁连山冻土区地处青藏高原北缘, 冻土面积约104km2, 连续冻土区内的年平均地温为-1.5 ~ -2.4℃, 冻土层厚度为50~139 m(曹代勇等, 2009)。根据对祁连山冻土区内木里煤田33号钻孔的气体组分、年平均地表地温、冻土层厚度、地温梯度等资料综合分析, 得出该区域基本具备形成天然气水合物的温压条件(祝有海等, 2006)。2008年底至2009年初, 我国在木里煤田聚乎更矿区钻获天然气水合物实物样品,使我国成为世界上第一个在中低纬度高山冻土区发现天然气水合物实物的国家(祝有海等, 2009)。
已有的研究表明海底沉积物中天然气水合物矿藏的形成和保存与深部生物圈微生物活动密切相关(Battistuzzi et al., 2004; Boetius et al., 2004; Kotelnikova, 2002; 苏新等, 2010)。然而到目前为止,我国对冻土带水合物区的微生物研究仅有零星报道(韩路等, 2011), 尚在起步阶段, 国际上相关研究也很薄弱。常用来研究微生物多样性的方法大体上可分为两类: 基于现代分子生物学技术的方法和基于生物化学的方法(Kirk et al., 2004), 前者包括基于分子杂交技术的分子标记法和基于 DNA序列测定的研究方法; 后者包括传统的平板计数法、荧光染色法、Biolog微平板分析和生物标志化合物方法等(周桔等, 2007)。利用这些研究方法可以获得土壤或沉积物样品中微生物的数量, 微生物种群组成特征以及特征性微生物类群等信息(Elvert et al., 2005; Orcutt et al., 2005; Orphan et al., 2001)。
生物标志化合物的研究已涵盖了主要四种生物化学组分: 蛋白质(包括核酸)、碳水化合物(包括几丁质)、类脂物和木质素(谢树成等, 2003), 本次研究的重点是微生物中的脂肪酸(FA)。脂肪酸分析方法原理如下: FA是微生物细胞膜的主要成分, 正常的生理条件下微生物 FA含量恒定, 不同的微生物能够通过不同生化途径形成不同的FA, 部分FA总是特异性出现在某一类群微生物中, 因此可根据不同微生物类群特定的FA组成来揭示环境中微生物的类群。在冷泉区或水合物赋存区, 甲烷氧化菌参与了一个很重要的反应——甲烷厌氧氧化反应(Anaerobic Oxidation of Methane, AOM)(Hinrichs et al., 2002), 目前根据 FA图谱的不同特征已经可以将甲烷氧化细菌区分为两大类: 类型 I和类型 II, I型甲烷氧化细菌主要包含一系列 C16:1的酸(Bédard et al., 1989; Bodelier et al., 2009), II型甲烷氧化细菌则以C18:1酸为主(Bodelier et al., 2009),甲烷氧化菌的含量可以一定程度上反映该层位是否有甲烷异常。
现有的报道绝大多数是研究现代土壤以及沉积物中 FA组成分布特征, 如利用磷脂脂肪酸分析方法研究湖泊沉积物中微生物多样性(赵大勇等, 2009); 分析水稻根际土壤中微生物多样性(刘波等, 2010); 以及分析白洋淀沉积物微生物特征(董黎明, 2011)等。目前无人对水合物区的FA进行研究, 我国冻土带的FA研究也处于空白阶段。本研究选取祁连山水合物区两个钻孔 DK3(含有水合物)与DK6(不含水合物), 对不同深度的样品特别是含水合物或者有与水合物相关异常的深度样品中微生物的 FA进行提取和分析, 旨在获得该区域的微生物的 FA组成, 初步探讨含水合物与不含水合物钻孔中的微生物组成异同, 从而了解研究区微生物 FA特征并探讨其与甲烷和水合物对应关系。
1 材料和方法
1.1 样品与资料
样品来源于青藏高原祁连山冻土带天然气水合物区钻孔(图 1), DK3钻孔(东经 99°10.16′, 北纬38°05.34′)钻于 2009年, 进尺 765.01 m(祝有海等, 2010), 在 133.0—156.0 m, 225.1—240.0 m 和367.7—396.0 m三个层段采到天然气水合物实物样(卢振权等, 2010)。DK6钻孔(东经 99°11.7′, 北纬38°04.8′)钻于2010年, 井深356.15 m, 该钻孔仅局部层位可见裂隙中冒气泡、红外低温、井口涌气及偶见重烃迹象等异常(庞守吉, 2012), 未采到水合物实物样(武淑娇, 2012)。
两个钻孔最顶部均为第四系冰碛沉积或坡积物, 其下伏地层主体为中侏罗统江仓组和木里组。由于构造作用结果, 研究区中部为三叠系组成的一个复式背斜, 南、北两侧为侏罗系含煤地层组成的两个向斜。钻孔区位于南向斜, 并受到复杂断层作用, 多数钻井顶部有下伏地层的重复出露, 如 DK3孔顶部有江仓组和木里组部分层段出现, 而DK6孔有上三叠统部分地层出露(庞守吉, 2012)。
两个钻孔均处于沼泽区, 浅表层(<50 cm)土壤样品会受到部分上覆草根影响, 但是本研究选取样品均较深(最浅样品深度为 2 m), 一定程度上可以忽略草根对此次实验结果的影响。根据野外测井资料(郭星旺, 2011), DK3孔的简易测温结果显示, 钻探区内的冻土层厚度约95 m, 研究区冻土最大季节融化深度达 4.5 m, 季节融化层地面年平均地温-1.2~3.6℃(庞守吉, 2012)。
1.2 钻孔岩心气体样中烃类气体组分测试
由于缺少DK3钻孔岩心气体数据, 而DK2与DK3两个钻孔地理位置接近(庞守吉, 2012), 并且打钻深度与产出水合物层位深度接近(祝有海等, 2010), 因此将已发表的DK2岩心中烃类数据(黄霞等, 2011), 作为本研究DK3岩心的参考。
测试DK6孔110.5—274.9 m间15个气体样品中的CH4浓度和其碳同位素, 具体实验方法见文献黄霞等(2011)。
1.3 脂肪酸提取和测试
脂肪酸的提取和分析在中国科学院地质与地球物理研究所气体地球化学重点实验室完成。
选取的样品经过冷冻干燥以后, 研碎至大于80 目, 用二氯甲烷与甲醇溶液(3:1, 体积比)浸泡24 h,超声萃取 3次(15 min/次), 将三次萃取液过滤后浓缩至约 5 mL, 然后用 1 mol/L的 KOH的甲醇-水 (5:1, 体积比)溶液65℃皂化4 h, 冷却后用正己烷-乙醚(9:1, 体积比)溶液萃取(3次), 萃取液为非皂化中性类脂物。下层碱液用10%的盐酸酸化至pH为2, 然后用正己烷-乙醚(7:3, 体积比)溶液萃取(3次),将萃取液浓缩至约5 mL, 加20%的BF3甲醇溶液(60% BF3:甲醇=1:3), 70℃酯化1.5 h, 用正己烷-乙醚(9:1, 体积比)溶液萃取(3次), 萃取液自然干燥后用GC-MS分析(Garcette-Lepecq et al., 2004)。

图1 祁连山冻土区采样点分布(据祝有海等, 2010修改)Fig. 1 Location of two sampling drill holes (DK3 and DK6 ) in the Qilian Mountain permafrost (modified after ZHU et al., 2010)
气相色谱-质谱联用仪型号为HP 6890/HP 5973 NGC-MS。色谱分析条件: DB-5毛细管柱(50 m× 0.25 mm×0.25 μm), 初始温度80℃, 以3℃/min程序升温至300℃, 终温恒定20 min, 进样口温度300℃,载气为氦气。质谱分析条件: 电离方式 EI, 电离能量 70 eV, 离子源温度 230℃, GC-MS接口温度280℃(王永莉等, 2007)。
1.4 脂类命名法则
脂肪酸(FA)分子式用“X:YωZ(c/t)”表示。其中: X表示脂肪酸分子的总碳原子数; Y表示烯键的数目; ω表示双键的位置(从分子的羧基端记数); Z表示烯键或环丙烷链的位置; c和t分别表示顺式和反式同分异构体。
通常得到的脂肪酸可以分为直链饱和脂肪酸(SSFA), 支链饱和脂肪酸(BSFA), 单键不饱和脂肪酸(MUFA), 环丙烷脂肪酸(CFA), 羟基脂肪酸(OHFA)和多键不饱和脂肪酸(PUFA)6种(董黎明, 2011)。微生物除含有在其他生物中常见的SSFA以外, 一些脂肪酸类型可以作为特定功能微生物的生物标记物(颜慧等, 2006)。在现有的研究中, FA一般只能粗略地区分革兰氏阳性、阴性菌, 好氧细菌、厌氧细菌、真菌等。i15:0, a15:0, 16:0, 16:1, i17:0, a17:0, 18:1, cy17:0, cy19:0(i表示异构支链脂肪酸; a表示反异构支链脂肪酸; cy表示环丙烷基)的含量总和代表细菌含量; 好氧细菌(Aerobic bacteria)的特征 FA为: MUFA; 厌氧细菌(Anaerobic bacteria)的特征FA为: CFA(Bernard et al., 1991); 革兰氏阳性细菌(Gram-positive bacteria)的特征性FA为: BSFA (Liu et al., 2009); 革兰氏阴性细菌(Gram-negative bacteria)的特征性FA为: MUFA, CFA (Zelles, 1999);真菌(Fungi)的特征性FA为: PUFA(Kendrick et al., 1992)。
1.5 数据分析
运用 PAST(Palaeontological statistics, version 1.21)软件对钻孔不同深度样品中不同类型脂肪酸相对含量进行主成分分析(Principal components analysis, PCA), 提取PC1和PC2并作图, 探讨微生物的群落结构。分别对每一钻孔不同深度微生物群落进行聚类分析(Cluster analysis), 探讨同一钻孔中微生物群落的差异性(Hammer et al., 2008)。
2 结果与分析
2.1 微生物FA特征及变化
2.1.1 DK3和DK6钻孔中微生物FA特征组成
对DK3和DK6钻孔中FA的组成分析结果表明, FA组成具有一定共性: 两个钻孔均检测到C12 到 C24二十六种 FA, 有明显的偶碳优势, 并且C16:0相对含量最高。
本研究中获得的 FA可以分成 BSFA, MUFA, CFA, PUFA, SSFA五大类型(图2)。SSFA包括: C12:0, C13:0, C14:0, C15:0, C16:0, C17:0, C18:0, C19:0, C20:0, C21:0, C22:0, C23:0, C24:0。从各深度样FA变化来看, SSFA相对含量均较高, 约占FA总含量的87%~97%, 其余几种类型脂肪酸相对含量较低。
MUFA包括: C16:1ω9c, C16:1ω7c, C16:1ω5c, C18:1ω9c, C18:1ω9t, C18:1ω7c, C18:1ω7t, C20:1ω9c, C22:1ω9c。该类 FA也都出现于两个钻孔的所分析样中, 其在 DK3钻孔中相对含量(1%~12%)低于DK6钻孔(3%~21%)。
本研究检测到的PUFA为: C18:2ω6c。DK3钻孔中 PUFA 约占总含量的 0.4%~1.2%, 且在147—241.7 m深度范围内未出现该类脂肪酸; DK6钻孔PUFA约占总含量的0.4%~2%。
BSFA包括: a15:0, i16:0。在DK3钻孔该类FA仅出现于223.1 m样品中。而在DK6钻孔中BSFA分布深度范围相对较广, 出现在2 m, 175 m, 203.7 m, 274.9 m, 330.5 m深度, 相对含量为0.5%~5%, 有明显随深度加深相对含量减少的趋势。
仅检测到一类FA属于CFA: cy17:0, 且只出现在DK3钻孔231.5 m深度, 该深度获得天然气水合物。
2.1.2 微生物群落组成特征及垂直变化
根据特征性FA对微生物的指示作用分析得出,两个钻孔中微生物均由革兰氏阳性菌(G+)、革兰氏阴性菌(G-)和真菌(Fungi)组成, 并且革兰氏阴性菌均占最大比例(图2), 革兰氏阳性菌所占比例最少。

图2 DK3(a)、DK6(b)钻孔岩性、FA及微生物组成随深度的变化趋势图(据庞守吉, 2012改编)Fig. 2 Depth patterns of the lithology, FA and microbial communities from Drill Hole DK3(a) and DK6(b) (modified after PANG, 2012)
革兰氏阳性菌仅出现于在DK3钻孔223 m深度中, 相对含量为 0.45%, 该深度未获得水合物实物样。该类细菌在DK6钻孔含量也较少, 除了175 m,203.7 m两个深度以外, 其余革兰氏阳性菌出现的深度均无甲烷异常。
革兰氏阴性菌在DK3钻孔(142—390 m)中相对含量为0.8%~11.2%。在DK6钻孔(96—213 m)该类群相对含量为3%~12%。
2.2 微生物群落的统计学分析
2.2.1 微生物群落的主成分分析
钻孔中FA相对含量的PCA结果表明, 前两个主成分(PC1, PC2)解释了微生物群落结构总变异的82.6%, 其中第一主成分的贡献值为 69.9%(图 3)。两根钻孔不同深度样品比较均匀地分布在PC1坐标轴的左右端, DK3钻孔含水合物层位主要分布在PC1的右侧。第二主成分对微生物群落结构变异的贡献值为12.7%, DK6钻孔中有水合物异常的层位,主要分布在PC2的下侧。
2.2.2 微生物群落的聚类分析
分别将DK3、DK6钻孔不同深度样品中FA相对含量运用 PAST软件做聚类分析, 距离系数采用Bray-Curtis(图4)。
DK3钻孔分析结果得出, 不同深度的样品明显分为两大类, 147.8 m, 231.5 m, 389 m, 144.9 m为一类, 这 4个深度样均获得了水合物样品, 说明同一根岩心中含水合物的层位与不含水合物层位的 FA组成是有差异的。
对DK6钻孔进行分析, 不同深度的样品也分为两类, 167.5 m, 267.5 m为一类, 这两个深度样有甲烷异常, 说明同一根岩心有水合物的存在或者有甲烷异常在一定程度上会影响FA的分布。
3 讨论与结论
3.1 钻孔沉积物FA分布与甲烷和水合物分布对比
测试结果显示, DK2钻孔中 CH4浓度在120~380 mL/L范围内; 其碳同位素分布范围为-24.5‰ ~ -47.2‰, 平均值为-39.6‰。DK6钻孔中CH4浓度在20~870 mL/L范围内; 甲烷碳同位素分布范围为-39.3‰ ~ -58.1‰, 平均值为-48.7‰。前人研究表明在甲烷富集的环境如有孔虫壳体碳酸岩(Kennett et al., 2000)和自生碳酸岩(Peckmann et al., 2004)中,13C强烈负偏, 并且生物成因的甲烷有极负的13C值(狄永军等, 2003)。此次研究的两个钻孔中, 甲烷浓度在水合物产出层位和水合物异常层位均增高, 其甲烷碳同位素都强烈偏负(图5)。
在天然气水合物赋存区或甲烷异常区, 沉积物中会特异性地出现与甲烷相关的微生物, 比如参与AOM 这一重要生物地球化学反应的厌氧甲烷氧化古菌(Blair et al., 1995; Iversen et al., 1985; Boetius et al., 2004; Knittel et al., 2005)。除此之外, 还有另一部分好氧甲烷菌也会特异性存在(McDonald et al., 2008), 该类菌又被划分为I型和II型, I型甲烷氧化菌中 C16:1是最主要的脂类化合物(Bédard et al., 1989; Murrell et al., 1998), II型甲烷氧化细菌则以C18:1酸为主(Bodelier et al., 2009)。虽然这两种脂肪酸并不是甲烷氧化菌的特异性脂肪酸, 但是它们是甲烷氧化菌类脂物中最主要成分, 所以 C16:1和C18:1的相对含量一定程度上可以反映甲烷氧化菌所占的比例(Bodelier et al., 2009; Nichols et al., 1987)。

图3 DK3、DK6不同深度FA的主成分分析Fig. 3 Principal components analysis (PCA) of FA in different depths of DK3 and DK6
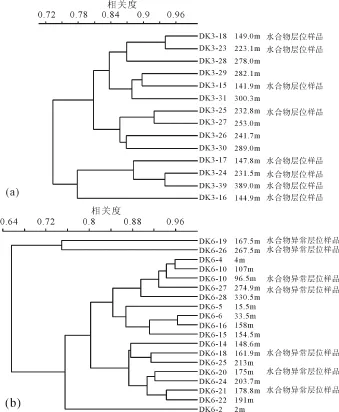
图4 DK3、DK6孔不同深度样品的聚类分析Fig. 4 Cluster analysis of FA in the different depths of Drill Hole DK3(a) and DK6(b)
两个钻孔中, MUFA相对含量均较低, 其中主要为C16:1, C18:1这两类脂肪酸。DK3钻孔C16:1的相对含量平均值为0.56%; C18:1相对含量平均值为 5.92%, 图 5阴影部分显示了钻孔有水合物异常的层位和水合物产出层位, 在这几个深度范围内, C16:1与 C18:1的相对含量较高, 与甲烷浓度有很好的对应关系。虽然在DK6钻孔未获得天然气水合物实物样品, 但是在有甲烷异常的深度范围内C16:1和C18:1两种FA也明显增多, 可以大致说明这两种 FA与甲烷的异常也存在着较好的对应关系。

图5 DK3、DK6岩心柱沉积物中与甲烷有关的特征FA随深度分布图Fig. 5 Depth patterns of the characteristic FA related to methane from Drill Hole DK3 and DK6
目前国内外对水合物区微生物多样性的研究重点集中在海洋环境水合物, 冻土带水合物区微生并且较多地出现在DK6钻孔无水合物异常中, 这一现象是否具有特异性, 以及是否可以用来区分含水合物和不含水合物钻孔中的 FA组成, 需要更多的后续研究进行验证。
3.2 冻土层微生物组成特征
根据测井资料显示, 研究区的冻土厚度为95 m(庞守吉, 2012)。本研究DK6钻孔有4个深度样属于冻土层沉积物, 分析冻土层沉积物样品中 FA的组成特征对拓宽 FA及微生物的研究载体具有重要意义。
在冻土层4个深度样品中SSFA均占有最优势地位, 并且随着深度的增加其相对含量减少; MUFA是第二大优势 FA, 也出现在每一个所分析的深度样中, 并且随着深度的增加其相对含量增加; PUFA未出现于15.5 m深度样中; 而BSFA只出现在最表层样品中(图6)。
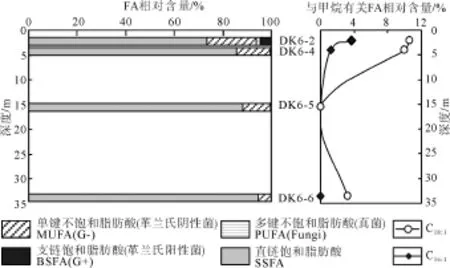
图6 DK6钻孔岩心冻土沉积物中FA随深度分布图Fig. 6 Depth patterns of all FA fractions and characteristic FA related to methane from permafrost of Drill Hole DK6
根据特征性 FA与微生物类群的对应性关系可以看出, 在DK6钻孔的浅表层(2 m), 微生物类群最丰富, 包含 G+、G-以及少量的 Fungi, 推测由于该处较接近地表, 有机质较于岩心深部含量丰富, 所以微生物所需营养物质较为充足。并且随着深度的增加, 微生物多样性明显降低, 在冻土层的较深部(33.5 m), 仅能识别出少量的G-。
DK6钻孔表层样品中, 两种与甲烷有关的微生物脂类(C16:1, C18:1)的含量均较高, 推测由于DK6钻孔上部断层发育(图 2b), 下覆地层中甲烷气体大量向上运移, 给以甲烷为生的微生物提供充足的养分, 因此与甲烷有关的微生物含量较高。
本次研究首次获得冻土沉积物中FA组成特征,更丰富了 FA的分布范围, 具体机理有待更多的实验进行证明。
3.3 钻孔中真菌分布特征
真菌几乎出现在两个钻孔的各深度样中, 相对含量为 0.5%~2%, 并且钻孔深部(300 m)仍然能检测到与真菌有关的FA。为了最大化获取生长所需的营养物质, 真菌通常生长在固体基质的表层及其内部, 或作为单细胞生活在水生环境中(Moss, 1986)。并且在目前现有的研究, 绝大多数是分析
10—50 cm 深度范围内沉积物中真菌的分布特征(Damare et al., 2006; Kabir et al., 1998; Neville et al., 2002)。
本次结果扩大了真菌的分布深度, 初步推测有以下两点原因: 真菌可存活于较深的岩石裂隙中;另一种原因是, 钻探过程中, 上部泥浆流入下部,但是由于岩石坚硬, 实验预处理阶段无法将岩心表层切除, 因此将钻孔上部代表真菌的FA带入下部。如图 2所示, 两个钻孔较浅深度和底部的微生物组成结构上有很大差异, 尤其是DK6极为明显, 这种现象一定程度上可以排除钻孔上部样品带入下部造成污染。在今后的研究中将进行改进方法, 以更准确地排除该部分误差。
综上所述, 本研究初次运用脂肪酸的分析方法对冻土带天然气水合物区岩心中的微生物群落的结构组成进行探讨, 所得结果丰富了冻土带中 FA数据, 发现C16:1和C18:1这两类脂肪酸与甲烷的异常有很好的对应关系, 并很难得的获得了冻土层沉积物中微生物FA组成记录。从另一方面证明了水合物异常影响了微生物组成分布。本次研究首次获得冻土沉积物中FA组成特征, 更丰富了FA的分布范围, 扩大了真菌的分布深度, 具体机理有待更多的实验进行证明。
曹代勇, 刘天绩, 王丹, 王佟, 文怀军, 潘语录. 2009. 青海木里地区天然气水合物形成条件分析[J]. 中国煤炭地质, 21(9): 3-6.
狄永军, 郭正府, 李凯明, 于开宁. 2003. 天然气水合物成因探讨[J]. 地球科学进展, 18(1): 138-143.
董黎明. 2011. 利用磷脂脂肪酸表征白洋淀沉积物微生物特征[J]. 中国环境科学, 31(11): 1875-1880.
郭星旺. 2011. 祁连山冻土区天然气水合物测井响应特征及评价[D]. 北京: 中国地质科学院.
韩路, 武淑娇, 李建华, 吕杰, 祝有海. 2011. 祁连山冻土区天然气水合物DK-2钻孔微生物群落[J]. 地质通报, 12: 11.
黄霞, 祝有海, 王平康, 郭星旺. 2011. 祁连山冻土区天然气水合物烃类气体组分的特征和成因[J]. 地质通报, 12: 7.
刘波, 胡桂萍, 郑雪芳, 张建福, 谢华安. 2010. 利用磷脂脂肪酸(PLFAs)生物标记法分析水稻根际土壤微生物多样性[J].中国水稻科学, 24(3): 278-288.
卢振权, 祝有海, 张永勤, 文怀军, 李永红, 王平康. 2010. 青海祁连山冻土区天然气水合物资源量的估算方法[J]. 地质通报, 29(9): 1310-1318.
庞守吉. 2012. 祁连山木里天然气水合物钻孔沉积构造特征及与水合物分布关系研究[D]. 北京: 中国地质大学(北京).
苏新, 陈芳, 张勇, 王媛媛, 焦露, 蒋宏忱, 董海良. 2010. 海洋天然气水合物勘查和识别新技术:地质微生物技术[J]. 现代地质, 24(3): 409-423.
王永莉, 方小敏, 艳白, 奚晓霞, 张玺正, 王有孝. 2007. 中国气候(水热)连续变化区域现代土壤中类脂物分子分布特征及其气候意义[J]. 中国科学(D辑)地球科学, 37(3): 286-396.
武淑娇. 2012. 祁连山冻土区天然气水合物可培养微生物研究及一株新种细菌的鉴定[D]. 北京: 北京化工大学.
谢树成, 梁斌, 郭建秋, 易轶, EVERSHED R, MADDY D, CHAMBERS F. 2003. 生物标志化合物与相关的全球变化[J]. 第四纪研究, 23(5): 521-528.
颜慧, 蔡祖聪, 钟文辉. 2006. 磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用[J]. 土壤学报, 43(5): 851-859.
赵大勇, 燕文明, 冯景伟, 袁守军. 2009. 磷脂脂肪酸分析在湖泊沉积物微生物生态学研究中的应用[J]. 化学与生物工程, 26(12): 17-20.
周桔, 雷霆. 2007. 土壤微生物多样性影响因素及研究方法的现状与展望[J]. 生物多样性, 15(3): 306-311.
祝有海, 刘亚玲, 张永勤. 2006. 祁连山多年冻土区天然气水合物的形成条件[J]. 地质通报, 25(1-2): 58-63.
祝有海, 张永勤, 文怀军, 卢振权, 贾志耀, 李永红, 李清海,刘昌岭, 王平康, 郭星旺. 2009. 青海祁连山冻土区发现天然气水合物[J]. 地质学报, 83(11): 1762-1771.
祝有海, 张永勤, 文怀军, 卢振权, 王平康. 2010. 祁连山冻土区天然气水合物及其基本特征[J]. 地球学报, 31(1): 7-16.
References:
BATTISTUZZI F, FEIJAO A, HEDGES S B. 2004. A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land[J]. BMC Evolutionary Biology, 4(1): 44.
BÉDARD C, KNOWLES R. 1989. Physiology, biochemistry, and specific inhibitors of CH4, NH4+, and CO oxidation bymethanotrophs and nitrifiers[J]. Microbiological Reviews, 53(1): 68-84.
BERNARD K A, BELLEFEUILLE M, EWAN E P. 1991. Cellular fatty acid composition as an adjunct to the identification of asporogenous, aerobic gram-positive rods[J]. Journal of Clinical Microbiology, 29(1): 83-89.
BLAIR N E, ALLER R C. 1995. Anaerobic methane oxidation on the Amazon shelf[J]. Geochimica et Cosmochimica Acta, 59(18): 3707-3715.
BODELIER P L, GILLISEN M-J B, HORDIJK K, DAMSTÉ J S S, RIJPSTRA W I C, GEENEVASEN J A, DUNFIELD P F. 2009. A reanalysis of phospholipid fatty acids as ecological biomarkers for methanotrophic bacteria[J]. The ISME Journal, 3(5): 606-617.
BOETIUS A, SUESS E. 2004. Hydrate Ridge: a natural laboratory for the study of microbial life fueled by methane from near-surface gas hydrates[J]. Chemical Geology, 205(3): 291-310.
CAO Dai-yong, LIU Tian-ji, WANG Dan, WANG Tong, WEN Hai-jun, PANG Yu-lu. 2009. Analysis of Formation Conditions of Natural Gas Hydrate in Muli Coalfield, Qinghai Province[J]. Coal Geology of China, 21(9): 3-6(in Chinese with English abstract).
DAMARE S, RAGHUKUMAR C, RAGHUKUMAR S. 2006. Fungi in deep-sea sediments of the Central Indian Basin[J]. Deep Sea Research Part I: Oceanographic Research Papers, 53(1): 14-27.
DI Yong-jun, GUO Zheng-fu, LI Kai-ming, YU Kai-ning. 2003. Disscussion of the origin of gas hydrate[J]. Advance in Earth Sciences, 18(1): 138-143(in Chinese with English abstract).
DONG Li-ming. 2011. Microbial characteristics in the sediments of Baiyangdian Lake utilizing phospholipid fatty acids analysis[J]. China Environmental Science, 31(11): 1875-1880(in Chinese with English abstract).
ELVERT M, HOPMANS E, TREUDE T, BOETIUS A, SUESS E. 2005. Spatial variations of methanotrophic consortia at cold methane seeps: implications from a high-resolution molecular and isotopic approach[J]. Geobiology, 3(3): 195-209.
GARCETTE-LEPECQ A, LARGEAU C, BOULOUBASSI I, DERENNE S, SALIOT A, LORRE A, POINT V. 2004. Lipids and their modes of occurrence in two surface sediments from the Danube delta and northwestern Black Sea: implications for sources and early diagenetic alteration: I. Carboxylic acids[J]. Organic Geochemistry, 35(8): 959-980.
GUO Xing-wang. 2011. Well Logging Response Characteristics and Evaluation of Gas Hydratein Qilian Mountain Permafrost[D]. Beijing: Chinese Academy of Geological Sciences(in Chinese with English abstract).
HAMMER Ø, HARPER D, RYAN P. 2008. PAST—Palaeontological STatistics, ver. 1.87, Zuerich[S]. PAST.
HAN Lu, WU Shu-jiao, LI Jian-hua, LÜ Jie, ZHU You-hao. 2011. Microbial community in DK-2 gas hydrate borehole, Qilian Mountain permafrost[J]. Geological Bulletin of China, 30(12): 1874-1882(in Chinese with English abstract).
HINRICHS K, BOETIUS A. 2002. The anaerobic oxidation of methane: new insights in microbial ecology and biogeochemistry[J]. Ocean Margin Systems: 457-477.
HUANG Xia, ZHU You-hai, WANG Ping-kang, GUO Xing-wang. 2011. Hydrocarbon gas composition and origin of core gas from the gas hydrate reservoir in Qilian Mountain permafrost[J]. Geological Bulletin of China, 30(12): 1851-1856(in Chinese with English abstract).
INAGAKI F, NUNOURA T, NAKAGAWA S, TESKE A, LEVER M, LAUER A, SUZUKI M, TAKAI K, DELWICHE M, COLWELL F S. 2006. Biogeographical distribution and diversity of microbes in methane hydrate-bearing deep marine sediments on the Pacific Ocean Margin[J]. Proceedings of the National Academy of Sciences of the United States of America, 103(8): 2815-2820.
IVERSEN N, JØRGENSEN B. 1985. Anaerobic methane oxidation rates at the sulfate-methane transition in marine sediments from Kattegat and Skagerrak (Denmark)[J]. Limnol. Oceanogr, 30(5): 944-955.
KABIR Z, O'HALLORAN I, WIDDEN P, HAMEL C. 1998. Vertical distribution of arbuscular mycorrhizal fungi under corn (Zea mays L.) in no-till and conventional tillage systems[J]. Mycorrhiza, 8(1): 53-55.
KENDRICK A, RATLEDGE C. 1992. Lipids of selected molds grown for production of n-3 and n-6 polyunsaturated fatty acids[J]. Lipids, 27(1): 15-20.
KENNETT J P, CANNARIATO K G, HENDY I L, BEHL R J. 2000. Carbon isotopic evidence for methane hydrate instability during Quaternary interstadials[J]. Science, 288(5463): 128-133.
KIRK J L, BEAUDETTE L A, HART M, MOUTOGLIS P, KLIRONOMOS J N, LEE H, TREVORS J T. 2004. Methods of studying soil microbial diversity[J]. Journal of microbiological methods, 58(2): 169-188.
KNITTEL K, LÖSEKANN T, BOETIUS A, KORT R, AMANN R. 2005. Diversity and distribution of methanotrophic archaea at cold seeps[J]. Applied and Environment Microbiology, 71(1): 467-479.
KOTELNIKOVA S. 2002. Microbial production and oxidation of methane in deep subsurface[J]. Earth-Science Reviews, 58(3): 367-395.
KVENVOLDEN K A, MCMENAMIN M A. 1980. Hydrates of natural gas: a review of their geologic occurrence[M]. US Department of the Interior, Geological Survey Circular: 825.
LIU Bo, HU Gui-ping, ZHENG Xue-fang, ZHANG Jian-fu, XIE Hua-an. 2010. Analysis on microbial diversity in the rhizosphere of rice by phospholipid fatty acids biomarkers[J]. Chinese Journal of Rice Science, 24(3): 278-288(in Chinese with English abstract).
LIU Y, YAO H, HUANG C. 2009. Assessing the effect of air-drying and storage on microbial biomass and community structure in paddy soils[J]. Plant and Soil, 317(1-2): 213-221.
LU Zheng-quan, ZHU You-hai, ZHANG Yong-qin, WEN Hai-jun, LI Yong-hong, WANG Ping-kang. 2010. Estimation method of gas hydrate resource in the Qilian Mountain permafrost area, Qinghai, China—a case of the drilling area[J]. Geological Bulletin of China, 29(9):1310-1318(in Chinese with English abstract).
MCDONALD I R, BODROSSY L, CHEN Y, MURRELL J C. 2008. Molecular ecology techniques for the study of aerobic methanotrophs[J]. Applied and Environmental Microbiology, 74(5): 1305-1315.
MILLS H J, HODGES C, WILSON K, MACDONALD I R, SOBECKY P A. 2003. Microbial diversity in sediments associated with surface-breaching gas hydrate mounds in the Gulf of Mexico[J]. FEMS Microbiology Ecology, 46(1): 39-52.
MOSS S T. 1986. The biology of marine fungi[M]. Great Britain: Press Syndicate of the University of Cambirge.
MURRELL J C, MCDONALD I R, BOURNE D G. 1998. Molecular methods for the study of methanotroph ecology[J]. FEMS Microbiology Ecology, 27(2): 103-114.
NEVILLE J, TESSIER J, MORRISON I, SCARRATT J, CANNING B, KLIRONOMOS J. 2002. Soil depth distribution of ecto-and arbuscular mycorrhizal fungi associated with Populus tremuloides within a 3-year-old boreal forest clear-cut[J]. Applied Soil Ecology, 19(3): 209-216.
NICHOLS P D, ANTWORTH C P, PARSONS J, WHITE D C, HENSON J M, WILSON J T. 1987. Detection of a microbial consortium, including type II methanotrophs, by use of phospholipid fatty acids in an aerobic halogenated hydrocarbon-degrading soil column enriched with natural gas[J]. Environmental toxicology and chemistry, 6(2): 89-97.
ORCUTT B, BOETIUS A, ELVERT M, SAMARKIN V, JOYE S B. 2005. Molecular biogeochemistry of sulfate reduction, methanogenesis and the anaerobic oxidation of methane at Gulf of Mexico cold seeps[J]. Geochimica et Cosmochimica Acta, 69(17): 4267-4281.
ORPHAN V J, HOUSE C H, HINRICHS K-U, MCKEEGAN K D, DELONG E F. 2001. Methane-consuming archaea revealed by directly coupled isotopic and phylogenetic analysis[J]. Science, 293(5529): 484-487.
PANG Shou-ji. 2012. Relationship between tectonic, sedimentation characteristics and distribution of gas hydrate in Muli Coalfield of Qilian Mountain[D]. China University of Geosciences(Beijing)(in Chinese with English abstract).
PECKMANN J, THIEL V. 2004. Carbon cycling at ancient methane-seeps[J]. Chemical Geology, 205(3): 443-467.
REED D W, FUJITA Y, DELWICHE M E, BLACKWELDER D B, SHERIDAN P P, UCHIDA T, COLWELL F S. 2002. Microbial communities from methane hydrate-bearing deep marine sediments in a forearc basin[J]. Applied and Environmental Microbiology, 68(8): 3759-3770.
SU Xin, CHEN Fang, ZHANG Yong, WANG Yuan-yuan, JIAO Lu, JIANG Hong-chen, DONG Hai-liang. 2010. Geomicrobiology as a New Tool for Exploration of Marine Gas Hydrates[J]. Geoscience, 24(3): 409-423(in Chinese with English abstract). WANG Yong-li, FANG Xiao-min, YAN Bai, XI Xiao-xia, ZHANG Xu-zheng, WANG You-xiao. 2007. Lipid distribution and its climatic significancein in modern soil sample from continuous climate change area of China[J]. Science China Earth Sciences, 37(3): 286-396(in Chinese).
WU Shu-jiao. 2012. The qilian permafrost zone of gas hydrate culture microbial analysis and identification of a new species of bacteria[D]. Beijing: Beijing University of Chemical Technology(in Chinese with English abstract).
XIE Shu-cheng, LIANG Bin, GUO Jian-qiu, YI Yi, EVERSHED R, MADDY D, CHAMBERS F. 2003. Biomarkers and the related global change[J]. Quaternary Sciences, 23(5): 521-528(in Chinese with English abstract).
YAN Hui, CAI Zu-cong, ZHONG Wen-hui. 2006. PLFA analysis and its applications in the study of soil microbial diversity[J]. Acta Pedologica Sinica, 43(5): 851-859(in Chinese with English abstract).
ZELLES L. 1999. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review[J]. Biology and Fertility of Soils, 29(2): 111-129.
ZHAO Da-yong, YAN Wen-ming, FENG Jing-wei, YUAN Shou-jun. 2009. Appl ications of Phosphol ipid Fatty Acid Analysis in the Microbial Ecology Studies of Lake Sediment[J]. Chemistry & Bioengineering, 26(012): 17-20(in Chinese with English abstract).
ZHOU Jue, LEI Ting. 2007. Review and prospects on methodology and affecting factors of soil microbial diversity[J]. Biodiversity Science, 15(3): 306-311(in Chinese with English abstract).
ZHU You-hai, LIU Ya-ling, ZHANG Yong-qin. 2006. Formation conditions of gas hydrate in permafrost of the Qilian Moutains, Northwest China[J]. Geological Bulletin of China, 25(1-2): 58-63(in Chinese with English abstract).
ZHU You-hai, ZHANG Yong-qin, WEN Huai-jun, LU Zhen-quan, JIA Zhi-yao, LI Yong-hong, LI Qing-hai, LIU Chang-ling, WANG Ping-kang, GUO Xing-wang. 2009. Gas Hydrates in the Qil ian Mountain Permafrost, Qinghai, Northwest China[J]. Acta Geologica Sinica, 83(11): 1762-1771(in Chinese with English abstract).
ZHU You-hai, ZHANG Yong-qin, WEN Huai-jun, LU Zhen-quan, WANG Ping-kang. 2010. Gas Hydrates in the Qilian Mountain Permafrost and Their Basic Characteristics[J]. Acta Geoscientica Sinica, 31(1): 7-16(in Chinese with English abstract).
Discrimination of Microbial Diversity by Fatty Acid in Drill Hole DK3 and DK6 in a Gas Hydrate Area, Qilian Mountain Permafrost
JIAO Lu1, 2), SU Xin1, 2)*, HUANG Xia3), LIU Hao-dong1, 2), HE Hao2), JIANG Hong-chen4), WANG Yong-li5)
1) State Key Laboratory of Biogeology and Environmental Geology, China University of Geosciences(Beijing), Beijing 100083; 2) School of Ocean Sciences, China University of Geosciences(Beijing), Beijing 100083; 3) Institute of Mineral Resources, Chinese Academy of Geological Sciences, Beijing 100037; 4) State Key Laboratory of Biogeology and Environmental Geology, China University of Geosciences(Wuhan), Wuhan, Hubei 430000; 5) Key Laboratory of Gas Geochemistry, Institute of Geology and Geophysics, Chinese Academy of Sciences, Lanzhou, Gansu 730000
The fatty acid (FA) method was used to evaluate microbial community diversity in (gas hydrate-bearing) Drill Hole DK3 and (hydrate-absent) Drill Hole DK6 in Qilian Mountain permafrost. 26 kinds of FA obtained in this study were divided into five types: BSFA, MUFA, CFA, PUFA and SSFA, with SFA being the dominantcomponent. Microbial community of the cores from the two drill holes contain gram positive bacteria, gram negative bacteria and fungi classified from specificity FA. Principal component analysis and cluster analyses of FA from the two cores were performed using the PAST (palaeontological statistics, version 1.21) program. No significant difference of microbial components was observed between DK3 and DK6, but there did exist obvious difference of microbial components between gas hydrate-bearing (or methane anomaly) layer and hydrate-absent (or methane anomaly-absent) layer. The authors found that C16:1, C18:1 and methane anomaly have very good corresponding relationship. These phenomena prove from another side that methane concentration and gas hydrate may affect microbial habitats in Drill Hole DK3 and DK6. This is the first study of FA composition characteristics in permafrost sediments, and the results enrich the distribution range of FA and also expand the distribution depth of fungi; nevertheless, more experiments are needed to prove the specific mechanism.
fatty acid; microbial diversity; gas hydrate; Qilian Mountain permafrost
Q547; Q938
A
10.3975/cagsb.2014.05.10
本文由天然气水合物勘查与试采工程国家专项项目“陆域天然气水合物环境监测及效应研究”(编号: GZHL20110327)和中国地质大学(北京)基本科研业务费专项资金项目“祁连山冻土区天然气水合物区沉积物中微生物多样性研究”(编号: 2011PY0195)联合资助。
2014-04-02; 改回日期: 2014-05-22。责任编辑: 魏乐军。
焦露, 女, 1987年生。博士研究生。主要从事水合物区地质微生物研究。通讯地址: 100083, 北京市海淀区学院路29号。电话: 010-82334651。E-mail: littlebunny7@163.com。
*通讯作者: 苏新, 女, 1957年生。教授, 博士生导师。主要从事微体古生物、海洋地质和天然气水合物调查与研究。通讯地址: 100083,北京市海淀区学院路29号。电话: 010-82335403。E-mail: xsu@cugb.edu.cn。

