高速逆流色谱分离纯化波棱瓜子中化学成分
杭伟,宋腾飞,段文娟,王晓,耿岩玲,杨丙田,张钦德
(1.山东中医药大学,山东 济南 250355;2.山东省分析测试中心,山东 济南 250014;
3.济南三峰生物工程技术有限公司,山东 济南 251400;4.山东中医药高等专科学校,山东烟台264000)
高速逆流色谱分离纯化波棱瓜子中化学成分
杭伟1,2,宋腾飞1,段文娟2,王晓2,耿岩玲2,杨丙田3,张钦德4*
(1.山东中医药大学,山东 济南 250355;2.山东省分析测试中心,山东 济南 250014;
3.济南三峰生物工程技术有限公司,山东 济南 251400;4.山东中医药高等专科学校,山东烟台264000)
采用高速逆流色谱对波棱瓜子乙酸乙酯提取物进行分离纯化,以石油醚-乙酸乙酯-甲醇-水(体积比2:6:3:5)为溶剂,上相为固定相,下相为流动相,流速2mL/min,转速850 r/min,共分离得到2个高纯度化合物,经过高效液相色谱检测,纯度均高于95%。该方法简便、快速、节省溶剂,可以对波棱瓜子中的化学成分进行快速有效的分离纯化。
高速逆流色谱;波棱瓜子;分离纯化
波棱瓜子,为葫芦科一年生攀缘草本植物波棱瓜(Herpetospermum pedunculosum(Ser.)C.B.Clarke)的干燥成熟种子[1],主要分布于我国西藏、云南以及印度、尼泊尔等地。本品性寒、味苦,具有清热解毒、去火降热及柔肝的功效,是一种传统常用藏药材,现代医学常用于治疗黄疸型传染性肝炎、胆囊炎、消化不良及赤巴病等[2],目前国内外对藏药波棱瓜子的化学成分研究相对较少。
高速逆流色谱法(high-speed counter-current chromatography,HSCCC)是一种不需要固态载体的液-液分配色谱技术,具有操作简便、可避免因不可逆吸附而引起的样品损失等优点,已被广泛应用于天然产物的分离纯化当中[3-4]。本文首次采用高速逆流色谱对波棱瓜子乙酸乙酯提取物进行分离纯化,得到了2个纯度大于95%的化合物,并采用质谱和核磁共振波谱法鉴定其结构,实现了对波棱瓜子中化学成分快速、有效的分离纯化。
1 材料、仪器与试剂
材料:波棱瓜子在四川康定地区一带收集,经四川中医药科学院方青茂研究员鉴定,为葫芦科一年生攀缘草本植物波棱瓜的干燥成熟种子。
仪器:TBP泵、GS10A型高速逆流色谱仪、多层聚四氟乙烯螺旋管(直径2.3 mm,分离体积230 mL,β值为0.5~0.8)、3057-11记录仪、8823B-紫外检测器;Waters 600-996高效液相色谱系统(配有光电二极管阵列检测器(PDA),Agilent 1100 Series6320 ion-trap质谱仪;Varian INOVA-600核磁共振波谱仪。
试剂:逆流色谱用乙酸乙酯、石油醚、氯仿和甲醇均为分析纯,所用水为纯净水;高效液相色谱用甲醇为色谱纯,所用水为纯净水。
2 实验方法
2.1 波棱瓜子乙酸乙酯提取物的制备
波棱瓜子药材5 kg,粉碎后用石油醚回流提取3次,每次2 h,将提取液过滤、合并、减压浓缩,得石油醚提取物234 g;残渣继续用乙酸乙酯回流提取3次,每次2 h,将提取液过滤、合并、减压浓缩,得到乙酸乙酯提取物185 g。
2.2 HSCCC分离
2.2.1 溶剂体系的配制
本实验溶剂体系为石油醚-乙酸乙酯-甲醇-水(体积比2:6:3:5),配约1.5 L,置于分液漏斗中,振荡使其完全混合后静置分层,平衡后将上下两相体系分开,上相作为固定相,下相作为流动相,分别超声脱气5~10 min,备用。称取波棱瓜子乙酸乙酯提取物200 mg,加入上下相各5 m L,振荡使其完全溶解,备用。
2.2.2 HSCCC制备分离过程
将溶剂体系中的上相(固定相)以20 mL/min的流速泵入HSCCC分离管内,待上相充满分离管后,调至主机转速为850 r/min,顺时针旋转,待转速稳定后,以2 mL/min流速泵入下相(流动相),检测波长254 nm。当流动相从主机口流出时,体系达到流体动力学平衡,再将已准备好的样品注入HSCCC仪器内,采集数据,根据图谱收集目标成分。
2.2.3 分配系数(Kd)的测定
根据相关文献报道的Kd值测定方法[5-6],取波棱瓜子乙酸乙酯提取物样品置于试管内,加入上下相各3 m L振荡,使样品完全溶解,静置分层,各取上下相5μL,用高效液相色谱进行检测,上相峰面积为A1,下相峰面积为A2,Kd=A1/A2。
2.3 高效液相色谱条件
C18色谱柱(250 mm×4.6 mm,5μm);流动相A:甲醇,流动相B:水;等度洗脱:0~30 min,60%A,40%B;流速:1 m L/min;检测波长:255 nm;进样量:5μL,柱温:室温。
3 结果与讨论
3.1 HSCCC分离条件优化
在高速逆流色谱法分离中,选择溶剂体系是分离中的关键环节,溶剂体系是否合适是由该目标化合物在其中的分配系数Kd来衡量的,对于目标化合物适宜的溶剂系统分配系数应在0.5~2之间[7]。本实验根据目标化合物的极性采用石油醚-乙酸乙酯-甲醇-水体系,因为这个两相体系具有较宽的极性范围以及良好的溶解度。如表1所示,选择了几种不同的溶剂系统,进行Kd值测量。当采用体积比为2:6:5:3及2:6:4:4的溶剂体系时,会导致分离的时间短,达不到良好的分离效果,难以实现目标化合物的分离纯化。采用体积比2:6:2:6的体系时,Kd值偏大,虽然取得了很好的分离效果,但是分离时间较长,分离效率低。实验结果表明,当采用体积比为2:6:3:5的石油醚-乙酸乙酯-甲醇-水体系时,目标化合物才能得到比较理想的分离效果,而且分离的时间较为合适。

表1 目标成分在不同溶剂系统中的分配系数Table 1 Kdof compounds in different solvent system
3.2 HSCCC分离纯化结果
选择石油醚-乙酸乙酯-甲醇-水(体积比2:6:3:5)体系,按照2.2节所述的方法对波棱瓜子乙酸乙酯提取物进行HSCCC分离,根据HSCCC谱图分别收集,结果如图1所示。经过HPLC检测,分别得到2个高纯度化合物,经冷冻干燥,得化合物1为11.4 mg,化合物2为15.7mg。结果如图2所示。

图1 波棱瓜子乙酸乙酯提取物高速逆流色谱图Fig.1 HSCCC chromatogram of Herpetospermum pedunculosum seeds ethyl acetate extract
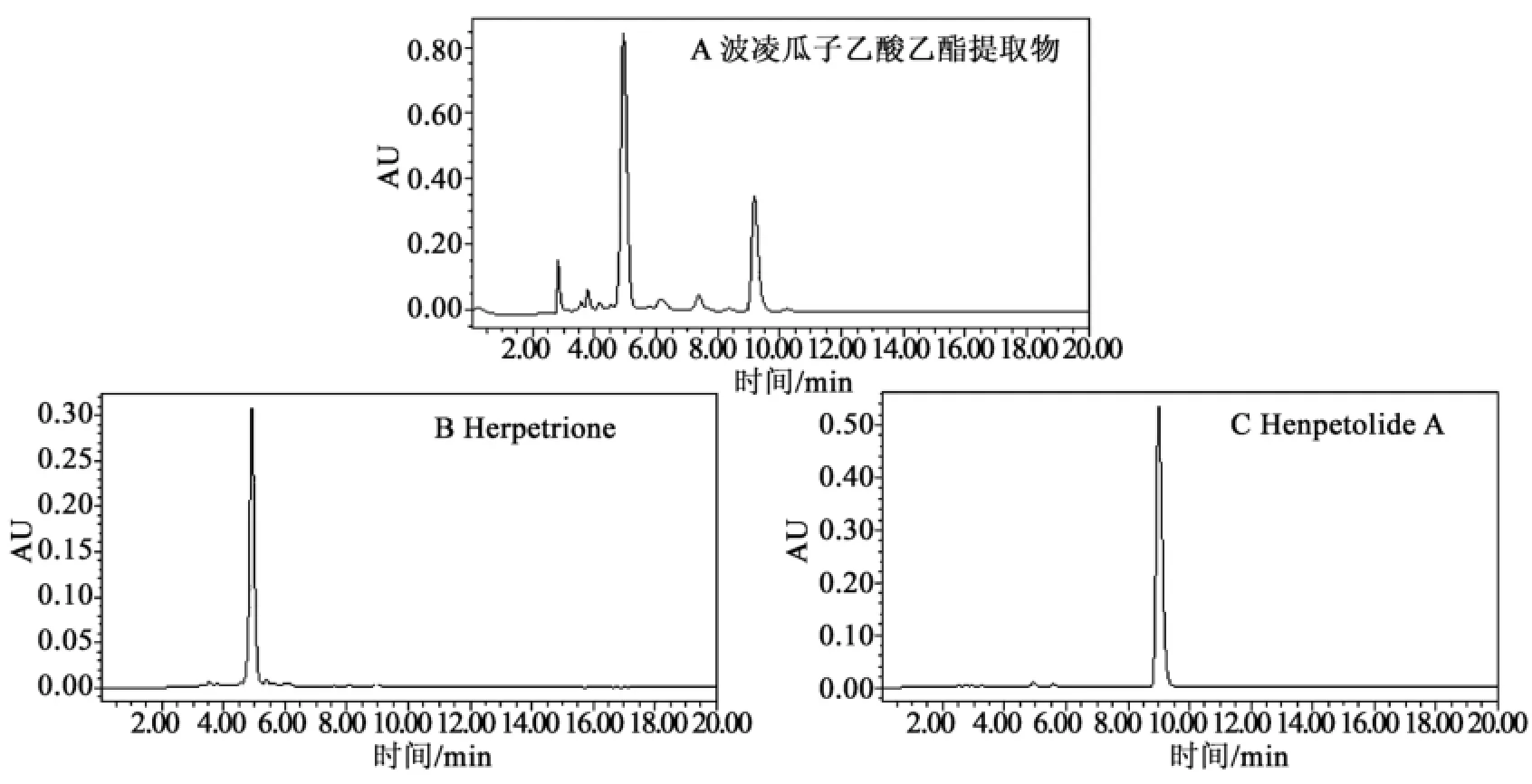
图2 波棱瓜子乙酸乙酯提取物及各化合物HPLC图Fig.2 HPLC chromatograms of extracts and individual compound from Herpetospermum pedunculosum seeds ethyl acetate extract
3.3 化合物结构鉴定
化合物1:ESI-MS(m/z):551.6[M-H]-.1H-NMR(CDCl3,600 MHz)δ:7.60(1H,dd,J=8.4 Hz,1.8 Hz,H-6),7.57(1H,d,1.8 Hz,H-2),6.87(1H,d,J=8.4 Hz,H-5),6.81(1H,dd,J=8.4 Hz,1.8 Hz,H-6″),6.77(1H,d,J=8.4 Hz,H-5″),6.60(1H,d,J=1.8 Hz,H-2″),6.19(1H,d,J=2.4 Hz,H-2′),5.69(1H,d,J=2.4 Hz,H-6′),5.20(1H,dd,J=7.8 Hz,4.8 Hz,H-8),4.68(1H,d,J=4.8 Hz,H-7),4.60(1H,d,J=4.8 Hz,H-7′),4.20(3H,m,-OCH3),3.85(2H,m,CH2OH),3.48(2H,s,3-OCH3),3.03(1H,m,H-9′),2.97(1H,m,H-9″).13C-NMR(CDCl3,600 MHz)δ:199.08(C-7),150.58(C-4),146.96(C-3″),146.71(C-3),146.38(C-3′),145.22(C-4″),142.16(C-1″),132.85(C-1′),132.82(C-1),128.88(C-6),124.22(C-5′),122.27(C-6′),118.94(C-6″),118.09(C-5″),114.25(C-5),114.05(C-2),108.56(C-2″),107.51(C-2′),85.81(C-7′),85.69(C-7″),71.67(C-9′),71.57(C-9″),63.89(CH2OH),56.09(3-OCH3),55.96(3′-OCH3),55.94(3″-OCH3),54.18(C-8″),54.06(C-8′),47.87(C-8).化合物1的ESI-MS、1H-NMR和13C-NMR数据与文献[8]报道基本一致,故鉴定化合物1为Herpetrione。
化合物2:ESI-MS(m/z):301.3[M-H]-.1H-NMR(DMSO,600 MHz)δ:10.04(1H,brs,-OH),8.04(1H,s,H-1′),7.60(1H,s,4′),7.07(1H,d,J=2.4 Hz,H-6),6.95(1H,d,J=2.4 Hz,H-8),5.78(1H,t,J=2.4 Hz,CH2OH),4.90(2H,d,J=2.4 Hz,CH2OH),3.98(3H,s,2′-OCH3),3.85(3H,s,7-OCH3);13C-NMR(DMSO,600 MHz)δ:160.49(C-2),159.24(C-7),154.25(C-2′),152.82(C-8a),147.05(C-3′),140.08(C-5),128.92(C-4),114.97(C-6),114.52(C-4′),113.61(C-3),111.05(C-4a),109.64(C-1′),101.34(C-8),63.78(CH2OH),56.15(2′-OCH3),56.04(7-OCH3).化合物2的ESIMS、1H-NMR和13C-NMR数据与文献[9]报道基本一致,故鉴定化合物2为Herpetolide A。
4 讨论
本文首次采用高速逆流色谱法对波棱瓜子乙酸乙酯提取物进行分离纯化,以石油醚-乙酸乙酯-甲醇-水(体积比2:6:3:5)溶剂体系,分离得到2个化合物,其纯度经高效液相色谱检测均高于95%。该方法简便、快速并节省溶剂,可以对波棱瓜子乙酸乙酯提取物进行快速有效的分离纯化,具有较好的实用价值。波棱瓜子化学成分研究是进一步进行活性研究及产品开发的必要步骤,建立相关成分快速有效的分离纯化方法,可以为波棱瓜子资源的开发应用提供技术支持。
[1]中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准藏药第一册[M].北京:中华人民共和国卫生部,1995:64.
[2]张梅,董小萍,王慧,等.藏药波棱瓜子脂肪油成分的气相色谱-质谱分析[J].成都中医药大学学报,2004,27(4):49-50.
[3]张天佑,王晓.高速逆流色谱技术[M].北京:化学工业出版社,2011.
[4]FANG L,LIU YQ,YANG B,et al.Separation of alkaloids from herbs using high-speed counter-current chromatography[J].Journal of Separation Science,2011,34(19),2545-2558.
[5]FANG L,LIU Y Q,ZHUANG H Y,et al.Combined microwave-assisted extraction and high-speed counter-current chromatography for separation and purification of xanthones from Garciniamangostana[J].Journal of Chromatography B,2011,879(28)3023-3027.
[6]WANG D J,GENG Y L,FANG L,etal.An efficient combination of supercritical fluid extraction and high-speed counter-currentchromatography to extract and purify(E)-and(Z)-diastereomers of a-asarone and b-asarone from Acorus tatarinowii Schott[J].Journal of Separation Science,2011,34(23):3339-3343.
[7]ITO Y.Golden rules and pitfalls in selecting optimum conditions for high-speed counter-current chromatography[J].Journal of Chromatography A.2005,1065(2)145-168.
[8]KAOUADJIM,FAVRE-BONVIN J.Herpetrione,a trimeric lignoide isolated from Herpetospermum caudigenum Wall[J].Tetrahedron Letters,1983,24(52):5881-5884.
[9]ZHANG M,DENG Y,ZHANG H B,et al.Two new coumarins fromHerpetospermum caudigerum[J].Chemical and Pharmaceutical Bulletin,2008,56(2):192-193.
Separation and purification of chem ical constituents in Herpetospermum pedunculosum seeds by high-speed counter-current chromatography
HANG Wei1,2,SONG Teng-fei1,DUAN W en-juan2,WANG Xiao2,GENG Yan-Iing2,YANG Bing-tian3,ZHANG Qin-de4*
(1.College of Pharmacy,Shandong University of Traditional Chinese Medicine,Jinan 250355,China;2.Shandong Analysis and Test Center,Jinan 250014,China;3.Three peak biological engineering technology Co.Ltd.,Jinan 250014,China;4.Shandong College of Traditional Chinese Medicine,Yantai 264000,China)
We originally employed high speed counter-current chromatog raphy(HSCCC)to separate and purify chemical constituents in ethyl acetate dissolvedHerpetospermum pedunculosumseeds.We separated two high-purity chemical compounds with petroleum ether-ethyl acetate-methanol-water(volume ratio of 2:6:3:5)as solvent,upper organic stationary phase and lower aqueous mobile phase,flow rate of 2 mL/min and rotation speed of 850 r/min.Their HPLC detected purities were more than 95%.The method is simple,rapid,solvent-saving and can rapidly and effectively separate and purify the chemical constituents inHerpetosperm um pedunculosumseeds.
high-speed counter-current chromatography;Herpetospermum pedunculosum seed;separation and purification
R284.2;O657.7
A
1002-4026(2014)01-0040-05
10.3976/j.issn.1002-4026.2014.01.007
2013-11-18
杭伟(1986-),硕士研究生,研究方向为中药活性成分。
*通讯作者,张钦德,教授,研究方向为中药质量控制与中药资源研究。Email:zhangqinde0929@163.com

