微生物学抗击耐药性
蔡立英/编译
微生物学抗击耐药性
蔡立英/编译

当耐甲氧西林金黄色葡萄球菌感染坦帕湾海盗队时,美国橄榄球界感受到了抗菌药物效力日益衰退带来的恐惧
● 科学回归自然界,去破译和瓦解病菌逃避抗菌药物的机制。
2013年10月20日,周日,美国橄榄球亚特兰大猎鹰队打败了坦帕湾海盗队。那天的比赛在亚特兰大闹市区心脏地带的乔治亚穹顶体育场举行,它不是因为比赛的精彩而被人们记住——两支队伍都在联赛中垫底,而是因为赛后发生的事情上了新闻头条。另一支“参赛队伍”——穿的不是橄榄球队服而是白色危险品防护服,进入了赛场并且对海盗队使用的更衣室进行了彻底的消毒。
追溯海盗队在佛罗里达州训练的时候,若干名队员就已经染上了耐甲氧西林金黄色葡萄球菌(MRSA),这是一种正变得日益流行的耐药性细菌——短短五年之内,美国被这种细菌感染的住院患者数量就翻了一倍。猎鹰队的官员担心MRSA已经从他们的对手海盗队的皮肤搭便车传给了亚特兰大猎鹰队。不只是海盗队担心感染 MRSA。 MRSA和其他葡萄球菌感染是如此常见,以至于美国的中学和大学会常规地监测它们。例如,北卡罗来纳州的教堂山中学在其摔跤手册中,就警告年轻运动员 “如果发现皮肤上有不寻常的斑点,要立即报告教练,”并且补充道:“为了防止感染其他队员,迅速处理这种异常情况至关重要。”这所中学里几乎每个人都认识曾感染过MRSA的人。
然而,我们感染耐抗菌药物病菌的最大风险可能并不来自于人类同胞,而是来自于牛、猪和鸡。2011年,美国大约80%的抗菌药物用于牲畜,使它们在集约化养殖环境下保持健康,并促进牲畜繁殖,因为这种环境下病菌感染很常见,且传播迅速(参见“公共卫生之抗生素政治”一文)。住在美国顶尖的猪肉生产州——爱荷华州的工厂化养猪场一公里内,感染MRSA的几率增长到近三倍。在英国,生猪养殖在斯塔福德郡和德比郡的扩张已经引起民众对失控的耐抗菌药物病菌的恐惧。
最近几年,学术研究者在一个隐喻的遗传学市场中,理解诸如MRSA、耐碳青霉烯肠杆菌科细菌和其他耐药性传播甚广的病菌如何传递逃避抗菌药物的机制方面,取得了飞跃性进展。
移动的耐药性
细菌通过两种基本途径形成耐药性:垂直方向上,通过在细胞复制时传递突变;水平方向上,耐药基因在称为质粒的DNA片段上从一个细胞传递到另一个细胞(参见图示“抗菌药物耐药性传播的两种途径”)。“质粒在基因水平转移(HGT)中是一个主导力量,”华盛顿大学(位于密苏里州圣路易斯)的微生物学家高塔姆·丹塔斯(Gautam Dantas)说,“但是也有基因水平转移能够发生的其他重要方式,包括通过噬菌体的作用把染色体的线性部分从一个细胞转移到其他细胞,以及从死细胞中摄取裸露DNA。”或是摄取不再封装在活的细菌细胞内,而是裸露在自由环境中的DNA。许多研究者现在认为基因水平转移是产生抗菌药物耐药性的主要驱动力。
“单个的基因会表达出单个的表型。”丹塔斯说,他指的是一个有机体观察得到的特征和特质。“但是我们不应该认为抗菌药物耐药基因是独自存在的。”任何一个基因都会受到相邻基因的影响,而且基因常常在基因簇中相互作用。一些基因还会变得更加可移动——擅长从一个细菌跳跃到另一个细菌。丹塔斯指出,宏基因组学方法——即对所有基因进行测序,以便“我们能识别出耐药基因和它们所处的遗传学情境”,将有助于我们阐明耐药机制,并且辨别那些特别会转移耐药性或是会与其他耐药基因共同作用而使其很难定位的基因。就像他解释的,“这种方法使得我们有可能区分出不会成为临床问题的那部分耐药基因和可能成为临床问题的那一小部分耐药基因。”
丹塔斯把“遗传上位性”(两个或更多基因相互影响)这个概念视为一种数量优势。“我们已经看到,比如,从进化学研究中,无论是回顾性的或是前瞻性的研究,那些编码了耐药性的特定基因倾向于聚簇在一起。”他说。
通过对耐药基因及其相互作用方式进行分类,丹塔斯希望科学家们能开始做预测。例如,某个特定的耐药基因从一个导致疾病群发的有机体转移到一个通常不导致疾病群发的有机体的可能性有多大?“这些基因在一个特定的有机体中表达出一个特定的表型的概率有多大?”

耐药性逆转
抗菌药物滥用的话题并不新鲜,经常被暗示为耐药性产生的原因。所以减少抗菌药物的使用将会增加抗菌药物的敏感性看起来似乎合乎逻辑。几年前,在瑞典的乌普萨拉大学和韦克舍医院,进化微生物学家丹·安德森(Dan Andersson)及其合作者检验了这个想法。减少抗菌药物的使用,要么是通过总体减少——也就是通过减少处方的总用量或是疗程长度,要么是使用可控制的特定抗菌药物。
安德森的研究组尝试了第二种方法,让一组病人使用一种抗菌药物直到产生高水平的耐药性,然后改变药方,让病人使用另一种药物,希望对第一种药物的耐药性会下降。这个实验失败了。“总体而言,我认为通过减少抗菌药物用量的方式很难降低耐药性,”安德森说,“经过一段很长的时间,耐药性是会降低,但是在很多情况下,耐药性降低的效果不够快。从我们医学的立场来看,这种逆转必须在几年内发生才是有用的。”一旦耐药性开始产生,就很难停止。
安德森指出,细菌与抗菌药物耐药性在逆转耐药性这个问题上所需的时间长度并不相同。导致抗菌药物耐药性的大多数机制对病菌会产生负面影响,比如减缓其生长,这就是人们所知的“适合度代价”。“这个代价可以非常小,但是几乎总是存在。也有一些例外是耐药性细菌实际上比易感性细菌的适合度更大,即使在缺少抗菌药物的环境下,这的确令人担忧。”在这些情况下,安德森说,“我们根本不会期待耐药性的逆转,因为那时驱动耐药性的逆转没有代价。”当耐药性提高了细菌的适合度之后,这个问题可能会扩大,即使不再继续使用抗菌药物。
耐药性加上适合度的增大,这个联合效应来自于一个叫做补偿进化的过程。安德森给出了一个例子:“我们研究了影响蛋白质合成的很多抗菌药物,这些抗菌药物与核糖体相连;如果耐药机制是由于核糖体中的某个蛋白质发生突变,补偿的突变可能会在核糖体的另一个蛋白质上发生。”所以第一个突变使细菌产生了耐药性,但是也使它生存的适合度下降了;第二个突变使细菌变得更适应环境,而没有降低其对抗菌药物的耐药性。简而言之,第二个突变在细菌的生存和繁殖能力方面补偿了第一个突变。最终的结果是细菌变得比以前更有抗菌药物耐药性,而且更适应环境。
总之,逆转耐药性并不是“我们应该指望在未来有可能的事情,”安德森断定,“它不会拯救我们,我们需要新的抗菌药物。”他补充道:“医药行业和学术研究者必须行动起来,研发新的抗菌药物,但是这个事情说起来容易做起来难。”
同样困难的事情是当一定人口的耐药性频率达到一个不再上升的最高值时,让医生停止使用药物,而医生仍然需要替代性药物。美国埃默里大学(位于佐治亚州亚特兰大)人口与进化生物学家布鲁斯·莱文(Bruce Levin)及其同事正在研究一个能显示耐药性水平何时会下降的模型。
在这个尚未发表的模型里,莱文与西班牙马德里的拉蒙-卡哈尔研究所微生物学家费尔南多·巴克罗(Fernando Baquero)以及挪威特罗姆瑟大学研究细菌进化的帕尔·约翰森(Pal Johnsen)指出,如果使用抗菌药物直到感染的细菌达到目标的耐药性频率——比方说 20%的细菌获得了耐药性——“我们能把对这种药物的耐药性水平保持在可控水平,”莱文说,“如果我们有无数种药物,那么效果会很好。”当然事实上我们没有,不仅缺乏新的抗菌药物,还存在多药耐药菌株的问题,它们对于很多年没使用的药物都具有耐药性。莱文的研究团队在日托中心采集的粪便样本表明,大约25%的隔离的大肠杆菌对链霉素有耐药性,这种抗菌药物除了用来治疗结核病之外,已经将近半个世纪没有作为疗法使用了。但是链霉素的耐药基因通过一个质粒被载运,这个质粒对于通常使用的抗菌药物具有耐药性。“在太多案例中,耐药性似乎都停留在这里了。”莱文说。
阻断通信
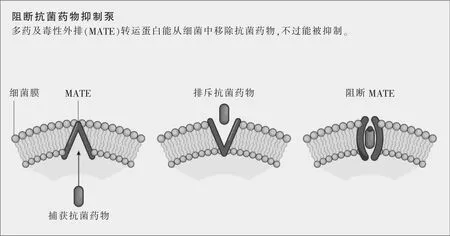
新的抗菌药物可能来源于对细菌的结构要素和通信网络的更深理解,想法是破坏那些导致抗菌药物耐药性的成分。日本东京大学的结构生物学家濡木理领导的一个研究组去年吸引了全世界的注意,他们宣布破解了一种多药及毒性外排(multidrug and toxic extrusion,MATE)转运蛋白的分子结构,正是这种蛋白赋予了抗菌药物耐药性。本质上说,MATE转运蛋白会从细菌中移除外物,比如毒素或抗菌药物。当揭开MATE转运蛋白的晶体结构时,濡木的研究组还描述了一种抑制MATE转运蛋白的分子,首次提示了阻断这种耐药机制的一种途径,并为药物研发者提供了一种可能的靶点(参见图示“阻断抗菌药物抑制泵”)。
“很多微生物学家都试图找到细菌的 ‘阿喀琉斯之踵’,从而制造新类别的抗菌药物。”普林斯顿大学的分子生物学家、霍华德·休斯医学研究所研究员邦尼·巴斯勒(Bonnie Bassler)说。例如,她的实验室正在寻找攻击被称为“群体感应(quorum sens-ing)”的细菌通信网络的方法,细菌在这个网络中能够确定它们何时数量众多,处于强势地位,可以进行攻击 [哈佛大学的光生物学家约翰·伍德兰德·黑斯廷斯(John Woodland Hastings)最早在1970年发表了群体感应的研究]。
简而言之,群体感应是这样起作用的:细菌分泌叫做自体诱导物的分子,如果细菌的浓度很低的话,这些分子就会漂走。细菌数量越多,自体诱导物也越多。“这是一种集聚效应,”巴斯勒说,“人群中的每一个细胞都在制造和分泌它自己的一份这种信号分子;细胞外的这种分子与细胞数量成比例增长。”她继续说:“所以当这种分子达到一个临界浓度,细菌就会与这些分子接触,从而推断出它们在附近有邻居。”这个特定的临界值或者叫“群体阈值”,取决于细菌的种类。
当致病细菌的数量达到这个群体阈值,接下来发生的事情对宿主来说会很丢脸。“细胞同时开启生物膜基因、毒性基因和毒素,并作为一个群体开始分泌使宿主生病的所有化合物,就像派遣了一个作战部队一样。”
就像巴斯勒所直率地描绘的,妙处在于阻断细菌的群体感应,这样即使当细菌集聚的时候,细菌也不能检测到它们的邻居,也不能传递信息来建造生物膜——这是细菌细胞的一层很难杀死的膜——或是分泌毒素。“这种方法看起来很有前景,”她说,“我们能制造出结构与真的自体诱导物类似的分子,在试管中堵塞细菌的受体,它们能阻止细菌发动它们的毒性战役。”结果,她说,“我们发现细菌不能制造生物膜了;它们不会杀死组织培养细胞了。 ”
然而,这还仍然是一个梦想,她说,因为人们在遭到一个既定感染后通常都会延医诊治,而且在细菌意识到它们有一个群体阈值并发动了它们协调一致的剧毒猛攻之后,这种做法是否有效还不确定。除此之外,“我们需要能在群体阈值测序通路的不同点起作用的各种分子,从而知道哪个位置在疗法上是最好的。”巴斯勒说。
即使这些分子研发出来,它们很可能需要改进,通过药物化学变得更有效力,只有到那时它们才能作为疗法在动物并且最终在人类身上进行试验。可能我们还需要数十年之后才能利用群体感应研发出新的抗菌药物。
梦想“落地”
像安德森、丹塔斯和其他科学家一样,以色列理工学院和哈佛医学院的系统生物学家罗伊·基洪尼(Roy Kishony)设想了基于对药物相互作用以及对耐药性与敏感细菌之间竞争的深刻理解的药物组合。基洪尼及其同事比较了自然环境和临床环境下的抗生素耐药性。他们疑问,为什么抗菌药物耐药性和细菌敏感性——也就是对抗菌药物的易感性——之间的平衡能在自然界中保持,但在临床环境中细菌耐药性就会迅速战胜细菌敏感性?基洪尼指出,自然界为了遏制生活在土壤中的微生物,早在数亿年前就形成了抗菌药物。“我们人类在这项事业中还是新手,我们还需要学习很多东西才能揭示抗菌药物耐药性在自然界是如何作用的。”他说。
在自然界,抗菌药物“不是单独存在的”,基洪尼说,“它们在有许多其他化合物而且有多种细菌的环境中存在。”“我们过去的研究把抗菌药物从环境中孤立出来了,”他解释说,“我们已经删除了制衡机制。 ”
基洪尼解释说,耐药性通常只涉及单个或几个基因,“许多这些基因已经被人类识别,在机制和分子方面显示出相当多很好的细节。”
基洪尼的研究组特别关注自然界中抵制耐药性的机制,从而为临床用途寻找候选疗法。“我们知道当单个药物总是选择耐药性的时候,一些药物组合能实际上选择对那些开始对任何一种单一药物产生耐药性的细菌起作用。”作为原理的一个证明,基洪尼引用了他实验室的一项研究成果:药物组合降低了人群中耐多西环素大肠杆菌的耐药性。
他说,土壤中可能还有更多类似的机制在起作用,包括“数量巨大的不同化合物,它们可能以新的方式相互作用,从而抑制抗菌药物耐药性进化。”从土壤中寻找这些相互作用的例子,可能会产生对耐药性进化更具弹性的新的抗微生物疗法。正如基洪尼所说,“我们能自己发明东西,但是我们很有可能仅仅通过研究泥土而发现伟大的想法和创新。”
[资料来源:Nature][责任编辑:彦 隐]

