高通量血液透析对尿毒症患者胰岛素抵抗及左室结构和功能的影响
(扬州市江都人民医院,江苏扬州225200)
行维持性血液透析(MHD)的患者易出现心血管并发症,这是导致患者死亡的首要原因。研究表明,微炎症状态和胰岛素抵抗(IR)与慢性肾衰竭患者心血管疾病死亡有关[1~3],在慢性肾衰竭患者中IR普遍存在[4]。本研究观察了高通量血液透析对维持性血液透析患者IR及心脏结构和功能的影响,现报告如下。
1 资料与方法
1.1 临床资料 选择2011年2月~2013年1月在本院接受MHD的患者80例,男46例,女34例,年龄40~67岁。其中糖尿病肾病20例,男13例,女7例,年龄40~66岁;均符合糖尿病肾病诊断标准:①确诊2型糖尿病时间,超过5 a;或有糖尿病视网膜病变;②持续白蛋白尿,尿蛋白定量>300 mg/d;③临床和实验室检查排除其他肾脏或泌尿系疾病。非糖尿病肾病患者60例,男33例,女27例,年龄42~67岁,原发病为慢性肾小球肾炎24例,高血压病肾损害10例,狼疮性肾炎4例,痛风性肾病6例,多囊肾6例,梗阻性肾病3例,间质性肾炎2例,其他5例。所有患者均接受MHD治疗1 a以上。随机将非糖尿病肾病患者分为A、B组,各30例,糖尿病肾病患者20例为C组。三组性别、年龄资料具有可比性。另外,从门诊健康体检者中选20例作为健康组,经体检排除高血压病、肾脏病、糖尿病及心脑血管疾病,男14例,女6例,年龄42~67岁。
1.2 治疗方法 A组采用Fresenius F7 HPS透析器,接受普通血液透析(HD)治疗;B、C组采用Fresenius FX60高通量透析器,接受高通量血液透析(HFHD)治疗。三组均采用前臂动静脉内瘘建立血管通路,均常规口服钙拮抗剂、ARB、铁剂及注射EPO、补钙等治疗。
1.3 观察项目
1.3.1 IR相关指标 A、B、C组治疗前及治疗6个月后,于治疗结束前10 min内采集静脉血检测空腹血糖(FPG)、空腹血浆胰岛素(FINS)、血清总胆固醇(TC)、甘油三酯(TG)、血清清蛋白(ALB)、血尿素氮(BUN)、肌酐(Cr)及炎性因子高敏C反应蛋白(hs-CRP)、甲状旁腺素(PTH),尿素清除指数(kt/v,k为透析器尿素清除率,t为透析时间,v为体质量乘以0.58)等。FPG、血BUN、Cr采用全自动生化仪检测,FINS采用放射免疫法测定,hs-CRP采用ELISA法检测。IR用稳态模型IR指数(HOMA-IR)公式进行评价,HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(mU/L)/22.5[5],该指标为非正态分布,转换为自然对数。健康组检测 TG、TC、ALB、FPG、FINS和HOMA-IR及hs-CRP。
1.3.2 心脏结构与功能 治疗前及治疗6个月后采用彩色多普勒超声测定三组左心房前后径(LAD),左心室舒张期内径(LVEDd),左心室收缩期内径(LVEDs),左心室舒张期后壁厚度(LVPWT),室间隔厚度(IVST),左心室质量指数(LVMI),左心室射血分数(LVEF),二尖瓣前向血流E峰与A峰比值(E/A),测量每分心输出量(CO)。全部数据均测量3个心动周期,取平均值。以LVMI男性>134 g/m2,女性>110 g/m2诊断为左心室肥厚,LVEF<50%诊断为左心室收缩功能减退,E/A<1诊断为左心室顺应性下降。
1.4 统计学方法 采用SPSS13.0统计软件。数据以±s表示,计量资料成组比较采用t检验,计数资料比较采用χ2检验,指标间相关性分析采用Pearson相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 各组治疗前后IR相关指标比较 B、C组治疗6个月后 PTH、hs-CRP、FINS、HOMA-IR 均下降(P均 <0.05),与治疗后 A 组相比,B、C 组 PTH、hs-CRP、FINS、HOMA-IR下降有统计学意义(P均 <0.05)。三组治疗前后kt/v均无统计学意义。见表1。
表1 各组透析前后IR相关指标比较(±s)

表1 各组透析前后IR相关指标比较(±s)
注:各组透析前IR相关指标与健康组相比,P均<0.05;与治疗前相比,a P<0.05;治疗前后差值与A组比较,b P<0.05
组别 n kt/v PTH(pmol/L) hs-CRP(mg/L) FPG(mmol/L) FINS(mU/L)HOMA-IR A组30治疗前 1.31 ±0.45 807.2 ±186.4 5.16 ±1.38 5.19 ±0.88 11.80 ±3.68 2.79 ±0.85治疗后 1.29 ±0.42 769.8 ±175.8 4.89 ±0.92 4.98 ±0.65 10.21 ±3.26 2.53 ±0.65 B组 30治疗前 1.33 ±0.49 887.6 ±256.7 5.42 ±1.22 5.53 ±0.78 13.20 ±3.25 2.85 ±0.78治疗后 1.45 ±0.53 502.6 ±300ab 2.89 ±0.98ab 5.42 ±0.55a 9.89 ±3.04ab 1.56 ±0.59ab C组 20治疗前 1.29 ±0.65 768.2 ±121 7.64 ±3.79 7.23 ±1.25 17.40 ±5.27 4.21 ±1.33治疗后 1.42 ±0.59 458.9 ±135ab 3.52 ±1.21ab 5.22 ±0.47a 11.30 ±0.41ab 2.46 ±1.80ab健康组 20 - 26.1±4.83 1.21 ±0.45 5.12±0.73 9.23 ±2.650.68 ±0.32
2.2 各组治疗前后左心结构和功能指标比较 B组和C组治疗后LVEF、E/A及CO较治疗前升高而LVMI较治疗前下降(P均<0.05),与治疗后A组相比(P均<0.05)。B组治疗前、后左心室肥厚发生率分别为73.3%、40.0%,E/A<1发生率分别为60.0%、33.3%,治疗后均低于治疗前(P均 <0.05),LVEF <50 发生率分别为 30.0%、13.3%,差异无统计学意义。治疗前后A组左心室肥厚发生率分别为70%、60%,LVEF<50发生率分别为33.3%、30.0%,E/A <1 发生率分别为 56.7%、50%;)及C组治疗前后左心室肥厚发生率分别为80.0%、60.0%,LVEF <50 发生率分别为 30.0%、20.0%,E/A <1 发生率分别为 65.0%、40.0%,差异无统计学意义。见表2。
表2 各组治疗前后心脏结构和功能指标变化(±s)
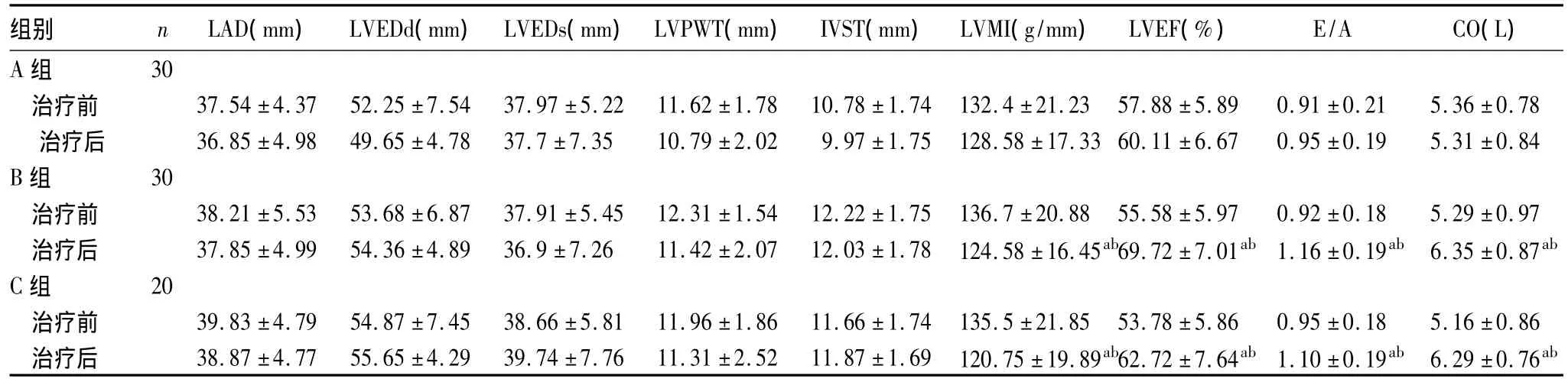
表2 各组治疗前后心脏结构和功能指标变化(±s)
注:与本组治疗前比较,a P<0.05;与A组治疗后比较,b P<0.05
组别 n LAD(mm) LVEDd(mm)LVEDs(mm)LVPWT(mm) IVST(mm) LVMI(g/mm) LVEF(%) E/A CO(L)A组30治疗前 37.54 ±4.37 52.25 ±7.54 37.97 ±5.22 11.62 ±1.78 10.78 ±1.74 132.4 ±21.23 57.88 ±5.89 0.91 ±0.21 5.36 ±0.78治疗后 36.85 ±4.98 49.65 ±4.78 37.7 ±7.35 10.79 ±2.02 9.97 ±1.75 128.58 ±17.33 60.11 ±6.67 0.95 ±0.19 5.31 ±0.84 B组 30治疗前 38.21 ±5.53 53.68 ±6.87 37.91 ±5.45 12.31 ±1.54 12.22 ±1.75 136.7 ±20.88 55.58 ±5.97 0.92 ±0.18 5.29 ±0.97治疗后 37.85 ±4.99 54.36 ±4.89 36.9 ±7.26 11.42 ±2.07 12.03 ±1.78 124.58 ±16.45ab69.72 ±7.01ab 1.16 ±0.19ab 6.35 ±0.87ab C组 20治疗前 39.83 ±4.79 54.87 ±7.45 38.66 ±5.81 11.96 ±1.86 11.66 ±1.74 135.5 ±21.85 53.78 ±5.86 0.95 ±0.18 5.16 ±0.86治疗后 38.87 ±4.77 55.65 ±4.29 39.74 ±7.76 11.31 ±2.52 11.87 ±1.69 120.75 ±19.89ab62.72 ±7.64ab 1.10 ±0.19ab 6.29 ±0.76ab
2.4 行MHD患者 HOMA-IR、hs-CRP与心脏结构功能指标的相关性 行MHD的患者血清HOMA-IR与 hs-CRP水平呈正相关(r=0.857 3,P <0.05)。hsCRP、HOMA-IR 分别与 LAD、LVEDd、LVEDs、LVPWT、IVST、LVMI呈正相关(r分别为 0.762 5、0.850 2、0.812 3、0.802 8、0.802 1、0.835 6 和0.684 7、0.757 1、0.824 2、0.837 9、0.856 2、0.931 4,P <0.05),与 LVEF、E/A、CO 呈负相关(r分别为-0.702 9、- 0.804 8、- 0.854 5 和 - 0.902 5、-0.850 3、-0.865 4,P <0.05)。
3 讨论
研究表明,慢性肾衰竭尤其终末期肾病患者存在IR和代偿性高胰岛素血症,早期慢性肾脏病患者亦存在IR[6,7],且随着肾功能减退而加重。慢性肾脏病患者肾功能下降,胰岛素代谢清除能力下降、尿毒症毒素蓄积、维生素D缺乏以及继发性甲状旁腺功能亢进、贫血等均可使IR加重。IR不仅是2型糖尿病的发病基础,亦是慢性肾脏病等多种疾病的共同病理生理基础。即使在行MHD的非糖尿病患者中,IR也同样较常见[8]。MHD患者普遍存在微炎症状态,微炎症状态可能通过某些途径导致胰岛素受体或受体后缺陷而加重IR[9]。但微炎症状态与IR之间是否直接相互影响尚不清楚。本研究结果显示,行MHD的患者HOMA-IR及hs-CRP均高于健康组升高,提示患者存在微炎症状态和IR。
常用的低通量血液透析其透析膜孔径较小,超滤系数小于10mL/(h·mmHg),其清除的物质主要是血液中的水溶性小分子毒素。而高通量透析器有较大的透析膜孔径,超滤系数大于20 mL/(h·mm-Hg),有的可达60 mL/(h·mmHg)以上,有利于提高中分子毒素的清除效率,可清除糖基化终产物,从而降低心血管发病率,改善预后。研究表明,相对于低通量透析治疗,血清白蛋白水平小于40 g/L者以及糖尿病患者可从 HFHD中获得益处[10]。常明等[11]研究发现,HFHD可改善尿毒症患者的营养状态,改善心脏舒张功能,延缓周围神经病变及血管内皮细胞功能损害,其机制可能与HFHD有效清除IL-6、β2-MG、晚期糖基化终末产物等中大分子毒素及炎症因子有关。相关报道发现HFHD可更好地清除炎症因子,改善IR[12]。本研究结果证实,糖尿病肾病及非糖尿病患者HFHD6个月后hs-CRP、PTH均明显低于常规血液透析组,有效减轻炎症状态。同时,与普通血液透析相比,HFHD患者FINS、HOMA-IR明显下降,LVEF、CO、E/A均升高(P均 <0.05),提示HFHD不但可改善炎症状态与IR,同时可改善左室收缩和舒张功能。在改善左心结构和功能方面,HFHD对非糖尿病患者的效果好于糖尿病肾病患者,可能与糖尿病对心脏的影响有关,尚需大样本研究进一步观察。另外我们发现,血清hs-CRP水平与胰岛素抵抗存在相关性,这与Sit等[2]的结果一致,提示HFHD改善胰岛素抵抗可能是通过改善患者的微炎症状态来实现的。
Shinohara等[13]对183例行血液透析治疗的非糖尿病、终末期肾病患者进行研究,发现HOMA-IR与心血管疾病病死率显著正相关,IR是终末期肾病患者心血管疾病病死率的一个独立预测因子。本研究结果显示,行MHD的患者FINS、HOMA-IR均高于健康组,表明患者存在IR,IR可促使心肌纤维化,导致心室重构[14]、左心室肥厚。推测可能机制[7,15]:①胰岛素通过胰岛素受体或胰岛素样生长因子受体-1促进心肌细胞增殖;②高胰岛素血症直接作用于肾脏导致水钠潴留和高血压;③高胰岛素血症间接通过增强交感神经系统活性诱导心肌蛋白合成;④IR抑制心肌细胞蛋白分解,促使心肌细胞内高钙,致心肌细胞增殖;⑤IR促进去甲肾上腺素生成,直接作用于心肌。
本研究结果显示,行HFHD的患者存在IR,HOMA-IR与hs-CRP呈正相关,并与左心室结构和功能指标相关,提示IR已成为影响患者心脏结构和功能的重要危险因素。了解MHD患者IR状态和心脏结构及功能的变化有助于病情判断及早期干预,而在血液透析方式上,高通量较低通量透析治疗能明显改善尿毒症患者的IR状态,并改善左心功能。
[1]Becker B,Kronenberg F,Kielstein JT,et al.Renal insulin resistance syndrome,adiponectin and cardiovascular events in patients with kidney disease:the mild and moderate kidney disease study[J].JAm Soc Nephrol,2005,16(4):1091-1098.
[2]Sit D,Kadiroglu AK,YilmazME,etal.The prevalence of insulin resistance and its relationship between anemia,secondary hyperparathyroidism,inflammation and cardiac parameters in chronic hemodialysis patients[J].Ren fail,2005,27(4):403-407.
[3]Guebre-Egziabher F,Kalbacher E,Fouque D,etal.Insulin resistance and inflammation in chronic kidney diseases[J].Nephrol T-her,2009,5(5):346-352.
[4]Kobayashi S,Maejima S,Ikeda T,et al.Impact of dialysis therapy on insulin resistance in end-stage renal disease:comparison of haemodialysis and continuous ambulatory peritoneal dialysis[J].Nephrol Dial Transplant,2000,15(1):65-70.
[5]Díez JJ,Iglesias P,Fernández-Reyes MJ,et al.Serum concentrations of leptin,adiponectin and resistin,and their relationship with cardiovascular disease in patientswith end-stage renal disease[J].Clin Endocrinol(Oxf),2005,62(2):242-249.
[6]薛兰芬,张慧儒,计承.IgA肾病胰岛素抵抗的临床研究[J].临床荟萃,2008,23(20):1488-1490.
[7]王成军,鲍晓荣.早期慢性肾脏病患者胰岛素抵抗与左心室肥厚的关系[J].中华内科杂志,2009,48(12):999-1003.
[8]Ramirez R,Carracedo J,Berdud I,et al.Microinflammation in hemodialysis is related to a preactivated subset ofmonocytes[J].Hemodial Int,2006,10(1):24-27.
[9]Cheung AK,Sarnak MJ,Yan G,etal.Cardiac diseases inmaintenance hemodialysis patients:results of the HEMO Study[J].Kid-ney Int,2004,65(6):2380-2389.
[10]Tattersall J,Canaud B,Heimburger O,etal.High-flux or low-flux dialysis:a position statement following publication of the Membrane Permeability Outcome study[J].Nephrol Dial Transplant,2010,25(4):1230-1232.
[11]常明,刘红,刘书馨,等.高通量血液透析改善尿毒症预后机制研究[J].中国实用内科杂志,2012,32(11):871-873.
[12]郭琦,许树根.高通量透析更有利于减轻肾衰竭患者的心血管因素[J].临床肾脏病杂志,2011,11(12):567.
[13]Shinohara K,Shoji T,Emoto M,etal.Insulin resistance as an independent predictor of cardiovascularmortality in patientswith endstage renal disease[J].JAm Soc Nephrol,2002,13(7):1894-1900.
[14]许伟源,郑良荣,郭航远,等.胰岛素抵抗对心室重构的影响及瑞舒伐他汀的干预作用[J].上海交通大学学报(医学版),2012,32(10):1316-1320.
[15]魏莉莉,岑俊,顾谊铮,等.维持性血液透析患者脂肪因子和胰岛素抵抗与心脏结构及功能的相关分析[J].国际移植与血液净化杂志,2009,7(6):31-35.

