松果菊苷对阿尔采末病大鼠海马、皮质内神经递质水平的影响
丁 慧,陈 虹,姜 勇,屠鹏飞,马婧怡,张万鑫
(1.石河子大学药学院,教育部新疆特种植物药资源重点实验室,新疆石河子 832002;2.北京大学中医药现代研究中心,北京 100191)
阿尔采末病 (Alzheimer’s disease,AD)是一种不可逆转的、进行性的慢性神经退行性疾病,由多种原因引发,其中与海马和皮质区的神经元异常密切相关。研究表明,AD病变物质基础与人体某些对学习和记忆等认知功能有特殊作用的神经递质,如乙酰胆碱、单胺类、氨基酸类及神经肽类等物质的改变或失衡密切相关[1-2]。记忆是由无数神经细胞间突触直接改变所产生的效应,神经递质通过第二信使引起蛋白磷酸化,启动新蛋白质合成,使其进入细胞核后,使得生物产生了短期和长期记忆。
松果菊苷 (echinacoside,ECH)是从新疆特色植物、国家重点保护野生药材肉苁蓉中分离、纯化的苯乙醇苷类化合物的主要成分[3]。本实验室前期研究证实,ECH有明显的神经保护作用。在此基础上,本研究应用脑微透析技术与高效液相色谱联用电化学检测(HPLC-ECD)法,动态检测ECH对AD大鼠海马、皮质细胞外液中单胺类神经递质水平的影响,初步探讨ECH改善AD大鼠学习记忆能力的可能作用机制。
1 材料与方法
1.1 药品与试剂 ECH由北京大学屠鹏飞教授惠赠(纯度95%以上);石杉碱甲片(河南太龙药业股份有限公司,批号:120708);去甲肾上腺素(NE)、多巴胺 (DA)、5-羟色胺 (5-HT)、庚烷磺酸钠均购自美国Sigma公司;甲醇(Fisher公司,色谱纯);柠檬酸磷酸锌水门汀(上海医疗器械股份有限公司产品,由液体和粉剂组成,用时调和);柠檬酸(上海山浦化工有限公司);柠檬酸钠 (天津市博迪化工有限公司);乙二胺四乙酸二钠 (天津市北方化玻购销中心);脑微透析灌流液为复方氯化钠注射液(北京双鹤药业股份有限公司);所用水均为Millipore超纯水。
1.2 实验动物 SD大鼠,♂,体质量290~320 g,购自新疆实验动物研究中心,许可证编号:SCXK(新):2011-0002,饲养条件为室温20℃~23℃,湿度为50%~70%,自由进水、摄食,自然光照。
1.3 主要仪器 脑微透析仪器包括:美国 BAS 4100型大鼠脑立体定位仪,CMA/12探针(分子截留量15 ku,膜长4 mm,瑞典 Microbiotech公司)及探针套管,CMA/402型微量注射泵,CMA/150低温样品自动收集器,CMA/120清醒动物自由活动装置;高效液相色谱系统(HPLC)包括:岛津 LC-20AB输液泵,岛津 CTO-10ASvp柱温箱,ANTEC DECAE-D2SDC电化学检测器,玻璃碳工作电极和Ag/AgCl参考电极,Hypersil-GOLD ODS C18色谱柱 (美国 Waters公司,250 mm×4.6 mm,5μm);其他:DMS-2型Morris水迷宫,中国医学科学院药物研究所;Varioskan Flash 4.00.51酶标仪,美国Thermo electron公司。
2 方法
2.1 模型建立[4]造模组大鼠采用腹腔注射D-半乳糖0.1 mg·g-1,每天1次,共计56 d,于 d 43用5μl微量注射器开孔处进入大鼠右侧海马背部,缓慢匀速注射 5μl凝聚态 Aβ25-35,注射速度 1μl·min-1,注射时间 5 min,并留针 5 min,联合建立动物AD模型。
2.2 分组及给药方法 将大鼠随机分为6组:模型组、ECH低剂量组 (10μg·g-1)、ECH中剂量组(20μg·g-1)、ECH高剂量组 (40μg·g-1)、阳性药石杉碱甲组 (Hup-A,0.02μg·g-1)、假手术组(生理盐水1μl·g-1)。各组大鼠每天腹腔注射相应的药物和生理盐水,每天1次,连续4周。
2.3 Morris水迷宫检测 Morris水迷宫是用于评价大鼠对空间学习和记忆的获取能力,由圆形水池、自动录像及分析系统共同组成。实验时,在水池中注入清水,水温保持在 (24±2)℃,水面高于平台约2 cm。在水池上方安置有与计算机相连接的摄像监视系统,调试摄像头,使电脑屏幕中清晰显示水迷宫分为4个象限,并同步准确记录大鼠的运动轨迹。训练期间,水迷宫外参照物保持不变,同时尽量减少声响及灯光的影响,尽可能在较暗的环境中进行。
2.3.1 定位航行实验[5]将大鼠面向池壁依次从4个象限的中点位置放入水池,当大鼠已爬上平台或设定的训练时间(120 s)已到,计算机便停止跟踪,并记录游泳轨迹。在超过训练时间 (120 s)仍未找到平台的大鼠,将引导其到达平台,休息30 s,帮助其学习记忆平台位置。
2.3.2 空间搜索实验 定位航行实验5 d后,d 6将平台移除,任选一个入水点将大鼠放入水池中,在规定的120 s内,统计大鼠穿越原平台位置的次数及停留原平台象限时间,用于测定大鼠对平台空间位置记忆的保持能力。
2.4 透析套管的植入及微透析液的收集 将各组大鼠在给药结束前3 d,用10% 水合氯醛 (3.5μl·g-1)麻醉,固定于 BAS 4100脑立体定位仪,参照Paxinos G《大鼠脑立体定位图谱》[6]将探针导管固定于脑立体定位仪,以前卤为基点,分别依次植入大鼠海马 (坐标 AP:+3.5 mm;ML:+2.0 mm;DV:-3.0 mm)和皮质(坐标 AP:+3.0 mm;ML:-1.6 mm;DV:-3.5 mm),并在套管附近另固定1枚小螺钉呈三角形分布,之后用柠檬酸磷酸锌水门汀液体和粉剂调和后固定,术后腹腔注射硫酸庆大霉素预防感染。套管植入后,待大鼠清醒后,在自由活动状态下立即将套管芯小心拔出,并将微透析探针小心地插入预留在海马、皮质的套管中,用复方氯化钠注射液以2μl·min-1的速度灌流,另一端接入微透析灌流系统,4℃下每20 min收集1管脑微透析液。脑微透析结束后,将收集到的透析液冻存于-70℃冰箱,择日测定。
2.5 统计学分析 结果数据均以¯x±s表示,采用SPSS 17.0统计分析软件。统计方法为比较模型组与假手术组采用独立样本t检验分析,多组数值间比较采用单因素方差分析。
3 结果
3.1 ECH对AD大鼠学习记忆能力的影响 (水迷宫检测) Morris水迷宫结果显示,d 1、2,各组大鼠学习记忆水平比较,差异没有统计学意义 (P>0.05),从d 3开始,模型组大鼠的逃避潜伏期明显长于正常对照组 (P<0.05);与模型组大鼠相比,ECH低、中、高剂量组、石杉碱甲组的逃避潜伏期差异具有显著性(P<0.01,P<0.05);ECH低、中、高剂量组与石杉碱甲组的大鼠之间的逃避潜伏期无明显差异(P>0.05)。在空间探索试验中,模型组大鼠在原平台象限内搜索时间和穿越平台次数明显少于正常组;ECH低、中、高剂量组与阳性药对照组大鼠在原平台象限内搜索时间和穿越平台次数明显多于模型组(P<0.05),而少于正常对照组(P<0.05),见 Fig 1。
3.2 HPLC-ECD分析[7]流动相每升含 0.15 mol·L-1柠檬酸 -柠檬酸钠缓冲液 829 ml、0.1 mol·L-1EDTA·2Na 1 ml、1.416 g庚烷磺酸钠、甲醇150 ml,混合过膜。流动相流速为1 ml·min-1。柱温箱温度28℃。电化学检测器工作电压为700 mV,增益2 nA。分别取空白溶液、标准品溶液、脑微透析液进样,进样量为20μl,色谱图结果见Fig 2。
3.3 标准曲线的制备 量取适量各标准储备液,加高氯酸制备成标准混合溶液,标准曲线用0.5、1、2、4、16 mg·L-1的混合标准溶液,以峰面积 (Y)对浓度(X)进行线性回归分析,回归方程为:NE:^Y=35748X+54425(r2=0.9997);DA:^Y=109204X+39243(r2=0.9997);5-HT:^Y=262300X-145774(r2=0.9997)。3种标准品在0.5~16 mg·L-1的范围内,线性关系良好。
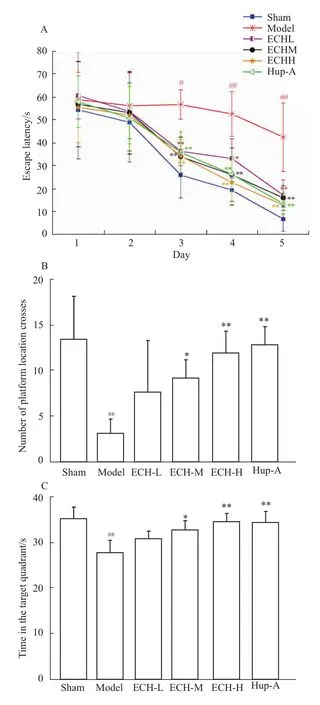
Fig 1 Performance of the rats in the Morris water maze±s,n=10)Effect of ECH on the performance of the Morris water maze test.A:The escape latency time in 5 days in the hidden platform test;B:The number of platform crosses in the probe trail;C:The Morris water maze assay with the platform removed to evaluate the time of animals spent in the target quadrant.#P<0.05,##P<0.01 vs sham group;*P<0.05,**P<0.01 vs model group
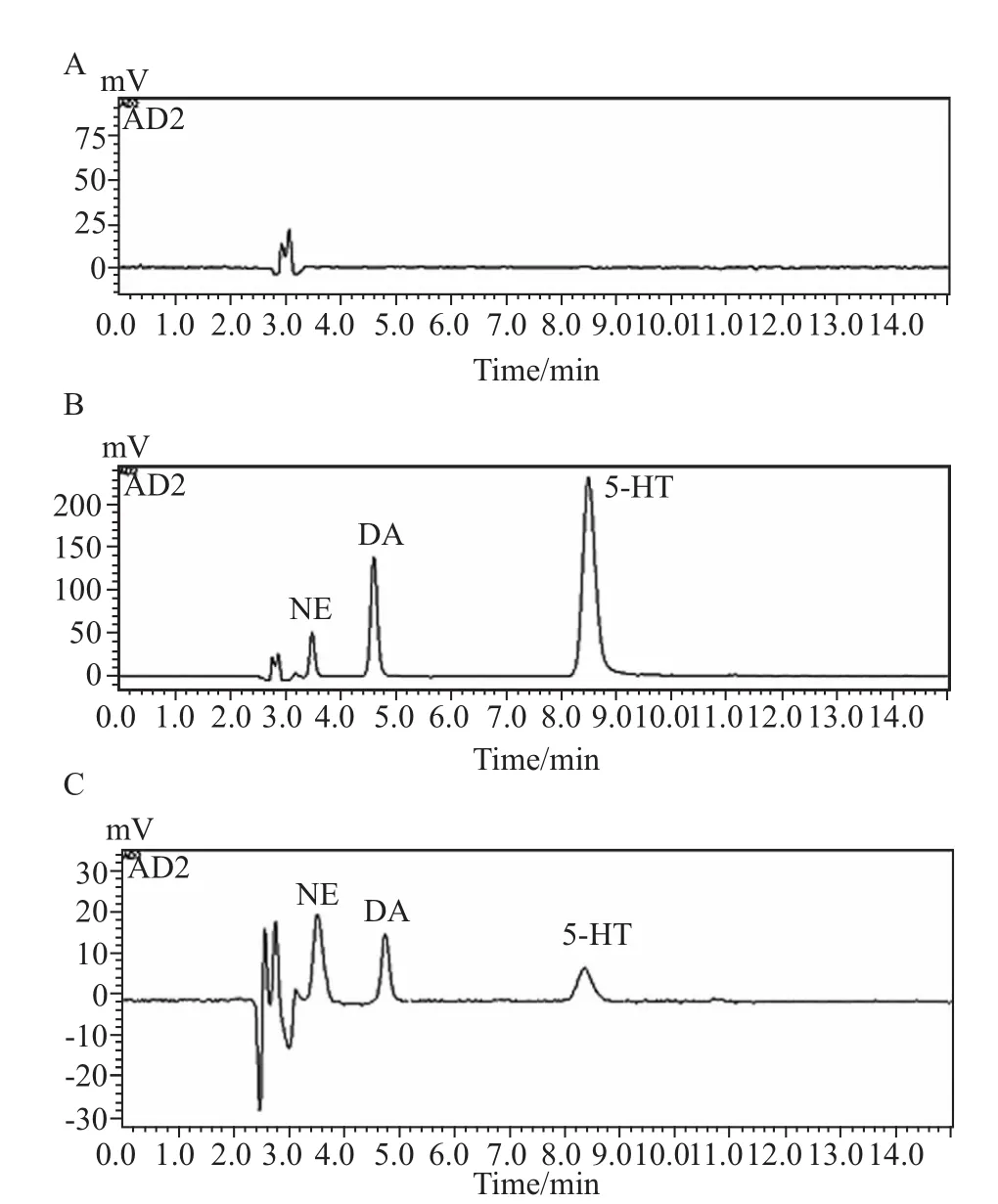
Fig 2 Monoamine neurotransmitter of brain microdialysis HPLC-ECD chromatographyA:Blank solvent HPLC chromatogram;B:Standard HPLC-ECD chromatography;C:Monoamine neurotransmitter of brain microdialysis HPLC-ECD chromatography
3.4 ECH对AD模型大鼠海马、皮质中单胺类神经递质的影响 实验结果表明,与假手术组相比,模型组大鼠皮质、海马中的单胺类神经递质水平均明显下降 (P<0.01),模型组大鼠皮质 (cerebral cortex,CC)中NE、DA、5-HT含量分别下降74.5%、46%、61.4%;海马 (hippocampus,HC)中这3种单胺类物质分别下降90.20%、76.9%、56%。给予ECH后,ECH各组CC、HC中NE、DA、5-HT的含量相比模型组,发生不同幅度的上升,ECH高剂量组(40 mg·kg-1)升高最为明显 (P<0.05或 P<0.01)。实验结果表明,ECH具有提高AD模型大鼠皮质、海马内单胺类神经递质水平的作用,见Tab 1。
4 讨论
本研究采用脑内微透析技术同时检测大鼠海马和大脑皮质内单胺类神经递质的含量,结果发现,AD模型组大鼠海马和皮质内DA、NE、5-HT含量均明显低于假手术组,提示采用D-半乳糖合并海马内注射Aβ25-35可致脑内单胺类神经递质水平降低。通过Morris水迷宫验证学习记忆能力,高效液相色谱-电化学检测法测定不同大脑组织细胞外液中单胺类神经递质的含量,从这两个方面对大鼠学习记忆力进行了实验性评价。结果表明,该模型方法具有科学性、合理性,同时符合临床AD的病理学特点,为研发药物抗AD提供了较理想的动物模型。
Tab 1 Change of levels of NE,DA,5-HT in different brain regions of different groups(x¯±s,n=10)
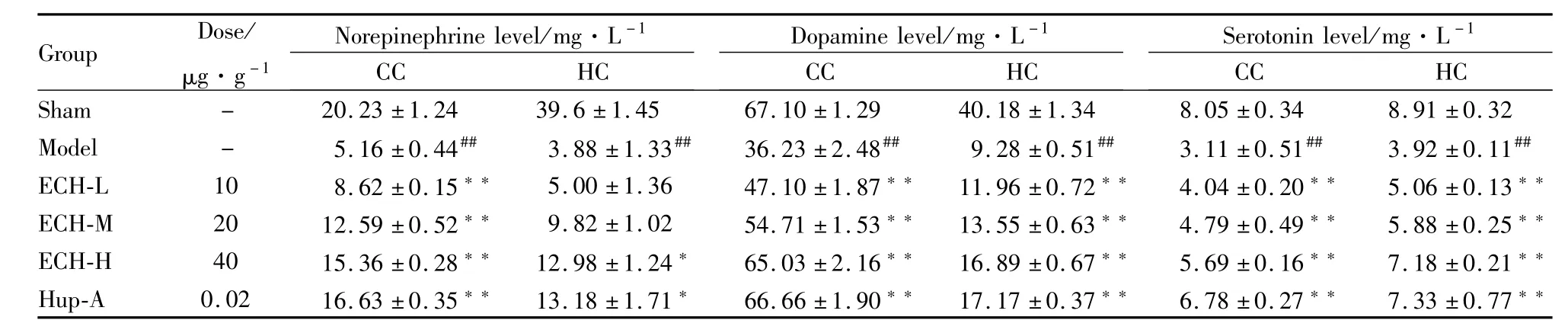
Tab 1 Change of levels of NE,DA,5-HT in different brain regions of different groups(x¯±s,n=10)
##P<0.01 vs sham group;*P<0.05,**P<0.01 vs model group
Group Dose/μg·g-1 Norepinephrine level/mg·L-1Dopamine level/mg·L-1Serotonin level/mg·L-1 CC HC Sham - 20.23±1.24 39.6±1.45 67.10±1.29 40.18 CC HC CC HC±1.34 8.05±0.34 8.91±0.32 Model - 5.16±0.44## 3.88±1.33## 36.23±2.48## 9.28±0.51## 3.11±0.51## 3.92±0.11##ECH-L 10 8.62±0.15** 5.00±1.36 47.10±1.87**11.96±0.72** 4.04±0.20** 5.06±0.13**ECH-M 20 12.59±0.52** 9.82±1.02 54.71±1.53**13.55±0.63** 4.79±0.49** 5.88±0.25**ECH-H 40 15.36±0.28**12.98±1.24* 65.03±2.16**16.89±0.67** 5.69±0.16** 7.18±0.21**Hup-A 0.02 16.63±0.35**13.18±1.71* 66.66±1.90**17.17±0.37** 6.78±0.27** 7.33±0.77**
AD是一种不可逆的、渐进性的脑功能紊乱性疾病,除了斑块形成和神经元纤维缠结,另一个标志是损害神经元合成NE[8],从而逐渐导致记忆丧失、行为异常、人格改变及思维能力下降,AD所致的记忆力严重下降主要是由于神经元传递受损。Ganguly等[9]研究表明,在一些更高级的脑组织,如海马体,NE通过激活β肾上腺素受体,在注意力和记忆的认知过程中发挥增强作用。NE从脑内蓝斑核中释放,且负责调节各种功能,抑郁、痴呆、警觉性和注意力下降都与NE不足有关。AD模型组大鼠皮质、海马细胞外液中的NE活性下降,活性的改变与AD的严重程度有关,连续4周给予ECH干预后,AD模型大鼠海马、皮质中NE水平明显升高,其可能是通过刺激不同大脑区域的肾上腺素能受体发挥作用。另外,ECH可以升高下降的单胺类神经递质水平,从而抑制脑内单胺类神经递质含量减少导致的神经元缺失,进而减少对记忆力的损害,但其作用机制仍需要进一步的研究。我们的研究结果与Hammerschmidt等[10]文献报道一致,在NA缺乏过程中通过改变Ca2+/钙调素依赖的蛋白激酶或钙调蛋白激酶Ⅱ以及NMDA受体水平从而导致认知障。
DA经研究发现是影响记忆能力,调节精神活动、情绪、思维和推理过程的关键性神经递质[11],其中,大脑前额叶皮层 (PFC)神经环路,尤其是谷氨酸能神经元与多巴胺能神经元之间的平衡,决定工作记忆的功能,因此,DA参与多重环节调节学习与记忆功能。本实验中,模型组大鼠海马、皮质的细胞外液中的DA含量与假手术组相比明显下降,DA的减少可能是由于NE能的利用率降低,NE神经元和DA神经元同时作用于海马、前额叶皮层等脑区,这些脑结构参与大鼠学习记忆功能。同时,DA可产生羟氧自由基,进而诱发神经元损伤,而神经退性行疾病,其中包括AD,其主要发病机制之一是氧化应激反应。我们的研究结果支持了先前Zhong等[12]报道ECH的化学结构有利于降低·OH水平,减轻脑损伤程度,从而产生脑神经的保护作用。
越来越多的证据已经表明,5-HT参与许多生理或病理过程,包括认知功能[13]。中缝核既是5-HT能神经元密集区,也是AD中神经纤维缠结与神经元丢失最早区域之一,因此,认为可能与AD之间存在某种联系,但在这个问题上的研究结果一直存在不一致[14]。5-HT水平的下降影响着脑5-HT受体功能紊乱,与此同时,单胺氧化酶 (MAO)是脑内单胺类的一种重要的代谢酶,衰老及AD脑组织中MAO-B活性升高,可加速氧化分解NE、DA、5-HT等单胺类神经递质,由此可以解释AD模型大鼠海马区萎缩与记忆障碍现象出现的相关性。文献已证实[12-15],ECH具有明显的神经保护作用和延缓衰老作用,并且能够抑制脑内MAO的活性,从而改善记忆功能。
参考文献:
[1] 叶 伟,唐孝威.老年性痴呆症发病机制及其防治措施的研究进展[J].国外医学·遗传学分册,2005,28(6):379-81.
[1] Ye W,Tang X W.The research progress of the pathogenesis of Alzheimer's disease and its prevention measures[J].Foreign Med Sci(Sect Genet),2005,28(6):379-81.
[2] Gu Z,Zhong P,Yan Z.Activation of muscarinic recetors inhibits beta-amyloidpeptide-induced signaling in cortical slices[J].J Biol Chem,2003,278(19):17546-56.
[3] 何文君,方泰惠,屠鹏飞.松果菊苷的药理研究进展[J].中国中药杂志,2009,34(4):476-9.
[3] He WJ,Fang T H,Tu PF.Research progress on pharmacological activities of echinacoside[J].China J Chin Mat Med,2009,34(4):476-9.
[4] 刘小莉,陈 虹,王明远,等.应用β-淀粉蛋白和 D-半乳糖建立阿尔茨海默病动物模型的研究 [J].时珍国医国药,2008,19(5):1038-9.
[4] Liu X L,Chen H,Wang M Y,et al.Establishment of a rat model with Alzheimer′s disease induced by beta-amyloid protein and D-galactose[J].Li Shi Zhen Med Mat Med Res,2008,19(5):1038-9.
[5] Liu Z B,Niu W M,Yang X H,et al.Effects of combined acupuncture and eugenol on learning-memory ability and antioxidation system of hippocampus in Alzheimer disease rats via olfactory system stimulation[J].J Tradit Chin Med,2013,33(3):399-402.
[6] Paxinos G,Watson C.The rat brain in stereotaxic coordinates[M].Beijing:People′s Medical Publishing House,2005:29-32.
[7] Wei L L,Chen H,Jiang Y,et al.Effects of echinacoside on histio-central levels of active mass in middle cerebral artery occlusion rats[J].Biomed Environ Sci,2012,25(2):238-44.
[8] Kalinin S,Willard SL,Shively C A,et al.Development of amyloid burden in African Green monkeys[J].Neurobiol Aging,2013,34(10):2361-9.
[9] Ganguly R,Guha D.Alteration of brain monoamines&EEGwave pattern in rat model of Alzheimer′s disease&protection by Moringaoleifera[J].Indian J Med Res,2008,128(6):744-51.
[10]Hammerschmidt T,kummer M P,Terwel D.Selective loss of noradrenaline exacerbates early cognitive dysfunction and synaptic deficits in APP/PS1 mice[J].Biol Psychiatry,2013,73(5):454-63.
[11]Cai J X,Ma Y Y,Xu L,et al.Reserpine impairsspatial working memory performance in monkeys:reversal by the alpha-2 adrenergic agonist clonidine[J].Brain Res,1993,614(12):191-6.
[12]钟 明,刘春丽,陈 虹,等.松果菊苷对脑缺血大鼠纹状体细胞外液中氨基酸水平的影响[J].中国药理学通报,2012,28(3):361-5.
[12]Zhong M,Liu CL,Chen H,et al.Effects of echinacoside on striatal extracellular levels of hydroxyl radical in cerebral ischemia rats[J].Chin Pharmacol Bull,2012,28(3):361-5.
[13]Seyedabadi M,Fakhfouri G,RamezaniV,et al.The role of serotonin in memory:interactions with neurotransmitters and downstream signaling[J].Exp Brain Res,2014,232(3):723-38.
[14]Ha T M,Cho D M,Park SW,et al.Evaluating associations between 5-HTTLPR polymorphism and Alzheimer′s disease for Korean patients[J].Dement Geriatr Cogn Disord,2005,20(1):31-4.
[15]Chen H,Jing F C,Li CL,et al.Echinacoside prevents the striatal extracellular level of monoamine neurotransmitters from diminution in 6-hydroxydopamine lesion rats[J].J Ethnopharmacol,2007,114(3):285-9.

