多b值DWI评价抗肿瘤血管药物早期反应的应用价值
丁 爽 贾文霄 许永华 杨利霞 黄自丽 潘晓东
抗血管生成药物是目前肿瘤药物治疗的重要策略。该药物的研发迫切需要建立有效、便捷的生物标志物早期监测肿瘤的血流动力学变化、细胞代谢等,以评价药物的早期疗效,指导临床个体化用药[1]。常规影像学检查方法仍是目前临床最常用的肿瘤分期及疗效评价的主要手段[2]。但这种临床疗效评价标准对于抗肿瘤血管药物疗效的评价存在明显不足。随着现代影像技术的发展,多参数影像学生物标志物已成为潜在的“替代终点” 来替代常规的临床观察终点[3]。其中磁共振弥散加权成像(diffusion weighted imaging,DWI)是目前唯一无创测定体内水分子扩散运动的方法,在肿瘤分级及各种治疗手段(如放疗、化疗)的疗效评估都具有较重要的作用[4-5]。目前,DWI技术及后处理软件的日趋完善,多b值DWI技术正在成为学者们研究的热点。该技术有望除能够反映细胞代谢外,还能反映抗肿瘤血管药物治疗后血管关闭情况[1,6]。本研究以结肠癌裸鼠皮下移植瘤模型为研究对象,动态观察抗癌药物治疗前后DWI各参数的早期变化,并与免疫组化行相关性分析,以明确多b值DWI各定量参数在评价抗血管生成药物早期反应方面的应用价值。
方 法
1.实验对象及实验设计
BALB/c-nu雌性裸鼠,鼠龄4~6周,体重14~18g,人型结肠癌Ht-29细胞株,由中科院上海生命科学研究院提供。本研究经过医院伦理委员会审核通过。参考文献[7]建立结肠癌裸鼠皮下移植瘤模型。成瘤后由同一测量者用游标卡尺测量肿瘤的最大直径(a)和最小直径(b),按公式V= ab2π/6计算肿瘤体积,建模成功的标准为移植瘤体积达200 mm3。
建模成功的30只结肠癌裸鼠皮下移植瘤模型随机分为三组:抗肿瘤血管药物治疗组(n=10):腹腔注射贝伐珠单抗注射液(商品名安维汀注射液),注射剂量10mg/kg(每只载瘤裸鼠注射约200 µg);细胞毒性药物治疗组(n=10):腹腔注射5-氟尿嘧啶注射液,注射剂量150mg/kg;对照组(n=10):按20mg/kg腹腔注射9%生理盐水。所有载瘤裸鼠均在治疗前行基础MRI检查,随后每组于基础检查后的第二天分别在相应药物治疗后1h、24h、48h行MRI,48hMRI检查结束后处死载瘤裸鼠行病理免疫组化染色。
2. MRI检查方法及图像分析
采用西门子1.5T Tim Avanto磁共振扫描仪,25mm实验动物专用4通道显微线圈。轴位扫描,T1WI序列:TR/TE=280 ms/18 ms;T2WI序列:TR/TE=3000 ms/82 ms;层厚2.0 mm,层间距0.0 mm,FOV 60~70 mm。多b值DWI扫描:采用10个扩散敏感梯度因子b值,分别为0 s/mm2、50 s/mm2、100 s/mm2、150 s/mm2、200 s/mm2、250 s/mm2、300 s/mm2、500 s/mm2、750s/mm2、1000 s/mm2。
将T2WI输入Biomap软件,人工划取每个扫描层面包含全部肿瘤组织的感兴趣(ROI),根据肿瘤体积=每层肿瘤面积之和×(层厚+层间距)计算获得肿瘤体积[3]。
将10个b值的DWI图像输入biomap软件内,计算获得不同b值的表观扩散系数值(apparent diffusion coefficient,ADC)及拟合出ADC图。根据参考文献报道[7-8]利用10个b值拟合出ADC10b图,再分别提取3个低b值(0 s/mm2、50 s/mm2、100 s/mm2)拟合出ADClow图,提取3个高b值(500 s/mm2、750s/mm2、1000 s/mm2)拟合出ADChigh图,根据0 s/mm2、500 s/mm2、1000 s/mm2拟合出ADC3b图。肿瘤组织ROI包括整个肿瘤组织,忽略肿瘤组织内的坏死区。各ADC图的ROI大小及位置一致。将ADClow与ADChigh值之间的差异定义为ADCperf值。
3. 组织病理学检查
裸鼠皮下肿瘤组织以10%中性甲醛溶液固定,常规石蜡包埋、切片进行常规HE染色及微血管密度测定(M VD)、血管内皮生长因子强度表达(VEGF)及增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)检测。
4. 统计学分析
采用SPSS 11.0统计软件进行统计分析,不同治疗组间、同一组治疗不同时期的多b值DWI检查获得的各项观察指标行重复测量的方差分析。各观察指标与病理结果之间进行相关性分析。检验水准取a =0.05。
结 果
1. 药物治疗前后移植瘤体积变化结果
移植瘤体积在三组间具有统计学差异(F=8.543,P﹤0.01),且不同观察时相的变化趋势是不同的(F=32.952,P﹤0.01)。药物治疗后24h及48h,肿瘤体积增长速度减低(图1),分别与对照组存在统计学差异(P﹤0.05),两药物组间无统计学差异(P=0.870;P=0.511)。
2.DWI图像及各ADC图的图像特点
各组治疗前后的各类ADC图上移植瘤均呈稍低信号,其中ADChigh图的图像信噪比较差,病灶显示不清楚,而ADC10b图信噪比较高,肿瘤边界显示较清楚。药物治疗前及治疗后1h的ADC图上移植瘤信号较均匀,两组药物治疗后24h及48h的ADC图上信号强度显示不均匀,可见斑片状及斑点状高信号的液化坏死区( 图2)。
3.多b值DWI各参数的测定结果
三组移植瘤药物治疗前后多b值DWI中各定量参数的变化趋势见图3。ADC3b、ADC10b、ADChigh值在三组间具有统计学差异(F=11.877,F=9.870,F=8.511,P﹤0.01),ADClow及ADCperf值在三组间无统计学差异(F=1.345,P=0.277;F=1.702,P=0.201)。每个观察时间段三组间的比较显示治疗前无统计学差异;在治疗后1h时,两药物组ADC3b、ADC10b、ADClow及ADCperf值低于对照组;在治疗后24h及48h时,ADC3b及ADC10b值高于对照组,而抗肿瘤血管药物组的ADCperf及ADClow值在治疗后24h时低于其余两组。各观察指标不同观察时相的变化趋势是不同的(F=66.036,F=65.698,F=19.9,F=83.587,F=38.780,P﹤0.01)。两药物组ADC3b、ADC10b、ADChigh值在治疗后1h明显减低,治疗后24h明显升高;ADClow及ADCperf值在细胞毒性药物治疗后24h开始恢复,而在抗肿瘤血管药物治疗后24h时持续下降。
4. 病理免疫组化结果与多b值DWI各参数间的相关性分析
多b值DWI各观察指标与免疫组化间的相关性分析结果见表1。ADC3b及ADC10b分别与M VD计数、VEGF强度表达及PCNA计分呈负相关性,ADCperf值与上述免疫组化结果呈正相关性,具有统计学意义;而ADClow值与M VD计数及VEGF计分呈正相关性,ADChigh值与PCNA计分具有负相关性。

图1 三组移植瘤体积变化结果,显示药物治疗后24h及48h,移植瘤体积增长速度减慢,低于对照组。
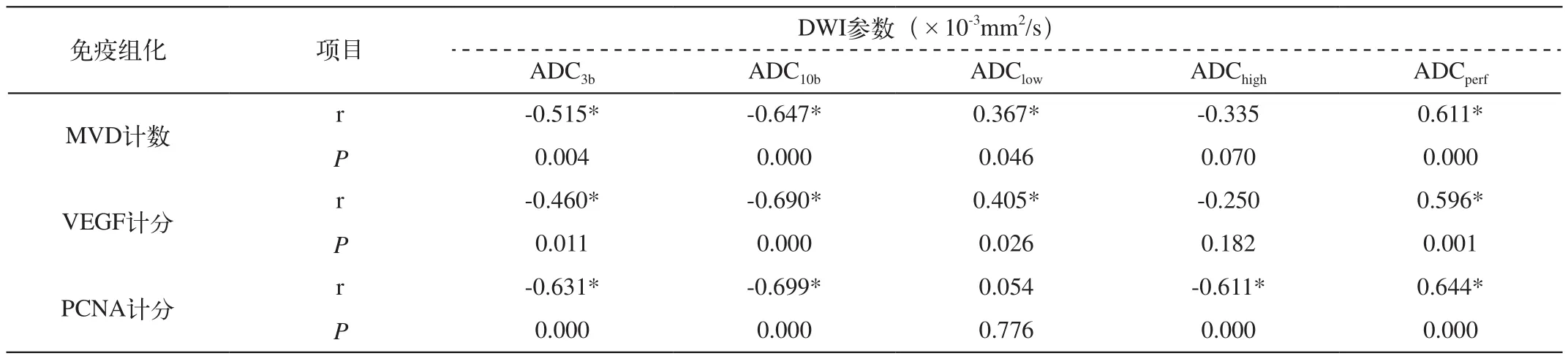
表1 免疫组化结果与多b值DWI各定量参数的相关性分析结果
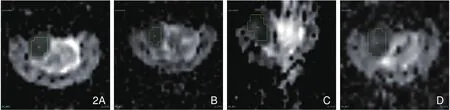
图2 抗肿瘤血管药物治疗前后ADC10b图上移植瘤信号强度的变化。A.为治疗前、B.为治疗后1h、C.为治疗后24h、 D.为治疗后48h;药物治疗前以及治疗后1h移植瘤信号较均匀,治疗后24h及48h移植瘤内部可见斑片状稍高信号的液化坏死区。
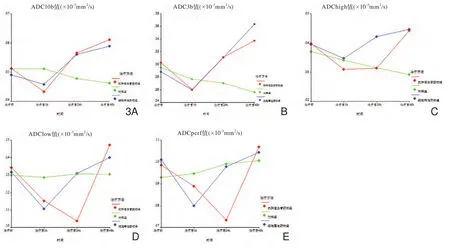
图3 三组移植瘤药物治疗前后多b值DWI中各定量参数的变化趋势。药物治疗前各ADC值组间无统计学差异;在治疗后1h时,两药物组ADC3b、ADC10b、ADClow及ADCperf值低于对照组;在治疗后24h及48h时,ADC3b及ADC10b值高于对照组,而抗肿瘤血管药物组的ADCperf及ADClow值在治疗后24h时低于其余两组。
讨 论
1.DWI可定量反映抗肿瘤血管药物治疗后的早期变化
磁共振弥散加权成像(diffusion weighted imaging,DWI)通过提供DWI图像、ADC图及ADC值多种分析手段从细胞分子水平早期反映恶性肿瘤放化疗后肿瘤内部的变化,在无创性评价肿瘤早期疗效方面具有无可比拟的优势。学者们已研究证实乳腺癌等恶性肿瘤化疗4d后ADC值的升高即表示恶性肿瘤治疗有效[9-10]。随着抗肿瘤血管药物的研发,国内外学者认为DWI技术可以作为生物标记物早期有效地反映抗肿瘤血管药物治疗后所诱导的细胞凋亡,从而间接反映肿瘤血管关闭情况。本研究结果显示常规化疗药物及抗肿瘤血管药物治疗后1hDW I各定量参数即刻发生了变化,而在治疗后2d才表现为肿瘤体积增长率减缓,表明DWI均可实时无创性的定量记录抗肿瘤血管药物及常规化疗药物治疗后肿瘤的早期变化。
2. 多b值DWI技术中ADC10b、ADC3b、ADChigh值的作用
影响ADC值大小的因素有肿瘤细胞密度、组织间隙、组织灌注状态、细胞膜通透性等,其中高b值的ADC值主要由肿瘤细胞的密度决定,而低b值的ADC值主要受组织血流灌注状态决定[1],因此本研究根据不同侧重点拟合出ADChigh、ADClow及ADCperf值等定量参数。研究结果显示两药物组治疗后1h各ADC值均明显下降,分析原因认为细胞毒性药物具有杀伤循环内皮祖细胞产生抗肿瘤血管形成的作用,注药后因缺血缺氧而导致细胞毒性水肿[11]。药物治疗后24h,两药物组的ADC3b、ADC10b、ADChigh值均升高,认为药物使肿瘤细胞坏死、密度下降,组织间隙水分子自由运动增加所致。由此可见上述三个参数的减低及恢复主要跟细胞毒性水肿的出现以及细胞密度的减低、组织间隙的增加有关。且上述定量参数与PCNA计分具有负相关性,认为这三个定量参数可以反映肿瘤的细胞代谢情况,其中 ADChigh值能更好反映药物治疗后细胞膜渗透性的改变、细胞的肿胀及细胞的早期裂解,这与Yiftach研究结果一致[12]。同时,ADC10b值及ADC3b值仍与MVD及VEGF染色呈负性相关,表明其值的升高在一定程度上可以间接反映药物治疗后肿瘤血管的关闭情况。
3. 多b值DWI技术中ADClow、ADCperf值的作用
ADClow及ADCperf值在不同作用机制药物治疗后24h时的变化趋势不一致,表明ADClow及ADCperf值主要反映了肿瘤微循环灌注状态。这两个参数的变化可以区分不同作用机制药物的早期反应,有望为药物作用机制的分析提供研究平台。但ADClow值受以下几个不同权重因素的影响,如扩 散、微循环和组织结构,个人或群体间测量的比较可重复性较差[13]。而ADCperf值比较符合血流灌注情况,且该值与免疫组化染色均呈正相关,认为ADCperf值的增高和减低可以大致反映肿瘤微循环血流灌注的增加和下降,并且间接反映了肿瘤细胞的增殖活性,因此当无法建立静脉通道做DCE-MRI检查时,ADCperf值可以用来近似替代反映肿瘤的血液灌流情况。
由此可见,多b值DWI各参数可作为影像学生物标记物反映活体组织中水分子的扩散运动能力及肿瘤血流灌注情况以评价抗肿瘤治疗的早期变化,且可成为评估抗肿瘤血管药物治疗后血管关闭及细胞代谢情况的辅助参考指标。总之,多b值DWI技术因具有无创、简便等优势,可成为靶向治疗疗效评价中较有价值的 MRI 功能成像技术之一。
[1] Padhani AR, Liu G, Koh DM, et al. Diffusion-weighted magnetic resonance imaging as a cancer biomarker: consensus and recommendations. Neoplasia, 2009,11: 102-125.
[2] 张贺龙. 实体瘤疗效评价标准及演变.现代肿瘤医学, 2010, 18: 839-841.
[3] Wang HJ, Li JJ, Chen F, et al. Morphological, functional and metabolic imaging biomarkers: assessment of vascular-disrupting effect on rodent liver tumours. Eur Radiol, 2010, 20: 2013-2026.
[4] 曹 崑, 张晓鹏, 汪 宁, 等. MR扩散成像评价宫颈癌放(化)疗早期疗效. 中国医学影像技术, 2009, 25: 1657-1660.
[5] Wybranski C, Zeile M, Löwenthal D, et al. Value of diffusion weighted MR imaging as an early surrogate parameter for evaluation of tumor response to high-dose-rate brachy therapy of colorectal liver metastases. Radiation Oncology, 2011, 6:43-51.
[6] Kharuzhyk SA, Petrovskaya NA, Vosmitel MA. Diffusion-weighted magnetic resonance imaging in non-invasive monitoring of antiangiogenic therapy in experimental tumor model. Exp Oncol,2010, 32: 104-106.
[7] 丁 爽, 贾文霄, 许永华, 等. DCE-MRI联合DWI评价肿瘤血管生成的实验研究. 中国医学计算机成像杂志, 2012, 18: 542-547.
[8] Sun X, Wang H, Chen F, et al. Diffusion-weighted MRI of hepatic tumor in rats: comparison between in vivo and postmortem imaging acquisitions. J Magn Reson Imaging. 2009,29:621-628.
[9] Barrett T, Gill AB, Kataoka MY, et al. DCE and DW MRI in monitoring response to androgen deprivation therapy in patients with prostate cancer: A feasibility study. Magn Reson Med, 2012,67: 778-785.
[10] Yoshikawa M I, Ohsumi S, Sugata S, et al. Relation between cancer cellularity and apparent diffusion coefficient values using diffusionweighted magnetic resonance imaging in breast cancer. Radiat Med, 2008, 26: 222-226.
[11] 牟 坤, 沈方臻, 肖文静, 等. 低剂量顺铂节律化疗抗血管生成作用的实验研究. 青岛大学医学院学报, 2009, 45: 115-118.
[12] Yiftach R, Thomas T, Genady K, et al. High-b-Value diffusionweighted MR imaging for pretreatment prediction and early monitoring of tumor response to therapy in mice. Radiology, 2004,232: 685-692.
[13] Hao JG, Wang JP, Gu YL. Importance of b value in diffusion weighted imaging for the diagnosis of pancreatic cancer. World J Gastroenterol, 2013, 19: 6651-6655.

