趋化因子CXCL14在结直肠癌组织中的表达及其临床相关性研究*
林刻智,林峰,郑双,沈洁△,沈贤,薛向阳
(1温州医科大学基础医学实验中心,浙江温州 325035;2台州市第一人民医院普外科,浙江台州 318020;3温州医科大学附属第一医院胃肠外科,浙江温州 325000;4温州医科大学微生物与免疫学教研室,分子病毒与免疫研究所,浙江温州 325035)
趋化因子CXCL14在结直肠癌组织中的表达及其临床相关性研究*
林刻智1,林峰2,郑双2,沈洁2△,沈贤3,薛向阳4△
(1温州医科大学基础医学实验中心,浙江温州 325035;2台州市第一人民医院普外科,浙江台州 318020;3温州医科大学附属第一医院胃肠外科,浙江温州 325000;4温州医科大学微生物与免疫学教研室,分子病毒与免疫研究所,浙江温州 325035)
目的:分析趋化因子CXCL14在结直肠癌组织中的表达,并探讨其表达的临床意义。方法:采用实时荧光定量PCR和免疫组化对40例结直肠癌及癌旁正常组织CXCL14的表达进行检测。Kaplan-Meier生存曲线和Cox回归模型评估CXCL14在结直肠癌组织中表达的临床意义。结果:CXCL14 mRNA和蛋白水平在结直肠癌组织中的表达较正常组织明显降低(P<0.05)。临床相关性分析表明,CXCL14表达的下调与肿瘤淋巴结转移、发生部位以及临床病理分期有关(P<0.05)。Kaplan-Meier生存分析显示,不同CXCL14蛋白表达水平的患者,生存时间具有显著差异(P<0.01)。结论:CXCL14可能参与结直肠癌的发生、发展过程。
趋化因子CXCL14;生存分析;结直肠肿瘤
结直肠癌是胃肠道最常见的恶性肿瘤之一,每年全球约有40万病例死于该病[1]。迄今,结直肠癌发生和发展的机制仍不清楚。肿瘤微环境已逐渐被认为是癌症发生和发展的一个重要的参与者[2-4],其中的趋化因子在肿瘤增殖、转移等方面起着重要作用[3-4]。趋化因子CXCL14是CXC趋化因子家族的一员。研究发现,CXCL14在不同类型肿瘤表达不一致,在肾癌、肺癌、头颈部鳞状细胞癌、宫颈癌等组织中几乎没有表达或者表达很低[5-8],而在部分前列腺癌和胰腺癌中[9-10]却高水平表达。我们前期胃癌标本检测结果也发现CXCL14表达在肿瘤组织明显降低[11]。迄今,CXCL14在结直肠癌中的表达及临床意义目前仍不清楚。因此,本研究分析CXCL14在结直肠癌组织中蛋白和mRNA的表达及临床意义。
材料和方法
1 材料
2 方法
2.1 组织标本采集及处理本研究的结直肠癌40例患者来自2008年12月至2009年4月台州市第一人民医院内镜活检确诊并经外科治疗的病人。结直肠癌的组织病理学诊断由医院病理科根据世界卫生组织的标准,术后证实。所有这些患者术前未接受放疗或化疗,术后根据美国国立癌症综合网(National Comprehensive Cancer Network,NCCN)结直肠癌指南接受严格的化疗。以上结直肠癌组织及相应正常组织(取自距肿瘤边缘2 cm处)的成对标本(经病理确诊)均被分为2部分:一部分样本在手术切除后30 min,采用液氮冷冻保存,以备RNA的提取;其余组织由4%甲醛固定,石蜡包埋、切片,进行免疫组化检测。
2.2 RNA的分离纯化总RNA的提取参照Trizol试剂说明书进行。为去除可能污染的DNA,抽提的RNA经DNaseⅠ处理后,酚-氯仿抽提,纯化的RNA 以DEPC水溶解,用紫外分光光度计检测RNA浓度后,-80℃储存备用。
2.3 CXCL14 mRNA检测参照ReverTra Ace逆转录试剂盒说明书,取1 μL提取的RNA以Oligo dT进行逆转录。反应条件为:42℃60 min,75℃15 min,反应结束后-20℃保存。以15 μL反应体系进行real-time PCR。相关分析的引物序列见表1。反应体系包括:1 μL逆转录产物,1×SYBR Green I Master Mix,0.5 μmol/L特异前向引物,0.5 μmol/L特异反向引物。反应条件为:95℃2 min后,95℃15 s,60℃ 1 min,40个循环。使用Bio-Rad CFX96仪器进行。所有样品做3复孔。根据待测标本的Ct值,以GAPDH为内参照,采用相对定量法,以2-ΔΔCt表示标本中CXCL14相对表达量,其中ΔΔCt=(CtCXCL14-CtGAPDH)肿瘤-(CtCXCL14-CtGAPDH)正常。

表1 引物序列Table 1.Primer sequences
2.4 免疫组化检测甲醛固定和石蜡包埋结直肠癌组织块样本切片,厚4 μm,玻片经0.1%多聚赖氨酸处理;二甲苯脱蜡至蒸馏水。用0.3%过氧化氢阻断内源性过氧化物酶10 min,PBS洗涤3次;柠檬酸盐缓冲液进行高压修复1.5 min。自然冷却至室温后,PBS(0.01 mol/L磷酸盐缓冲液,pH 7.4)洗涤3 次;羊血清封闭2 h;加入Ⅰ抗,4℃过夜。加入辣根过氧化物酶标记羊抗兔Ⅱ抗37℃,孵育30 min; DAB显色。苏木素复染、分化、透明,中性树胶封片。设阴性对照组以0.01 mol/L PBS代替Ⅰ抗。结果判定:CXCL14定位于胞浆,胞浆显色呈棕色为阳性表达;用Image-Pro Plus 6.0图像处理软件计算平均吸光度值,并进行统计分析。
3 统计学处理
用统计软件SPSS 19分析。数据以均数±标准差(mean±SD)表示。配对样本间比较采用Wilcoxon符号秩检验,两组独立样本间比较采用Mann-Whitney U检验,3组及以上独立样本间比较采用Kruskal-Wallis H检验;采用Kaplan-Meier生存曲线分析CXCL14蛋白表达与预后的关系。以P<0.05为差异有统计学意义。
结果
1 结直肠癌组织CXCL14 mRNA的表达
如图1A所示,CXCL14和GAPDH的熔解曲线为单峰,表明我们建立的实时荧光定量PCR方法能特异扩增目的基因。采用上述实时荧光定量PCR方法,我们进一步分析结直肠癌组织CXCL14 mRNA的表达。如图1B所示,肿瘤样本CXCL14 mRNA的相对表达值明显低于配对的正常组织(P<0.01)。
为了能够有效地测量企业员工的组织承诺,提高员工对组织的忠诚感与归属感,各国学者编制了各种不同的组织承诺量表,比较典型的有以下几种:
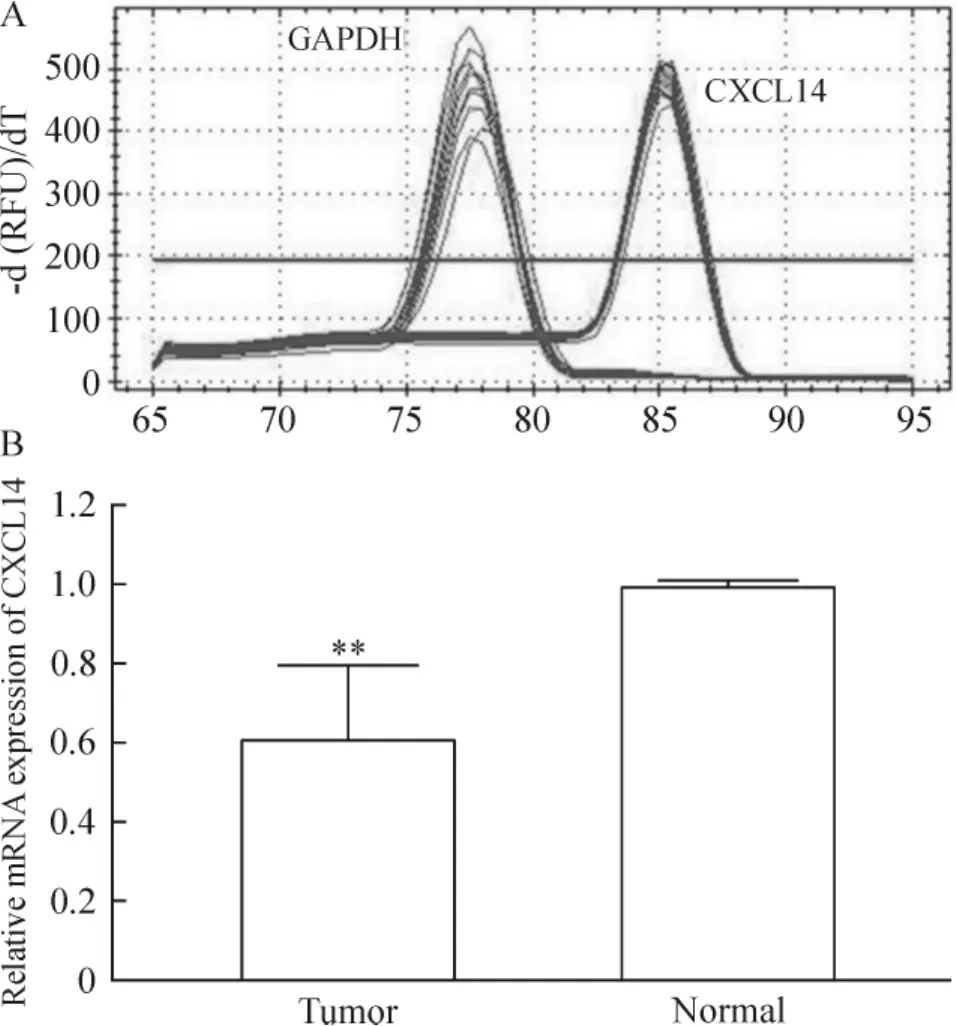
Figure 1.Expression of CXCL14 mRNA in colorectal cancer tissues.A:melting curves;B:relative mRNA expression of CXCL14.Mean±SD.n=20.**P<0.01 vs normal.图1 结直肠癌组织CXCL14 mRNA的表达
2结直肠癌组织CXCL14蛋白表达的免疫组化分析
结直肠癌组织与其配对正常组织CXCL14蛋白水平的表达见图2。CXCL14蛋白表达在胞浆,正常组织CXCL14表达呈强阳性、棕色染色,而肿瘤组织表达低或几乎无表达。采用半定量分析免疫组化结果,肿瘤样本及正常CXCL14的平均吸光度值分别为0.5411和0.1769。统计分析显示,CXCL14在肿瘤样品的表达水平低于正常组织(P<0.01)。
3 CXCL14蛋白表达水平与结直肠癌临床病理特征相关性
进一步分析肿瘤组织CXCL14的表达与结直肠癌临床病理特征相关性显示,CXCL14蛋白的表达与肿瘤的发生部位、淋巴结转移以及临床病理分期有显著相关性(P<0.05)。有淋巴结转移的结直肠癌肿瘤组织CXCL14的相对表达量明显低于无淋巴结转移肿瘤组织(P<0.05)。病理分期属III、IV期的结直肠癌肿瘤组织CXCL14的相对表达量也明显低于病理分期属I、II期的标本(P<0.05)。CXCL14的表达与年龄、性别、浸润程度、肿瘤标志物等未见显著相关性(P>0.05),见表2。
4 肿瘤组织CXCL14表达水平与结直肠癌预后分析
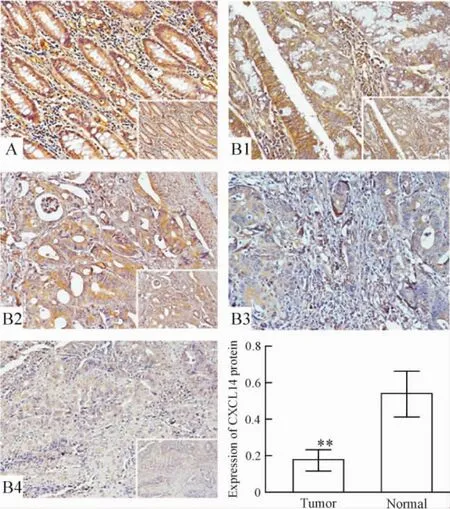
Figure 2.Expression of CXCL14 protein in colorectal cancer tissues(immunohistochemical staining,×200).A:normal;B1~4:tumorⅠ~Ⅳ,respectively.Mean± SD.n=20.**P<0.01 vs normal.图2 结直肠癌组织CXCL14蛋白的表达
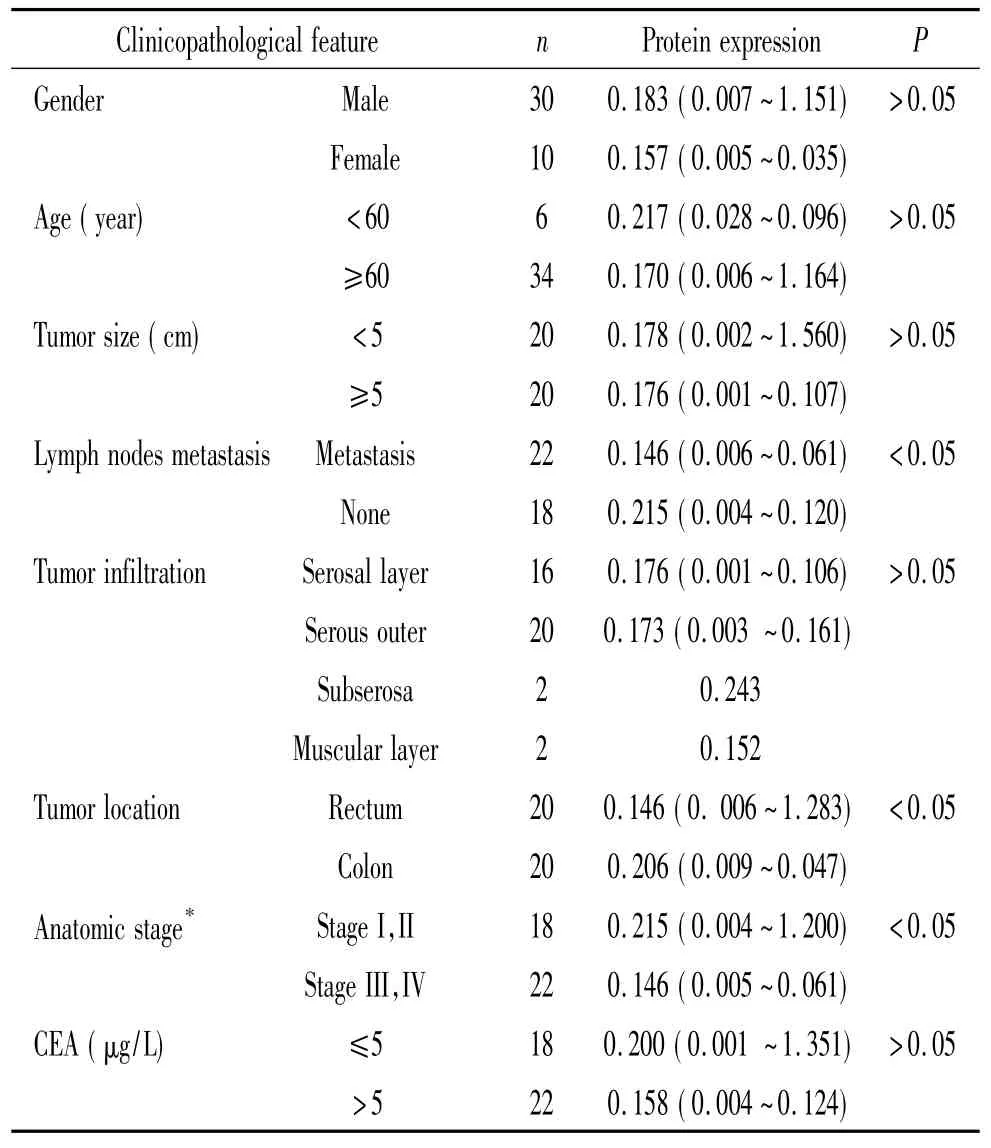
表2 结直肠癌标本CXCL14蛋白表达与临床病理特征的相关性分析Table 2.Correlation between clinicopathological features and CXCL14 protein expression in 40 specimens
40例结直肠癌标本总生存率为50.0%,根据成对肿瘤与正常组织CXCL14蛋白表达平均吸光度的相对值,设≥1/3的为1组,<1/3为2组,分别为22 和18例。Kaplan-Meier生存分析显示,1组和2组5年生存率分别为72.7%和11.1%,差异显著(P<0.01),见图3。

Figure 3.Survival curves of the colorectal cancer patients with different expression levels of CXCL14.1:high expression group:average absorbance value(tumor vs normal)≥1/3;2:low expression group:average absorbance value(tumor vs normal)<1/3.图3 直结肠癌患者不同CXCL14相对表达水平的生存曲线
讨论
肿瘤微环境的研究是目前肿瘤相关研究的热点。肿瘤微环境的细胞能分泌一些趋化因子,调节血管生成、宿主特异性免疫激活以及肿瘤细胞生长等肿瘤细胞和间质细胞间基本的生物学过程[2-4]。CXCL14是一种新型的趋化因子成员,最初是由Hromas等[12]报道。它的基因位于染色体5p31.1,由77个氨基酸组成[5]。除淋巴组织外,CXCL14在大脑、小肠、肾和上皮细胞等都有表达[6]。炎症反应时,CXCL14往往倾向于降低[13]。已经证实,CXCL14可以抗血管生成,还有趋化自然杀伤细胞、B细胞、巨噬细胞、单核细胞、未成熟树突状细胞等多种功能[2,6,13-15]。除了免疫学方面的功能,作为一个多功能趋化因子的CXCL14还与多种肿瘤的发生发展相关。研究显示,CXCL14在乳腺癌、肾细胞癌、肺癌、头颈部鳞状细胞癌、宫颈癌及胃癌组织中的表达减少或缺失[6-8,11-12,16]。Gu等[17]还发现在乳腺癌的生长和转移中,CXCL14蛋白的表达与淋巴结转移具有负相关性。
为分析CXCL14表达与结直肠癌的相关性,本研究通过实时荧光定量PCR和免疫组化检测结直肠癌肿瘤组织和癌旁正常组织CXCL14 mRNA及蛋白表达水平。与绝大多数肿瘤相关研究报道一致[6-8,11-12,16],我们发现CXCL14在结直肠癌组织中的表达明显低于正常组织。但本研究结果与最近Zeng等[18]的结果相反。为排除实验的误差,我们严格按照该文献提供的试剂和方法平行进行免疫组化检测,结果仍是结直肠癌组织标本CXCL14表达降低。
进一步分析CXCL14蛋白表达与临床病理特征的相关性发现,有淋巴结转移的结直肠癌肿瘤组织CXCL14表达明显低于无淋巴结转移肿瘤组织;病理分期属III、IV期的结直肠癌肿瘤组织CXCL14的相对表达量也明显低于病理分期属I、II期的标本。此外,肿瘤组织CXCL14表达水平与结直肠癌预后明显相关。这些现象提示,CXCL14参与结直肠癌的发展。已经证实,CXCL14可以通过抑制血管平滑肌细胞的趋化和微血管系统抑制肿瘤血管的形成[2,5,19-20]。这提示CXCL14不但是结直肠癌预后判断的重要指标,而且是一个新的候选治疗靶点。CXCL14表达水平与肿瘤浸润深度、性别、年龄、大小、分化等未见明显相关性,但直肠癌肿瘤组织CXCL14表达明显低于结肠癌组织,可能是不同组织CXCL14的基础表达水平不同。
综上所述,结直肠肿瘤组织中CXCL14表达减少可能参与了结直肠癌的发生和发展进程。检测肿瘤组织CXCL14的表达水平可作为结直肠癌患者预后评价的的临床辅助指标。
[1]Steele GD Jr,Jessup LM,Winchester DP,et al.Clinical highlights from the National Cancer Data Base:1995[J].CA Cancer J Clin,1995,45(2):102-111.
[2]Shellenberger TD,Wang M,Gujrati M,et al.BRAK/ CXCL14 is a potent inhibitor of angiogenesis and a chemotactic factor for immature dendritic cells[J].Cancer Res,2004,64(22):8262-8270.
[3]Balkwill F.The significance of cancer cell expression of the chemokine receptor CXCR4[J].Semin Cancer Biol,2004,14(3):171-179.
[4]Zlotnik A,Burkhardt AM,Homey B.Homeostatic chemokine receptors and organ-specific metastasis[J].Nat Rev Immunol,2011,11(9):597-606.
[5]Hara T,Nakayama Y.CXCL14 and insulin action[J].Vitam Horm,2009,80:107-123.
[6]Sleeman MA,Fraser JK,Murison JG,et al.B cell-and monocyte-activating chemokine(BMAC),a novel non-ELR alpha-chemokine[J].Int Immunol,2000,12(5): 677-689.
[7]Tessema M,Klinge DM,Yingling CM,et al.Re-expression of CXCL14,a common target for epigenetic silencing in lung cancer,induces tumor necrosis[J].Oncogene,2010,29(37):5159-5170.
[8]Balkwill FR.The chemokine system and cancer[J].J Pathol,2012,226(2):148-157.
[9]Augsten M,Hägglöf C,Olsson E,et al.CXCL14 is an autocrine growth factor for fibroblasts and acts as a multi-modal stimulator of prostate tumor growth[J].Proc Natl Acad Sci U S A,2009,106(9):3414-3419.
[10]Wente MN,Mayer C,Gaida MM,et al.CXCL14 expression and potential function in pancreatic cancer[J].Cancer Lett,2008,259(2):209-217.
[11]Hu C,Lin F,Zhu G,et al.Abnormal hypermethylation of promoter region downregulates chemokine CXC ligand 14 expression in gastric cancer[J].Int J Oncol,2013,43 (5):1487-1494.
[12]Hromas R,Broxmeyer HE,Kim C,et al.Cloning of BRAK,a novel divergent CXC chemokine preferentially expressed in normal versus malignant cells[J].Biochem Biophys Res Commun,1999,255(3):703-706.
[13]Kurth I,Willimann K,Schaerli P,et al.Monocyte selectivity and tissue localization suggests a role for breast and kidney-expressed chemokine(BRAK)in macrophage development[J].J Exp Med,2001,194(6):855-861.
[14]Starnes T,Rasila KK,Robertson MJ,et al.The chemokine CXCL14(BRAK)stimulates activated NK cell migration:implications for the downregulation of CXCL14 in malignancy[J].Exp Hematol,2006,34(8):1101-1105.
[15]Juremalm M,Nilsson G.Chemokine receptor expression by mast cells[J].Chem Immunol Allergy,2005,87:130-144.
[16]Park CR,You DJ,Kim DK,et al.CXCL14 enhances proliferation and migration of NCI-H460 human lung cancer cells overexpressing the glycoproteins containing heparan sulfate or sialic acid[J].J Cell Biochem,2013,114(5): 1084-1096.
[17]Gu XL,Ou ZL,Lin FJ,et al.Expression of CXCL14 and its anticancer role in breast cancer[J].Breast Cancer Res Treat,2012,135(3):725-735.
[18]Zeng J,Yang X,Cheng L,et al.Chemokine CXCL14 is associated with prognosis in patients with colorectal carcinoma after curative resection[J].J Transl Med,2013,11:6.
[19]Maerki C,Meuter S,Liebi M,et al.Potent and broadspectrum antimicrobial activity of CXCL14 suggests an immediate role in skin infections[J].J Immunol,2009,182 (1):507-514.
[20]张琦,陈融,牛军.αvβ6整合素对氟尿嘧啶诱导的结肠癌细胞凋亡的影响[J].中国病理生理杂志,2009,25(2):231-235.
Down-regulation of chemokine CXCL14 and its clinical relevance in colorectal cancer
LIN Ke-zhi1,LIN Feng2,ZHENG Shuang2,SHEN Jie2,SHEN Xian3,XUE Xiang-yang4
(1Medical Experimental Teaching Center,Wenzhou Medical University,Wenzhou 325035,China;2Department of General Surgery,Taizhou First People’s Hospital,Taizhou 318020,China;3Department of Gastrointestinal Surgery,The First Affiliated Hospital of Wenzhou Medical University,Wenzhou 325000,China;4Department of Microbiology and Immunology,Institute of Molecular Virology and Immunology,Wenzhou Medical University,Wenzhou 325035,China.E-mail:linfeng0316 @aliyun.com;wzxxy001@163.com)
AIM:To investigate the expression of chemokine CXCL14 and its clinical significance in colorectal cancer.METHODS:The CXCL14 expression was detected by real-time PCR and immunohistochemistry.Kaplan-Meier curve and Cox regression were used to evaluate the clinical significance of CXCL14 in colorectal cancer.RESULTS:The expression of CXCL14 at mRNA and protein levels declined in colorectal cancer tissues compared with the paired normal tissues(P<0.05).Down-regulation of CXCL14 was associated with tumor lymph node metastasis,the site and the clinical pathological stage(P<0.05),and also correlated with the prognosis closely.Kaplan-Meier survival analysis showed that the protein expression levels of CXCL14 were significantly different in the patients with different survival time(P<0.01).CONCLUSION:It is possible that CXCL14 acts a role in the development and progression of colorectal cancer.
Chemokine CXCL14;Survival analysis;Colorectal neoplasms
R363
A
10.3969/j.issn.1000-4718.2014.02.030
1000-4718(2014)02-0355-05
2013-09-22
2013-12-27
浙江省科技厅公益性技术应用研究计划项目(No.2012C37080);浙江省教育厅项目(No.Y201327980)
△通讯作者Tel:0577-86689910;沈洁E-mail:linfeng0316@aliyun.com;薛向阳E-mail:wzxxy001@163.com

