MicroRNA-196a通过HOXB7调控人骨髓间充质干细胞的增殖功能*
黎佼,董珺,张振辉,田朝伟,成传访,吴功雄,刘世明△
(1广州医科大学附属第二医院心血管内科,2广州心血管疾病研究所,广东广州 510260)
MicroRNA-196a通过HOXB7调控人骨髓间充质干细胞的增殖功能*
黎佼1,2,董珺1,张振辉1,田朝伟1,成传访1,2,吴功雄2,刘世明1,2△
(1广州医科大学附属第二医院心血管内科,2广州心血管疾病研究所,广东广州 510260)
目的:研究年龄相关microRNA-196a(miR-196a)对人骨髓间充质干细胞(hMSCs)增殖功能的调控作用。方法:通过MTT研究年龄对hMSCs增殖能力的影响。通过microRNA芯片和qRT-PCR检测年龄对miR-196a表达的影响。通过转染miR-196a模拟物或抑制物,研究其对hMSCs增殖能力的影响。通过萤光素酶报告基因系统证实HOXB7为miR-196a的靶基因。通过siRNA研究HOXB7对碱性成纤维细胞生f长因子(bFGF)表达及hMSCs增殖功能的影响和研究bFGF对hMSCs增殖功能的影响。结果:随年龄增加,hMSCs的增殖能力下降,miR-196a的表达增加。miR-196a可抑制hMSCs的增殖。抑制miR-196a的表达可促进hMSCs的增殖。同时抑制miR-196a和HOXB7的表达,使miR-196a失去对hMSCs增殖能力的调控作用。抑制HOXB7的表达可使bFGF的表达下调。直接抑制HOXB7或bFGF的表达可抑制hMSCs的增殖。结论:miR-196a通过抑制HOXB7及bFGF的表达导致hMSCs增殖能力下降。
人骨髓间充质干细胞;MicroRNA-196a;年龄;HOXB7蛋白
人骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hMSCs)具有增殖、分化及自我更新的能力。然而年龄能够影响hMSCs的功能,例如:随年龄增加,细胞增殖、分化能力下降,衰老增加[1]。已有研究证实microRNA参与调控细胞生存、复制、衰老、增殖及分化等过程[2-3]。并且随年龄的增加,microRNA的表达也发生改变。其中老年小鼠的肝脏、肺脏和脑组织的microRNA随年龄增加而表达发生改变;不同年龄段来源的人外周血单核细胞的microRNA表达也发生改变[2]。我们的前期研究同样证实老年C57/BL6小鼠来源的MSCs以及老年人来源的hMSCs的增殖、分化能力随年龄的增加而下降[4]。并且在hMSCs中,microRNA的表达随年龄的增加也发生改变,其中miR-196a表达上调最为明显[5]。关于miR-196a在hMSCs中的作用研究甚少,Kim等[6]证实miR-196a在促进人脂肪组织来源间充质干细胞(human adipose tissue-derived mesenchymal stem cells,hASCs)向成骨细胞分化过程中可能同时抑制了其增殖。基于miR-196a可能参与调控hMSCs增殖功能的假设,本研究观察了miR-196a对不同年龄段hMSCs增殖能力的调控作用,并进一步探讨其机制。
材料和方法
1 材料
1.1 人骨髓的提取通过广州医科大学附属第二医院伦理委员会批准,与患者签订知情同意书。在广州医科大学附属第二医院心外科瓣膜病患者手术过程中吸取人骨髓5 mL。供体为17~30岁者定义为年青组,65~80岁者定义为年老组。年青组与年老组患者均给与相同药物治疗,排除肿瘤、乙肝、HIV感染等因素。
1.2 主要试剂及仪器胎牛血清和Opti-MEM培养基(Gibco);Lipofectamine 2000转染试剂和Lipofectamine RNAiMAX转染试剂(Invitrogen);抗CD29、CD31、CD34、CD44、CD45和CD166流式抗体(Multi-Sciences Biotech);CellTiter 96细胞增殖试剂盒(Promega);SYBR Green荧光定量试剂盒和RNA逆转录试剂盒(Toyobo);淋巴细胞分离液(Ficoll);荧光定量PCR仪(ABI7300);多功能酶标仪(Tecan);RNA/ DNA微量分光光度计(NanoVue)。
2 方法
2.1 hMSCs的提取及鉴定将人骨髓小心叠加于等体积的淋巴细胞分离液上层,4℃下以2 000 r/ min离心20 min,吸取分离液和血浆界面云雾状的单个核细胞层,用无血清IMDM悬浮后,以1 000 r/min离心。按2×105/cm2密度接种于培养瓶中培养。48 h后换液,将不贴壁的细胞洗去。贴壁细胞每3 d换液,待细胞融合度达80%以上时,胰酶消化传代。流式细胞术检测细胞表面CD29、CD31、CD34、CD44、CD45和CD166的表达。
2.2 hMSCs增殖能力检测用Promega细胞增殖检测试剂盒检测hMSCs增殖能力。hMSCs以3 000 cells/well培养于96孔板中。每100 μL培养基中加入20 μL试剂盒中MTS及PMS混合液,4 h后通过酶标仪在波长490 nm处检测吸光度,并绘制细胞增殖曲线。
2.3 MicroRNA基因芯片检测及qRT-PCR检测分别选取年青组(17岁、20岁、25岁)及年老组(78岁、80岁、75岁)的hMSCs送于北京博奥生物有限公司进行microRNA基因芯片检测。用1 μg总RNA逆转录为cDNA。通过qRT-PCR检测miR-196a、同源框B7(homeobox B7,HOXB7)和碱性成纤维细胞生长因子(basic fibroblast growht factor,bFGF)的表达。分别选取U6及GAPDH作为内参照。各基因引物见表1。
2.4 双萤光素酶报告基因系统构建通过pGL4.13萤光素酶质粒构建pGL4.13-HOXB7-3’UTR报告基因载体,并通过重叠延伸PCR删除miR-196a与HOXB7 3’UTR直接结合位点,构建pGL4.13-HOXB7-3’UTR-mut。扩增所用引物见表1。
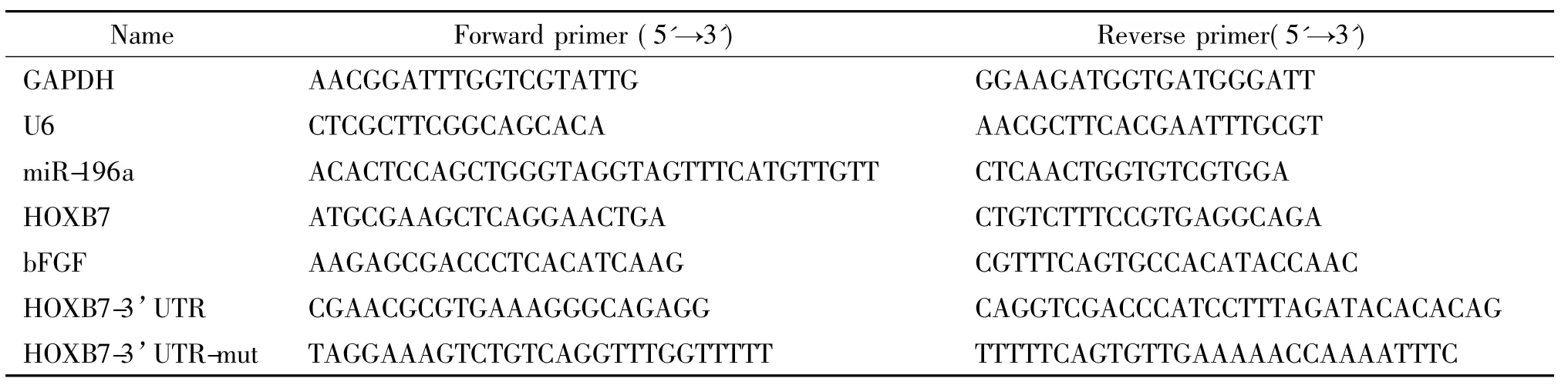
表1 引物序列Table 1.The sequences of the primers
2.5 细胞转染miR-196a模拟物、抑制物、si-HOXB7、si-bFGF及其相应的阴性对照均由上海吉玛公司合成,序列见表2。hMSCs培养于24孔板,无血清培养过夜后,更换为新鲜无血清及抗生素培养基(500 μL/well)。将小分子RNA稀释于100 μL Opti-MEM培养基中,加入1 μL Lipofectamine RNAiMAX,轻柔混匀后室温放置15 min;将RNAiMAX与microRNA/siRNA的稀释液加入24孔板的各孔细胞中,培养48 h按实验需要处理细胞。
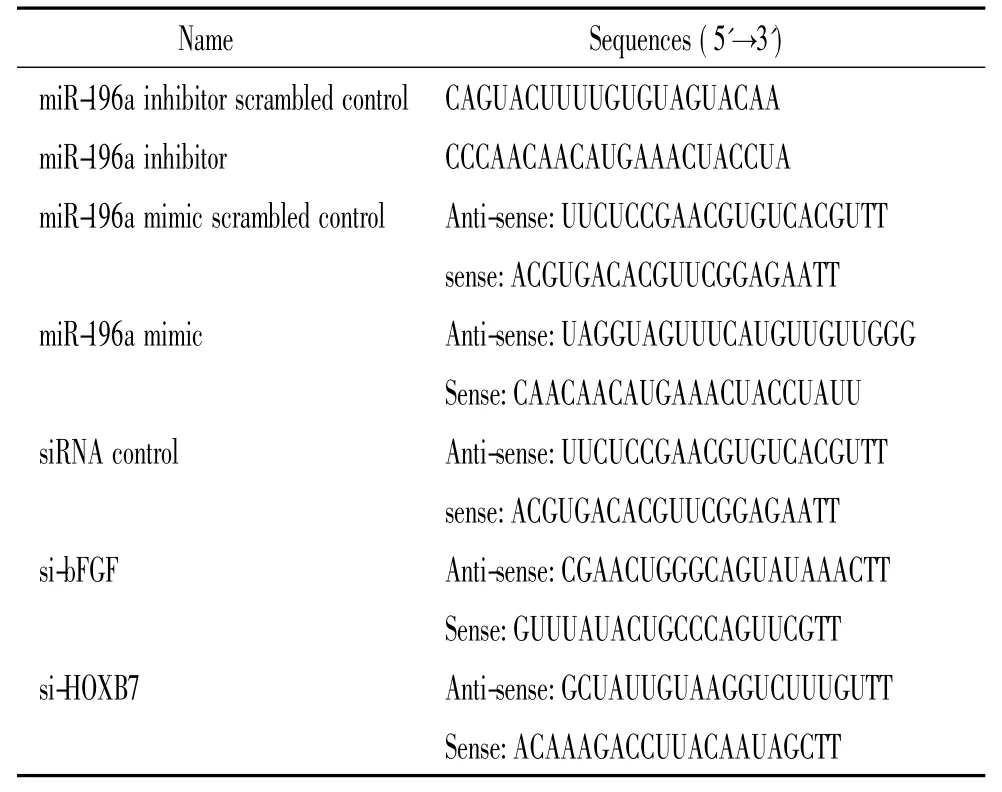
表2 MicroRNA与siRNA序列Table 2.The sequences of microRNA and siRNA
双萤光素酶报告系统实验:细胞于48孔板培养24 h后,更换为无血清和抗生素DMEM培养基(200 μL/well)。将小分子RNA和表达质粒稀释于25 μL Opti-MEM中,轻柔混匀;将1 μL Lipofectamine 2000稀释于25 μL Opti-MEM中混匀,室温放置5 min;将上述两液混合,室温放置20 min后加入各孔细胞中。培养6 h后更换成含10%血清的培养基,再培养42 h后按实验需要处理细胞。
miR-196a模拟物及阴性对照的终浓度为100 nmol/L;miR-196a抑制物及阴性对照的终浓度为200 nmol/L;siRNA及其对照的终浓度为20 nmol/L。
3 统计学处理
数据以均数±标准差(mean±SD)表示,应用SPSS16.0统计软件分析,两组间的差异显著性采用独立样本t检验,多组间的差异显著性采用单因素方差分析(One-way ANOVA)。
结果
1年龄影响了hMSCs增殖能力和microRNA的表达
通过流式细胞术检测年青和年老hMSCs表面特异性抗原的表达,发现年龄对hMSCs表面特异性抗原的表达并无影响。年青和年老hMSCs均表达间充质干细胞表面特异性抗原CD44(87.20%±9.30% vs 89.73%±6.82%)、CD29(95.32%±3.31%vs 96.30%±2.52%)和CD166(80.42%±12.67%vs 79.28%±8.27%),而不表达造血干细胞表面特异性抗原CD34(0.013%±0.006%vs 0.016%± 0.012%)、CD31(0.020%±0.013%vs 0.018%± 0.009%)和CD45(0.010%±0.014%vs 0.015%± 0.010%)。但随年龄增加,hMSCs增殖能力下降,见图1A。年龄也影响了microRNA的表达,通过Affymetrix GeneChip 2.0 microRNA芯片分析我们发现miR-196a的表达随年龄增加而上调,见图1B。通过qRT-PCR检测,我们进一步证实,与年青组相比,年老组hMSCs中miR-196a表达上调6.51倍,见图1C。
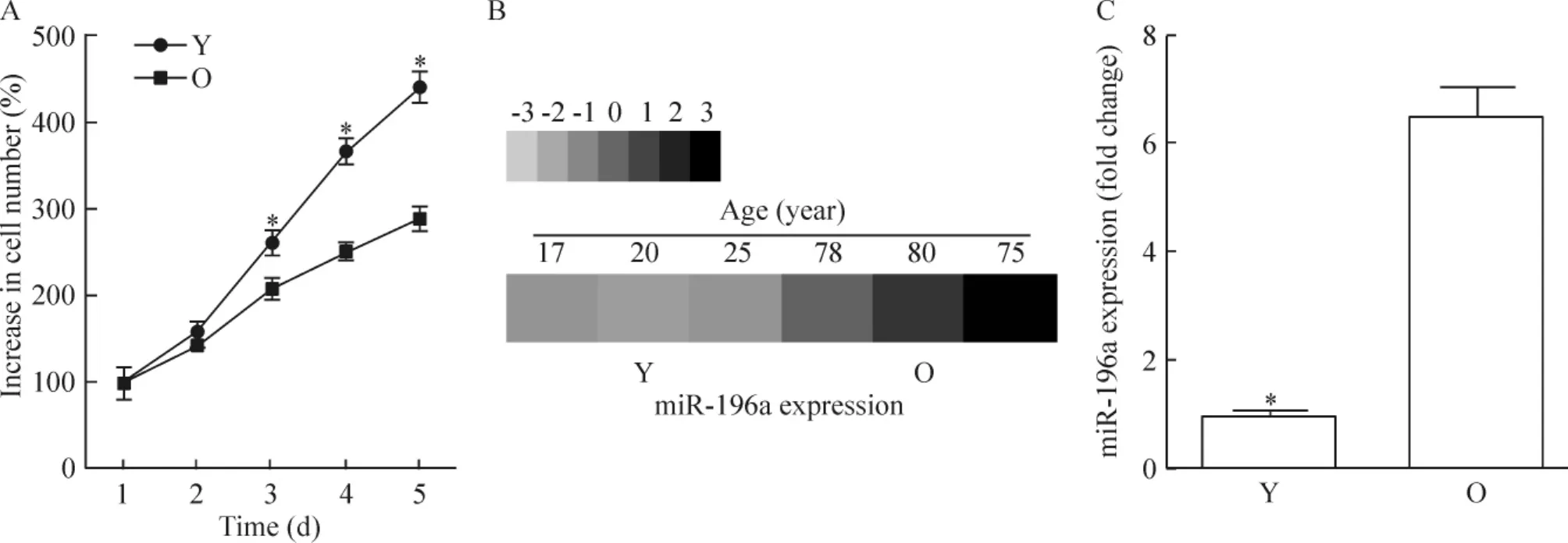
Figure 1.Alternation of proliferation and miR-196a expression in young(Y)and old(O)hMSCs.A:five-day growth curves of the hMSCs;B:miR-196a expression in the hMSCs was determined by microarray analysis;C:miR-196a expression in the hMSCs was determined by qRT-PCR.Mean±SD.n=3.*P<0.05 vs O.图1年龄对hMSCs增殖能力及miR-196a表达的影响
2 miR-196a抑制了hMSCs的增殖能力
通过转染miR-196a抑制物,与阴性对照组相比,年青组和年老组的miR-196a分别下调了0.70倍及0.61倍。相反,通过转染miR-196a模拟物,与阴性对照组相比,年青组和年老组的miR-196a分别上调了5.0倍及6.5倍,见图2A。抑制miR-196a表达后,我们发现年青组及年老组的hMSCs增殖能力上升;相反,过表达miR-196a后,年青组及年老组的hMSCs增殖能力下降,见图2B、C。
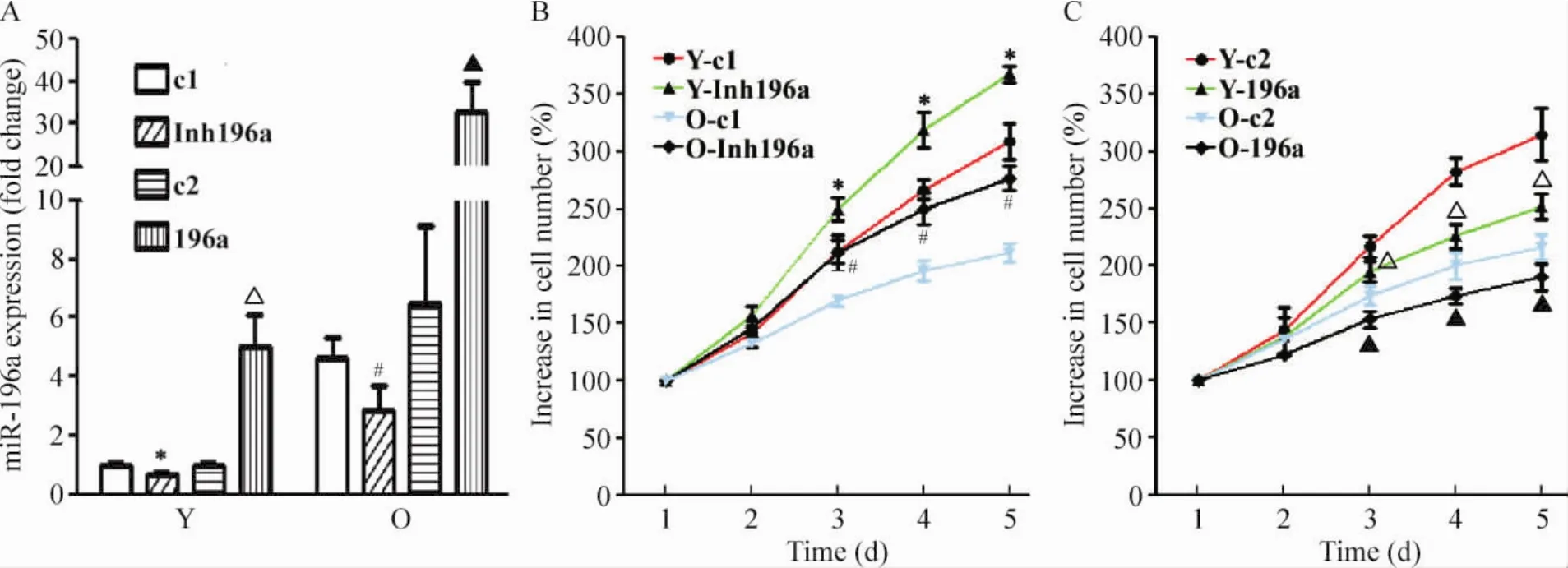
Figure 2.Effect of miR-196a on young(Y)and old(O)hMSC proliferation.A:down-regulated miR-196a expression in hMSCs by miR-196a inhibitor(Inh196a)and up-regulated miR-196a expression in hMSCs by miR-196a mimic(196a);B:five-day growth curves of Inh196a-transfected hMSCs;C:five-day growth curves of 196a-transfected hMSCs.c1:miR-196a inhibitor scrambled control;c2:miR-196 mimic scrambled control.Mean±SD.n=3.*P<0.05 vs Y-c1;△P<0.05 vs Y-c2;#P<0.05 vs O-c1;▲P<0.05 vs O-c2.图2 miR-196a对hMSCs增殖功能的影响
3 miR-196a直接调控HOXB7的表达
通过TargetScan网站预测,我们发现miR-196a可与HOXB7 3’UTR相结合,直接调节HOXB7的表达,见图3A。我们将hMSCs同时转染miR-196a的模拟物和HOXB7的报告基因载体(野生型HOXB7和突变型HOXB7-mut),结果显示,与空白对照组相比,转染野生型载体的细胞萤光素酶活性下降至0.66倍,而转染突变型载体未见变化,见图3B。hMSCs先转染miR-196a的抑制物,抑制内源性miR-196a表达,再转染HOXB7的报告基因载体(野生型HOXB7和突变型HOXB7-mut),结果发现转染野生型载体的细胞萤光素酶活性升高至1.40倍,而转染突变型载体未见变化,见图3C。
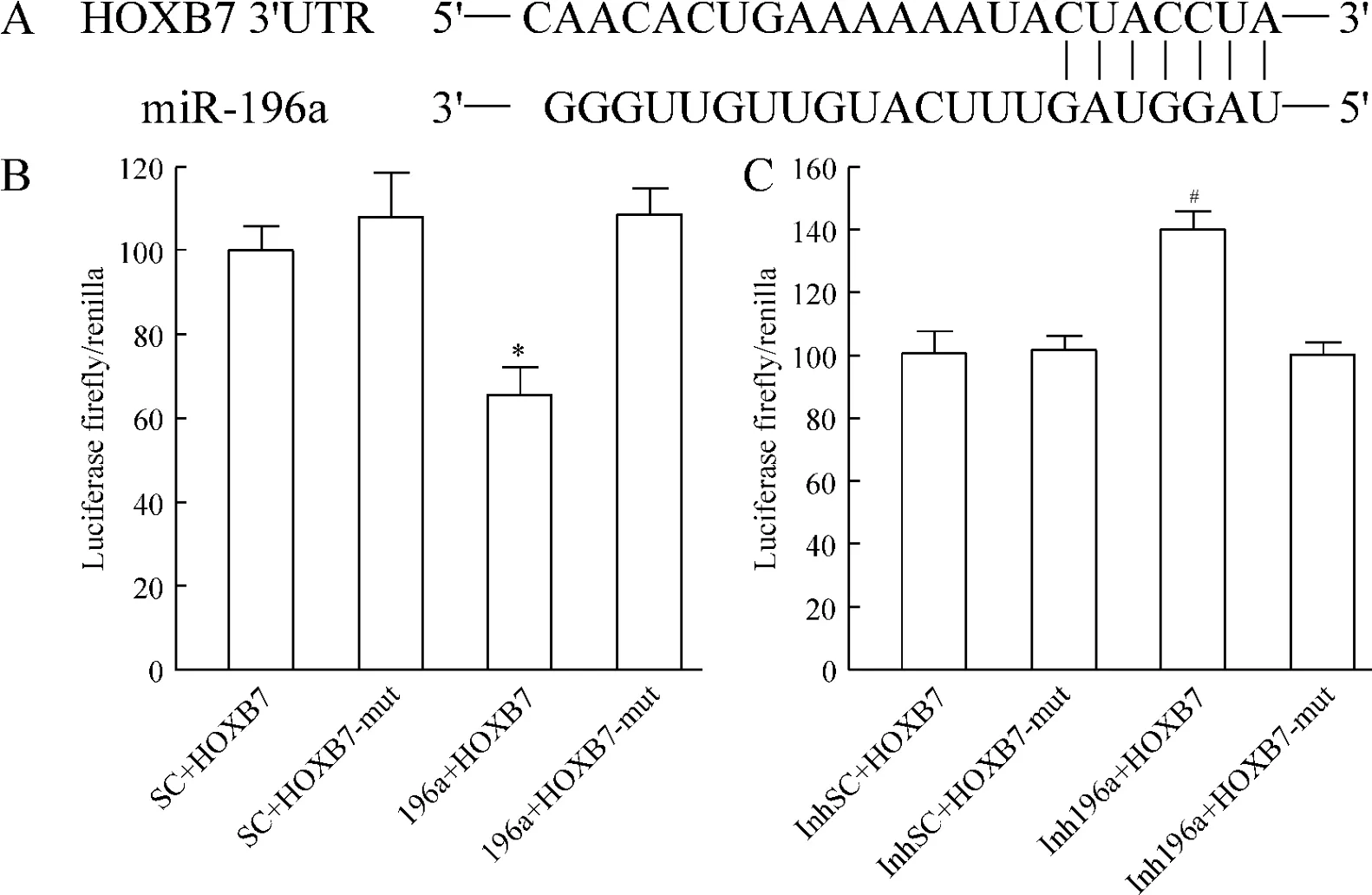
Figure 3.miR-196a targeted the 3’UTR of HOXB7 mRNA.A:miR-196a sequences and the binding sites in HXB7 3’UTR;B: hMSCs were cotransfected with miR-196a mimic(196a)or scrambled control(SC)and pGL4.13-HOXB7-3’UTR or pGL4.13-HOXB7-3’UTR-mut;C:hMSCs were cotransfected with miR-196a inhibitor(Inh196a)or inhibitor SC(InhSC) and pGL4.13-HOXB7-3’UTR or pGL4.13-HOXB7-3’UTR-mut.The luciferase activity for HOXB7 3’UTR was measured 48 h after transfection and normalized to endogenous Renilla luciferase.Mean±SD.n=4.*P<0.05 vs 196a+HOXB7-mut;#P<0.05 vs Inh196a+HOXB7-mut.图3 miR-196a直接调控HOXB7的表达
4 miR-196a通过HOXB7抑制hMSCs增殖
通过qRT-PCR检测我们发现,HOXB7的表达与miR-196a刚好相反,随年龄的增加而下调,年老组为年青组的0.31倍,见图4A。通过转染miR-196a模拟物过表达miR-196a,我们发现年青及年老的hMSCs中HOXB7 mRNA和蛋白表达相应下调,mRNA表达量分别为对照组的0.47倍及0.38倍,见图4B、C。通过转染miR-196a抑制物抑制miR-196a的表达,我们发现年青及年老的hMSCs中HOXB7的表达相应上调,分别为对照组的2.55倍及3.37倍,见图4C。为了进一步证实miR-196a通过HOXB7抑制hMSCs增殖,我们构建了siRNA抑制HOXB7的表达,qRT-PCR的实验结果显示,siRNA可以抑制年青及年老的hMSCs中HOXB7的表达,分别为对照组的0.23倍及0.31倍,见图4C。直接抑制HXOB7表达后,我们同样发现年青及年老hMSCs的增殖能力下降,见图4D。我们通过siRNA抑制HOXB7的表达对抗miR-196a抑制物对HOXB7表达的上调作用后检测年青及年老hMSCs的增殖能力,发现抑制HOXB7的表达后miR-196a抑制物丧失了促进年青及年老hMSCs增殖的能力,见图4C、E。

Figure 4.Effect of HOXB7 on young(Y)and old(O)hMSC proliferation.A:HOXB7 mRNA expression in the hMSCs;B:HOXB7 protein expression in miR-196a mimic(196a)-transfected Y and O hMSCs;C:HOXB7 mRNA expression in the hMSCs transfected with 196a,miR-196a inhibitor(Inh196a),si-HOXB7 or Inh196a+si-HOXB7;D:five-day growth curves of the hMSCs transfected with si-HOXB7;E:five-day growth curves of the hMSCs cotransfected with Inh196a and si-HOXB7.c1:miR-196a mimic scrambled control;c2:miR-196a inhibitor scrambled control;c3:si-HOXB7 control;c4:miR-196a inhibitor scrambled control and si-HOXB7 control.Mean±SD.n=3.☆P<0.05 vs O;▲P<0.05 vs c1;△P<0.05 vs c2;*P<0.05 vs Y-c3;#P<0.05 O-c3.图4 HOXB7对hMSCs增殖的影响
5 HOXB7调控bFGF的表达
qRT-PCR的结果显示,bFGF的表达与HOXB7类似,随年龄的增加而下调,年老组为年青组的0.36倍,见图5A。通过转染miR-196a模拟物过表达miR-196a,我们发现年青及年老的hMSCs中bFGF的表达相应下调,分别为对照组的0.59倍及0.33倍;通过转染miR-196a抑制物抑制miR-196a的表达,我们发现年青及年老的hMSCs中bFGF的表达相应上调,分别上调至2.04倍及3.34倍;通过siRNA抑制HOXB7表达,我们发现年青及年老hMSCs中bFGF的表达相应的下调,分别为对照组的0.35倍及0.26 倍;同时抑制HOXB7及miR-196a表达时,我们发现实验组与对照组中bFGF的表达无显著差异,见图5B。我们同样构建了siRNA直接抑制bFGF的表达,通过qRT-PCR我们发现siRNA可以抑制年青及年老hMSCs中bFGF的表达,分别为对照组的0.30倍及0.13倍;直接抑制bFGF表达后,我们同样发现年青及年老hMSCs的增殖能力下降,见图5B、C。
上述结果表明,年龄的增长导致hMSCs中miR-196a的表达增加,从而抑制了其靶基因HOXB7的表达;HOXB7表达下调,使其调控的bFGF表达也同样下降,两者的共同作用使年青及年老hMSCs增殖能力下降,见图5D。
讨论
目前为止,很多研究发现microRNAs与年龄增加引起的功能改变及导致的疾病有关,但是microRNAs在此过程中的所起的作用及其机制了解甚少。本课题组的前期研究通过microRNAs芯片技术,比较了年青和年老的hMSCs中900多个microRNAs的表达,并通过qRT-PCR证实hMSCs中miR-196a、miR-378、miR-486-5p和miR-664-star的表达随年龄的增加而上调;而miR-10a、miR-708和miR-3197的表达随年龄的增加而下调[5]。其中miR-196a随年龄的增加表达上调最明显。本研究进一步探讨了miR-196a对hMSCs功能的调控作用及其机制。
MicroRNAs可参与调控干细胞的增殖功能。Liu等[7]的研究发现miR-17-92簇调控脑卒中后神经祖细胞的增殖及存活。在缺血神经祖细胞或者缺血动物的室下区过表达miR-17-92簇均可促进细胞增殖,相反抑制其表达则抑制细胞增殖,增加细胞死亡。同样,也有研究证实miR-210可通过抑制铁硫簇支架同系物(iron-sulfur cluster scaffold homolog 2,ISCU2)及蛋白酪氨酸磷酸酶非受体2型(protein tyrosine phosphatase,non-receptor type 2,PTPN2)的表达促进hASCs的增殖及迁移[8]。Wang等[9]的研究也证实miR-16抑制了蜕膜来源间充质干细胞的增殖及迁移,并且通过调控周期素E1使细胞周期停滞。
在与增殖功能相关microRNAs的研究中,miR-196a被证实参与调控多种细胞的增殖。我们的研究证实,miR-196a的表达上调是年龄导致hMSCs增殖能力下降的主要因素。这与Kim等[6]在hASCs中的研究类似,他们证实miR-196a通过调控HOXC8的表达抑制了hASCs的增殖。在非小细胞肺癌的研究中发现miR-196a在癌组织及肺癌细胞株中高表达,miR-196a通过抑制HOXA5的表达促进肿瘤细胞增殖和侵袭[10]。Sun等[11]在胃癌中也发现miR-196a的表达上调。肿瘤体积越大,临床分期越高,miR-196a表达越高。而相应的,miR-196a表达越高,胃癌病人生存时间越短。在胃癌细胞株SGC7901中抑制miR-196a表达可以抑制细胞周期的进展,抑制细胞增殖及细胞集落单位的形成。细胞类型及调控机制的不同可能是导致miR-196a功能差异的主要原因。
一个microRNA可能调控多个靶基因,多个microRNA也可能只调控一个靶基因。研究证实miR-196a的靶基因可能有:HOXB8、HOXC8、HOXD8、 HOXA7、HOXB7、ERG、HMGA2、ANXA1、S100A9、SPRR2C、KRTS等。我们的研究证实在hMSCs中HOXB7为miR-196a的靶基因,miR-196a可以直接抑制HOXB7 mRNA和蛋白的表达。这与Kim等[6]在hASCs中的研究结果,以及Braig等[12]在黑色素瘤中的研究结果类似。HOXB7被证实可促进多种细胞的增殖:在造血干细胞的研究中,Care等[13]发现HOXB7可以促进造血干细胞的增殖和分化;Liao等[14]的研究发现在结直肠癌细胞株中过表达HOXB7可以促进细胞增殖和肿瘤形成,HOXB7在结直肠癌进展中起重要作用;在口腔癌中的研究也发现了类似的结果:口腔癌的发病可能是由HXOB7促进细胞增殖而导致的,HXOB7可能是口腔鳞癌重要的预后指标[15]。此外,Naora等[16]的研究发现在正常卵巢表面上皮细胞中过表达HOXB7可以促进细胞增殖,更重要的是,此研究进一步证实HOXB7可以结合并反式激活bFGF启动子,促进细胞蓄积和释放bFGF。在乳腺癌细胞中的研究也同样发现,HOXB7的表达促进了bFGF的表达[17]。与HOXB7类似,bFGF同样也可以促进多种干细胞增殖,例如bFGF可以减少细胞群体倍增时间,促进脐带来源干细胞的增殖,而不影响其免疫表型的表达及免疫功能[18];bFGF可以促进滑膜干细胞的增殖并促进其向成骨细胞分化[19]。这与我们的研究结果是一致的:随年龄的增加hMSCs中HOXB7和bFGF的表达下调,细胞增殖能力下降。通过siRNA直接抑制HOXB7或者bFGF的表达可以抑制hMSCs增殖。HXOB7与bFGF表达下调是miR-196a导致hMSCs增殖能力下降的主要原因。
综上所述,miR-196a通过抑制HOXB7及bFGF的表达导致hMSCs增殖能力下降。本课题阐述了miR-196a导致hMSCs增殖能力下降的机制,为年龄相关microRNAs——miR-196a的运用提供了理论基础,为microRNAs及hMSCs在再生医学中的运用提供了新的研究方向。
[1]Sethe S,Scutt A,Stolzing A.Aging of mesenchymal stem cells[J].Ageing Res Rev,2006,5(1):91-116.
[2]Noren HN,Abdelmohsen K,Gorospe M,et al.micro-RNA expression patterns reveal differential expression of target genes with age[J].PLoS One,2010,5(5): e10724.
[3]Bartel DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[4]黎佼,陈敏生,杨伟健,等.年轻骨髓间充质干细胞可通过细胞融合改善年老骨髓间充质干细胞功能[J].中国病理生理杂志,2010,26(5):976-981.
[5]Li J,Dong J,Zhang ZH,et al.miR-10a restores human mesenchymal stem cell differentiation by repressing KLF4 [J].J Cell Physiol,2013,228(12):2324-2336.
[6]Kim YJ,Bae SW,Yu SS,et al.miR-196a regulates proliferation and osteogenic differentiation in mesenchymal stem cells derived from human adipose tissue[J].J Bone Miner Res,2009,24(5):816-825.
[7]Liu XS,Chopp M,Wang XL,et al.MicroRNA-17-92 cluster mediates the proliferation and survival of neural progenitor cells after stroke[J].J Biol Chem,2013,288 (18):12478-12488.
[8]Kim JH,Park SG,Song SY,et al.Reactive oxygen species-responsive miR-210 regulates proliferation and migration of adipose-derived stem cells via PTPN2[J].Cell Death Dis,2013,4:e588.
[9]Wang Y,Fan H,Zhao G,et al.miR-16 inhibits the proliferation and angiogenesis-regulating potential of mesenchymal stem cells in severe pre-eclampsia[J].FEBS J,2012,279(24):4510-4524.
[10]Liu XH,Lu KH,Wang KM,et al.MicroRNA-196a promotes non-small cell lung cancer cell proliferation and invasion through targeting HOXA5[J].BMC Cancer,2012,12:348.
[11]Sun M,Liu X H,Li J H,et al.MiR-196a is upregulated in gastric cancer and promotes cell proliferation by downregulating p27kip1[J].Mol Cancer Ther,2012,11(4): 842-852.
[12]Braig S,Mueller DW,Rothhammer T,et al.MicroRNA miR-196a is a central regulator of HOX-B7 and BMP4 expression in malignant melanoma[J].Cell Mol Life Sci,2010,67(20):3535-3548.
[13]Carè A,Valtieri M,Mattia G,et al.Enforced expression of HOXB7 promotes hematopoietic stem cell proliferation and myeloid-restricted progenitor differentiation[J].Oncogene,1999,18(11):1993-2001.
[14]Liao WT,Jiang D,Yuan J,et al.HOXB7 as a prognostic factor and mediator of colorectal cancer progression[J].Clin Cancer Res,2011,17(11):3569-3578.
[15]De Souza Setubal Destro MF,Bitu CC,Zecchin KG,et al.Overexpression of HOXB7 homeobox gene in oral cancer induces cellular proliferation and is associated with poor prognosis[J].Int J Oncol,2010,36(1):141-149.
[16]Naora H,Yang YQ,Montz FJ,et al.A serologically identified tumor antigen encoded by a homeobox gene promotes growth of ovarian epithelial cells[J].Proc Natl Acad Sci USA,2001,98(7):4060-4065.
[17]Wu X,Chen H,Parker B,et al.HOXB7,a homeodomain protein,is overexpressed in breast cancer and confers epithelial-mesenchymal transition[J].Cancer Res,2006,66(19):9527-9534.
[18]Ramasamy R,Tong CK,Yip WK,et al.Basic fibroblast growth factor modulates cell cycle of human umbilical cord-derived mesenchymal stem cells[J].Cell Prolif,2012,45(2):132-139.
[19]Kim JH,Lee MC,Seong SC,et al.Enhanced proliferation and chondrogenic differentiation of human synoviumderived stem cells expanded with basic fibroblast growth factor[J].Tissue Eng Part A,2011,17(7-8):991-1002.
MicroRNA-196a modulates proliferation of human bone marrow mesenchymal stem cells through HOXB7
LI Jiao1,2,DONG Jun1,ZHANG Zhen-hui1,TIAN Chao-wei1,CHENG Chuan-fang1,2,WU Gong-xiong2,LIU Shi-ming1,2
(1Department of Cardiology,The Second Affiliated Hospital,2Guangzhou Institute of Cardiovascular Diseases,Guangzhou Medical University,Guangzhou 510260,China.E-mail:gzliushiming@126.com)
AIM:To investigate the effects of microRNA-196a(miR-196a)on the proliferation of human bone marrow mesenchymal stem cells(hMSCs).METHODS:Cell growth was evaluated by MTT assay.The expression of miR-196a was determined by microRNA array and quantitative real-time PCR(qRT-PCR).The effect of miR-196a on hMSC proliferation was detected by transfection of miR-196a mimic or inhibitor.Using dual-luciferase reporter system,the target gene of miR-196a was identified.The effect of HOXB7 on basic fibroblast growth factor(bFGF)expression and hMSC proliferation was detected by siRNA.The effect of bFGF on hMSC proliferation was analyzed by siRNA.RESULTS:The proliferation ability was decreased and the expression of miR-196a was up-regulated in the old hMSCs compared with the young hMSCs.Up-regulation of miR-196a resulted in increased proliferation of hMSCs.Conversely,down-regulation of miR-196a resulted in decreased cell proliferation.Homeobox B7(HOXB7)was the target gene of miR-196a.The regulation of miR-196a on hMSC proliferation was attenuated by inhibiting the expression of miR-196a and HOXB7 together.Down-regulation of miR-196a inhibited the expression of bFGF.Direct repression of HOXB7 or bFGF expression inhibited the hMSC proliferation.CONCLUSION:miR-196a inhibits the proliferation of hMSCs by repressing the expression of HOXB7 and bFGF.
Human bone marrow mesenchymal stem cells;MicroRNA-196a;Age;HOXB7 protein
R363
A
10.3969/j.issn.1000-4718.2014.02.015
1000-4718(2014)02-0278-08
2013-09-25
2013-12-11
广州市科信局重大民生攻关专项(No.2012Y2-00027);广州市属高校科研计划项目(No.2012C232);广州医科大学博士科研项目(No.2012C42)
△通讯作者Tel:020-34153522;E-mail:gzliushiming@126.com

