ACSL3在前列腺癌细胞系中的表达及其对前列腺癌转移的影响*
李科,陈怡,董艳,叶志强
(中山大学附属第三医院1泌尿外科,4急诊科,广东广州 510630;2中山大学孙逸仙纪念医院乳腺外科,广东广州 510120;3暨南大学生命科学技术学院生物工程系,广东广州 510632)
ACSL3在前列腺癌细胞系中的表达及其对前列腺癌转移的影响*
李科1,陈怡2,董艳3,叶志强4△
(中山大学附属第三医院1泌尿外科,4急诊科,广东广州 510630;2中山大学孙逸仙纪念医院乳腺外科,广东广州 510120;3暨南大学生命科学技术学院生物工程系,广东广州 510632)
目的:观察比较长链脂酰辅酶A合成酶3(long-chain acyl-CoA synthetase 3,ACSL3)在前列腺正常上皮细胞和不同类型前列腺癌细胞系中的表达差异,通过构建ACSL3基因稳定表达的前列腺癌细胞株研究ACSL3对前列腺癌细胞侵袭能力的影响。方法:利用RT-PCR方法检测ACSL3 mRNA在前列腺正常上皮细胞、局限性及转移性前列腺癌细胞中的表达情况,分析其表达与前列腺癌发生、进展及转移的关系;以前列腺癌细胞基因组cDNA为模板,通过PCR扩增ACSL3基因,重组构建含有Flag标签的pCDNA3.1(+)-Flag-ACSL3质粒,包装慢病毒,转染前列腺癌细胞,通过荧光显微镜、RT-PCR和Western blotting等方法鉴定ACSL3在细胞内的表达情况;利用Transwell侵袭实验研究ACSL3对前列腺癌细胞侵袭能力的改变。结果:较前列腺正常上皮细胞,各种前列腺癌细胞中ACSL3 mRNA表达均明显下降。同时,局限性前列腺癌细胞中ACLS3 mRNA表达较转移性前列腺癌细胞明显升高;此外,雄激素非依赖性前列腺癌细胞比雄激素依赖性前列腺癌细胞中ACLS3 mRNA表达显著降低。进而,我们成功构建和包装了表达ACSL3基因的pCDNA3.1(+)-Flag-ACSL3重组质粒及慢病毒,并转染前列腺癌细胞,筛选出稳定表达株;并且,通过Transwell实验证实ACSL3表达与前列腺癌细胞的侵袭能力呈负相关。结论:前列腺正常上皮细胞及不同前列腺癌细胞系中ACSL3的表达存在明显差异,提示ACSL3可能在前列腺癌的发生发展中起重要作用;成功构建了ACSL3基因稳定表达的前列腺癌细胞株,并初步证实ACSL3过表达可以抑制前列腺癌细胞的侵袭力。
前列腺肿瘤;长链脂酰辅酶A合成酶3;肿瘤侵袭
前列腺癌(prostate cancer,PCa)是欧美男性发病率最高的恶性肿瘤,死亡率仅次于肺癌[1]。近年来,随着生活环境的改变、饮食结构的调整和人口的老龄化比例上升等高危因素的增多,我国PCa发病率和死亡率逐年升高,且上升趋势较快[2]。PCa发病及病程均较隐匿,研究发现PCa一旦进展转移,临床根治的可能性就微乎其微,转移已成为患者死亡的最主要原因[3]。目前,雄激素剥夺仍是PCa的主要治疗方法之一;然而报道指出,去势治疗12~18个月后,因为雄激素受体(androgen receptor,AR)相关信号通路的作用,雄激素依赖性PCa(androgen-dependent prostate cancer,ADPC)可逐渐演化为雄激素非依赖性PCa(androgen-independent prostate cancer,AIPC),从而导致患者最终死于雄激素不敏感细胞的广泛转移[4]。遗憾的是,现今临床上无论是病理分期,还是Gleason评分等因素均无法有效地对PCa的转归进行有效的评估。因此,寻找新颖可靠的PCa特异性标志物以及治疗干预靶点,对于准确预测PCa的发生与进展,深入研究HDPC向AIPC演变的机制,探索有效的治疗措施,延长患者生存期和提高患者生活质量有着重大意义。
近来,国外有研究利用蛋白组学技术和表达微阵列分析筛选PCa中AR信号通路的相关调节蛋白,发现长链脂酰辅酶A合成酶3(long-chain acyl-CoA synthetase 3,ACSL3)为AR信号通路调节的目标基因之一,并在临床PCa组织样本中证实其转录和蛋白表达水平明显下调,提示ACSL3可能与PCa的发生、进展密切相关[5]。此外,另有文献报道,ACSL3 与ETV1所组成的新型融合基因是导致ETV1在PCa中重排的重要因素,从而导致了PCa生物学行为的改变[6]。ACSL3作为长链脂酰辅酶A合成酶家族的成员之一,其主要生物学功能是调节机体内脂肪酸代谢,催化脂肪酸转化成长链乙酰辅酶A,对于脂质的合成、蛋白质的修饰、β-氧化等过程都具有重要意义[7];而脂肪酸代谢的异常与能量的获得与传递紧密相连,是肿瘤发生、进展的重要环节。本研究检测ACSL3在前列腺正常上皮细胞、局限性PCa细胞以及转移性PCa细胞中的表达差异,并比较ACSL3表达与PCa细胞的雄激素依赖性与否是否存在着关联;继而,通过构建ACSL3真核表达质粒,并包装慢病毒,转移PCa细胞后筛选出ACSL3稳定表达细胞株,为进一步研究ACSL3在PCa发生、进展和转移中的作用、分子机制及临床意义奠定实验基础。
材料和方法
1 材料
1.1 质粒、细胞、菌株实验所需前列腺正常上皮细胞RWPE-I、局限性PCa细胞株22Rv1(雄激素依赖性)、转移性PCa细胞株LNCaP(雄激素依赖性)和PC-3(雄激素非依赖性)均由武汉大学中国典型培养物保藏中心提供。pCDNA3.1(+)-Flag质粒为本实验室保存;pLenti-GFP-Neo载体购自GenScript;慢病毒载体系统购自Tronolab;大肠杆菌DH5α购自TaKaRa。
1.2 主要试剂Trizol Reagent、Lipofectamine LTX、Keratinocyte Serum-Free Medium和胎牛血清购自Invitrogen;EcoR I、Xho I、Ex Taq聚合酶、DNA Ligation Kit Ver.2.0、PrimeScriptTMOne Step RT-PCR Kit和PrimeScriptTMRT reagent Kit(Perfect Real Time)购自TaKaRa;凝胶DNA纯化回收试剂盒、质粒DNA小提试剂盒、PCR回收试剂盒以及去内毒素质粒中提试剂盒均购自Omega;Matrigel购自BD;Transwell板购自Corning;鼠源抗Flag标签单克隆抗体购自CST。
1.3 引物根据GenBank已发表的ACSL3基因序列设计RT-PCR特异性引物,正义链5’-CAATTACAGAAGTGTGGGACT-3’,反义链5’-CACCTTCCTCCCAGTTCTTT-3’,由上海生工公司合成并检测。根据GenBank已发表的ACSL3基因序列设计常规PCR特异性引物,正义链5’-CCGGAATTCGCCACCATGAATAACCACGTGTCTT-3’,反义链5’-CCGCTCGAGTTTTCTTCCATACATTCGCT-3’,在上游引物引入EcoR I酶切位点,下游引物引入Xho I酶切位点。引物均由上海生工公司合成并检测。
2 方法
2.1 RT-PCR检测ACSL3 mRNA在不同前列腺细胞中的表达水平前列腺正常上皮细胞RWPE-I、PCa细胞LNCaP、22Rv1和PC-3分别培养于6孔板中,当细胞铺满培养孔时,Trizol抽提RNA,并以RNA为模板进行逆转录反应,PCR程序为:37℃15 min;85℃5 s。然后以不同细胞的cDNA为模板,ACSL3特异性荧光定量引物进行RT-PCR实验,具体操作步骤参考PrimeScriptTMRT reagent Kit(Perfect Real Time)说明书,本实验采用相对定量PCR反应,以GAPDH基因作为内参照。
2.2 重组pCDNA3.1(+)-Flag-ACSL3质粒的构建以PC-3细胞基因组cDNA为模板扩增得到上、下游分别加有EcoR I和Xho I酶切位点的ACSL3基因序列,片段总长度为2 100 bp。按Gel Extraction Kit说明书进行ACSL3基因片段扩增产物的回收,将ACSL3与pCDNA3.1(+)-Flag质粒用EcoR I和Xho I双酶切,分别回收纯化,将两者酶切纯化的产物按照8∶1的摩尔比混合,用TaKaRa DNA Ligation Kit Ver 2.0试剂盒连接1 h,转化DH5α感受态细菌,然后涂布于含氨苄青霉素50 mg/L的LB固体培养基中。次日,随机挑取10个单菌落,分别接种于3 mL含氨苄青霉素的LB培养液中,37℃、150 r/min振荡培养过夜。将菌落PCR筛选呈阳性的菌落用质粒DNA小量提取试剂盒抽提质粒DNA。将提取的质粒DNA用EcoR I和Xho I双酶切,进行电泳检测,以DS5000 marker为分子量参照,将筛选出的阳性克隆产物的菌液进行测序鉴定,获得pCDNA3.1(+)-Flag-ACSL3重组质粒,-20℃冻存备用。以同样方法构建pLenti-GFP-Neo-ACSL3质粒。
2.3 ACSL3慢病毒包装构建慢病毒载体系统为四质粒系统,包括pRsv-REV、pMDlg-pRRE、pMD2G以及Lenti-ACSL3。慢病毒包装细胞转染用胰蛋白酶消化对数生长期的293T细胞,细胞密度为0.5× 109/L时重新接种于25 mL的15 cm细胞培养皿,37℃、5%CO2培养箱内培养;pRsv-REV(10 μg)、pMDlg-pRRE(15 μg)、pMD2G(7.5 μg)和pLenti-GFP-Neo-ACSL3(20 μg)加入无菌水及CaCl2(2.5 mol/L)溶液中;当细胞密度达60%~70%时转染,将DNA和磷酸钙混合液转移至含单层细胞的培养液中,培养12 h后弃去含有转染混和物的培养液,加入胎牛血清继续培养48 h;收集转染72 h的293T细胞上清液,离心后收集上清液,将病毒上清液以0.45 μm滤器过滤;把病毒粗提液样品过滤离心,获得病毒浓缩液,分装后保存在病毒管中,-80℃长期保存。在进行病毒生物学滴度测定后获得Lenti-ACSL3慢病毒。
2.4 ACSL3稳定表达PCa细胞株的构建PC-3细胞培养于6孔板中,当细胞长到80%~90%的汇合度时进行转染实验,转染96 h后,倒置荧光显微镜下观察到荧光证实慢病毒转染成功,待细胞生长状态良好,取转染效率最高的PC-3细胞株加入含G418(500 mg/L)的培养基中培养3周,获得稳定表达ACSL3的雄激素非依赖性转移性PCa细胞PC-3ACSL3+。相同方法构建雄激素依赖性转移性PCa细胞LNCaPACSL3+和雄激素依赖性局限性PCa细胞22Rv1ACSL3+。
2.5 RT-PCR及Western blotting检测转染PCa细胞中ACSL3的表达pCDNA3.1(+)-Flag-ACSL3转染PC-3细胞24 h后,Trizol抽提RNA,并以RNA为模板进行逆转录反应获得cDNA,再以其为模板,ACSL3特异性荧光定量引物进行RT-PCR定量检测ACSL3 mRNA表达。pCDNA3.1(+)-Flag-ACSL3转染PC-3细胞48 h后,加入100 μL含蛋白酶抑制剂的细胞裂解液,用细胞刮刮下细胞,离心制备蛋白样品,利用Western blotting检测ACSL3蛋白表达。
2.6 Transwell侵袭小室实验检测ACSL3过表达对PCa细胞侵袭力的影响实验分为pCDNA3.1(+)-Flag空白质粒转染对照组和pCDNA3.1(+)-Flag-ACSL3重组质粒转染实验组。Transwell每孔上室加入100 μL Matrigel,37℃培养箱孵育3 h。紫外照射灭菌过夜。下室中加入趋化液、细胞无血清培养上清后,铺胶上室套入下室。细胞转染24 h后,分别加入对照组和实验组细胞悬液各200 μL,37℃培养箱孵育20 h。取出上室,吸去残液和Matrigel胶。在上室中添加70%甲醇固定30 min,常规结晶紫染色,光镜下观察。随机取3个高倍镜视野,计数小室面细胞数即为穿透Matrigel细胞数,实验重复3次,取均数作为结果。
3 统计学处理
用SPSS 13.0 for Windows统计软件进行分析。计量资料以均数±标准差(mean±SD)表示,采用t检验;计数资料采用χ2检验。以P<0.05为差异有统计学意义。
结果
1 RT-PCR实验结果
以前列腺正常上皮细胞RWPE-I、PCa细胞LNCaP、22Rv1和PC-3的cDNA为模板,进行实时定量PCR反应,并以前列腺正常上皮细胞RWPE-I内ACSL3 mRNA的表达水平为参考,比较分析PCa不同细胞与RWPE-I中ACSL3 mRNA的表达水平的差异。结果表明,较RWPE-I细胞,各种PCa细胞中ACSL3 mRNA表达明显下降(P<0.05)。同时,局限性PCa细胞22Rv1中ACLS3 mRNA表达较转移性PCa细胞PC-3升高(P<0.05)。此外,本研究还发现雄激素非依赖性PCa细胞PC-3比雄激素依赖性PCa细胞LNCaP及22Rv1中ACLS3 mRNA的表达显著降低(P<0.05)。因此,我们认为ACSL3的表达水平与PCa的发生、进展转移,以及与PCa细胞从雄激素依赖向雄激素非依赖演变具有一定的关联性,见图1。
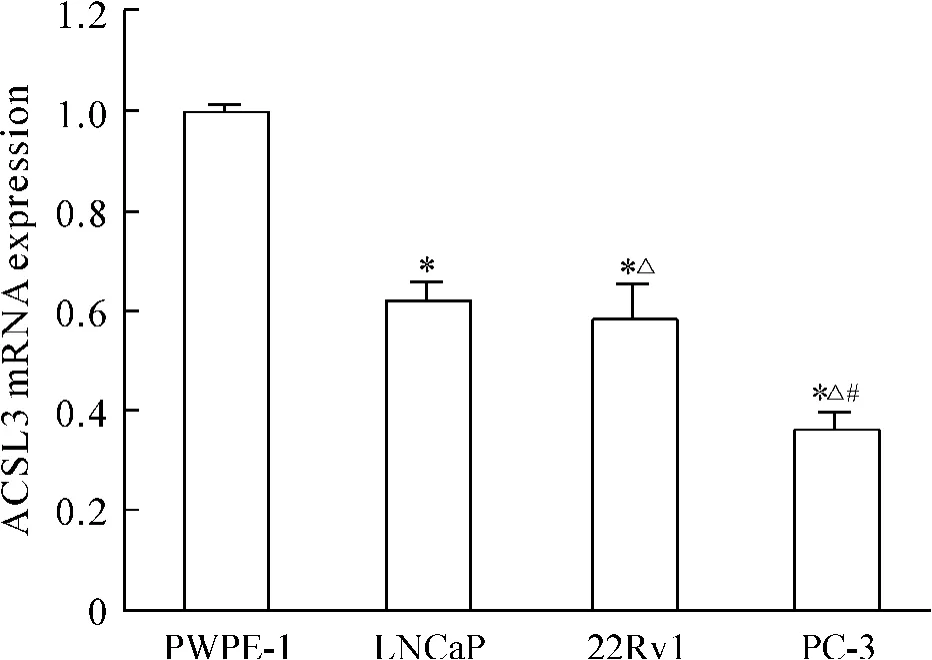
Figure 1.ACSL3 mRNA expression in RWPE-I,LNCaP,22Rv1 and PC-3 cells.Mean±SD.n=3.*P<0.05 vs RWPE-I;△P<0.05 vs LNCaP;#P<0.05 vs 22Rv1.图1 前列腺正常上皮细胞及各种PCa细胞中ACSL3 mRNA的表达
2 pCDNA3.1(+)-Flag-ACSL3重组质粒的构建及鉴定
以PC-3细胞基因组cDNA为模板扩增ACSL3基因,1%的琼脂糖凝胶电泳显示PCR产物大小分别为2 100 bp左右,与预期ACSL3基因片段大小相符,见图2A;重组质粒菌落PCR鉴定,得到1条2 100 bp的条带,与预期ACSL3基因片段大小相符,见图2B;菌落PCR鉴定为阳性的菌株重新摇菌,抽提质粒后经EcoRⅠ和XhoⅠ双酶切鉴定,得到1条2 100 bp 和5.4 Kb的条带,都与预计大小相符,见图2C。以上结果初步证明成功构建了pCDNA3.1(+)-Flag-ACSL3重组真核表达质粒。
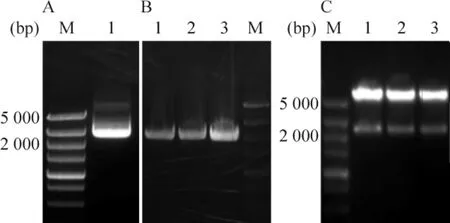
Figure 2.Construction and identification of eukaryotic expression plasmid pCDNA3.1(+)-Flag-ACSL3.A:ACSL3 gene amplified fragment;B:colony PCR of ACSL3 gene;C:ACSL3-plasmids digested by EcoRⅠand XhoⅠ;M:DS5000 marker.图2 pCDNA3.1(+)-Flag-ACSL3重组质粒的构建及鉴定
3 RT-PCR及Western blotting鉴定ACSL3 mRNA和蛋白在细胞内的表达
重组真核表达质粒pCDNA3.1(+)-Flag-ACSL3转染PC-3细胞后,利用ACSL3特异性荧光定量引物进行RT-PCR定量检测mRNA表达,证实较对照组,ACSL3 mRNA水平明显升高(P<0.01),见图3A。同时,利用Flag标签单克隆抗体进行Western blotting检测Flag-ACSL3蛋白表达,结果表明转染组蛋白水平比对照组显著增加(P<0.01),见图3B。上述结果证明pCDNA3.1(+)-Flag-ACSL3重组真核表达质粒在PCa细胞内可以有效过表达ACSL3。
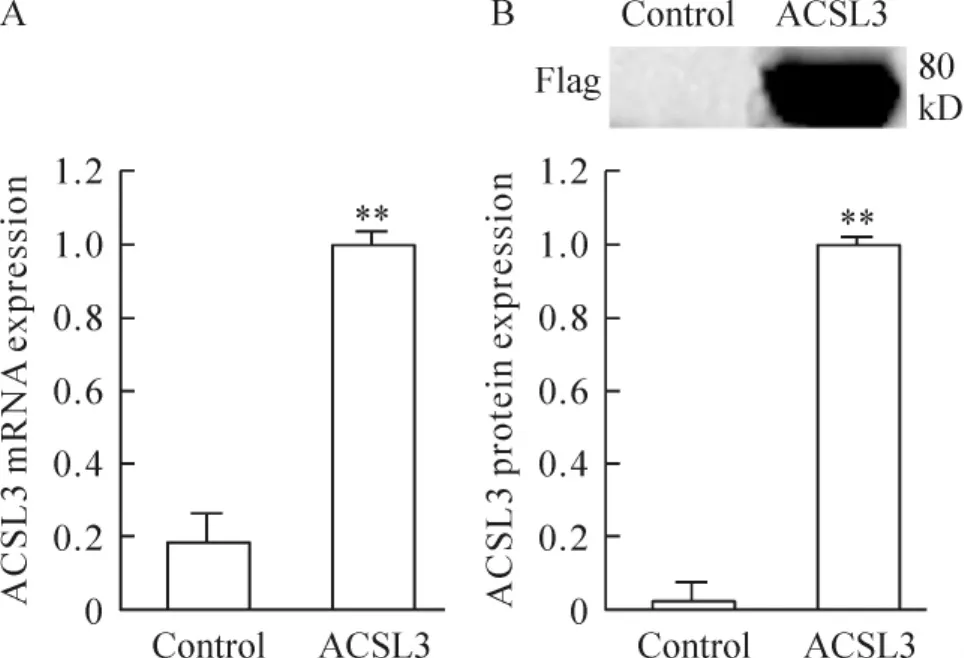
Figure 3.ACSL3 mRNA(A)and protein(B)expression in PC-3 cells after transfected with pCDNA3.1(+)-Flag-ACSL3.Mean±SD.n=3.**P<0.01 vs control.图3 pCDNA3.1(+)-Flag-ACSL3转染PC-3细胞后的ACSL3 mRNA和蛋白表达
4 ACSL3稳定表达PCa细胞株的构建
PCa细胞培养于6孔板中,慢病毒Lenti-ACSL3转染细胞96 h后,取转染效率最高的PC-3细胞株加入含G418(500 mg/L)的培基中培养3周,从而获得ACSL3稳定表达的雄激素非依赖性转移性PCa细胞PC-3ACSL3+、雄激素依赖性转移性PCa细胞LNCaPACSL3+和雄激素依赖性局限性PCa细胞22Rv1ACSL3+,见图4。
5 重组质粒转染对细胞迁移能力的影响
LNCaP细胞转染pCDNA3.1(+)-Flag-ACSL3质粒24 h后,侵袭能力较pCDNA3.1(+)-Flag空白质粒转染组明显下降,对照组和转染组穿膜细胞数分别为45±8.85和23±7.62,差异具有统计学意义(P<0.01),提示ACSL3表达与PCa细胞的侵袭能力呈现明显的负相关,见图5。
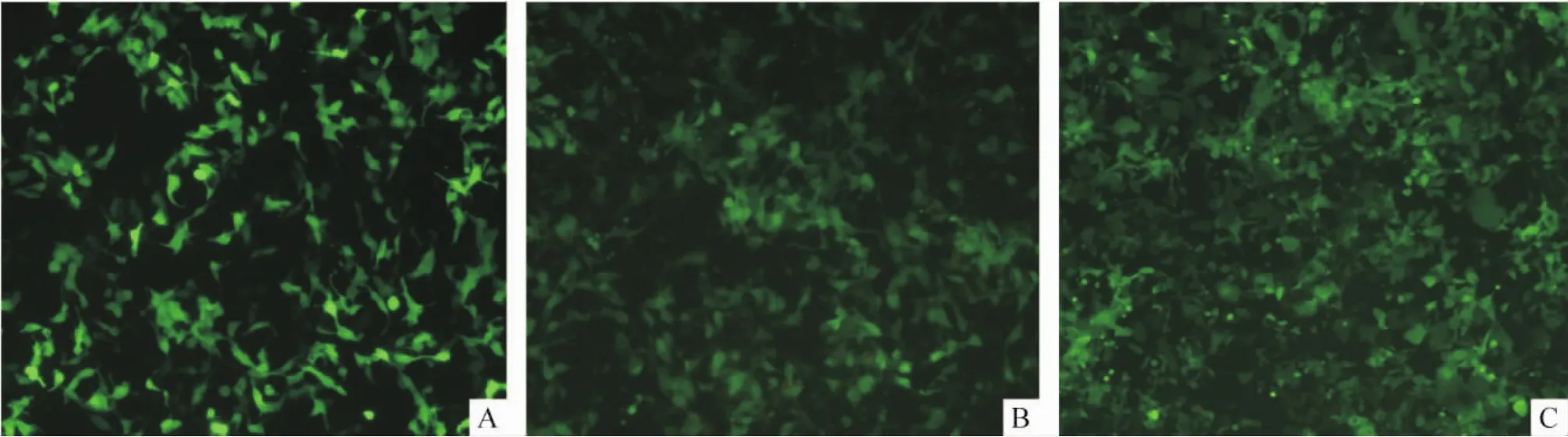
Figure 4.Representative images of PCa cells which stably expressed ACSL3 gene(×60).A:PC-3ACSL3+;B:LNCaPACSL3+;C: 22Rv1ACSL3+.图4 荧光倒置显微镜下观察ACSL3稳定表达的PCa细胞株
讨论
肿瘤的转移和复发是肿瘤患者死亡的主要原因。尽管随着分子生物学的发展,认识到肿瘤相关基因的过表达和沉默在肿瘤的进展和转移中起着重要作用,但目前所发现的转移相关基因的数量仍较少,且对其具体的调控机制依旧缺乏深入的研究,从而限制了相关基因在临床诊断和治疗中的应用。因此,发现更多新的肿瘤转移相关基因,阐明其调控肿瘤转移的分子机制,对研发新型诊疗方法,提高患者的生存率和生活质量具有决定性意义。
PCa作为最常见多发的男性恶性肿瘤之一,其早期症状并不明显。虽然随着临床诊断技术的发展,PCa早期诊断率有所提高,但多数患者确诊时常已处于较晚的进展期[8],而90%的进展期PCa都已发生转移[9]。同时,由于PCa生物学习性多变,其侵袭转移是患者死亡的主要原因。每年因肿瘤转移而导致死亡的比例占总死亡病例的70%。此外,常规的PCa去势治疗,在一段时间后PCa逐渐由激素依赖性转变为激素非依赖性,使得治疗变得更加困难,而这其中AR扮演着重要的角色;在ADPC向AIPC的转变过程中,AR通路通过多种方式发挥作用,AR基因的扩增、突变以及与共激活子之间作用的改变都可能使PCa细胞获得激素非依赖型的生养能力,因此,阐明AR信号通路在PCa中的作用对PCa的诊断和治疗有着重大意义[10]。
国外新近报道发现ACSL3是AR信号通路的相关调节蛋白,其作为长链脂酰辅酶A合成酶家族的成员,主要表达于前列腺、骨骼肌、睾丸、心脏和胎盘等组织中,在细胞内的主要生理功能是调节细胞内脂质代谢,催化长链脂肪酸激活的第一步,在细胞内可以作用于脂质的合成或者蛋白质修饰。细胞膜脂质的组成和新陈代谢调节的改变与许多疾病有关,包括癌症。研究表明长时间抑制ACSL3表达会对细胞产生毒性[11];在鼠的肝细胞中,通过RNA干扰抑制ACSL3基因的表达,导致很多与脂肪生成相关转录因子活性的降低,如过氧化物酶体增殖激活受体γ、糖类反映元素结合蛋白、固醇调节元素结合蛋白1C、肝受体α和它们目标基因的表达。另外,脂酰辅酶A合成酶的活性还可以改变AMPK活性,调节多种转录因子进而调节相关基因的表达[12]。此外,细胞内脂滴(lipid droplets,LDs)作为中性脂的储存场所,在人肝细胞HuH7中ACSL3是LDs的主要连接蛋白、LDs包含各种各样的蛋白、如PAT家族蛋白,小窝蛋白(caveolins)和Rab家族蛋白,而这些蛋白均为癌症相关蛋白,表明ACSL3也可能与癌症有关[13-15]。
本研究选择ACSL3作为研究对象,初步证实了较前列腺正常上皮细胞,各种PCa细胞中ACSL3 mRNA表达明显下降;而转移性PCa细胞中ACSL3的表达较局限性PCa细胞更低。与此同时,AIPC细胞中ACSL3表达比ADPC中也要显著减少。由此我们推断,ACSL3的表达水平可能与PCa的发生、进展转移,以及与PCa细胞从雄激素依赖向雄激素非依赖演变具有一定的关联性;从而为PCa的早期诊断和预后评判提供了新的标志物,同时为PCa的治疗提供了潜在的干预靶点。此外,本研究通过分子克隆方法,将目的片段ACSL3基因插入到含有Flag标签的真核表达载体pCDNA1.3(+)质粒上,并包装了慢病毒,然后对重组质粒的转染效果进行了检测,继而构建了稳定表达ACSL3的PCa细胞株,继而通过Matrigel侵袭实验证实ACSL3表达与PCa细胞的侵袭能力呈负相关,这一切工作都为后续研究ACSL3在PCa的发生、进展中的生物学功能,以及其在AR受体信号通路中的分子调控机制奠定了基础。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[2]Peyromaure M,Debré B,Mao K,et al.Management of prostate cancer in China:a multicenter report of 6 institutions[J].J Urol,2005,174(5):1794-1797.
[3]Preston SH.Prostate-cancer screening[J].N Engl J Med,2009,361(2):202-203.
[4]方习武,夏术阶,唐孝达.雄激素受体在人类前列腺癌发展中的作用研究[J].中国病理生理杂志,2004,20(7):1275-1279.
[5]Marques RB,Dits NF,Erkens-Schulze S,et al.Modulation of androgen receptor signaling in hormonal therapy-resistant prostate cancer cell lines[J].PLoS One,2011,6 (8):e23144.
[6]Attard G,Glark J,Ambroisine L,et al.Heterogeneity and clinical significance of ETV1 translocations in human prostate cancer[J].Br J Cancer,2008,99(2):314-320.
[7]Nchoutmboube JA,Viktorova EG,Scott AJ,et al.Increased long chain acyl-CoA synthetase activity and fatty acid import is linked to membrane synthesis for development of picornavirus replication organelles[J].PLoS Pathog,2013,9(6):e1003401.
[8]Stamey TA,Caldwell M,McNeal JE,et al.The prostate specific antigen era in the United States is over for prostate cancer:what happened in the last 20 years?[J].J Urol,2004,172(4 Pt 1):1297-1301.
[9]Bubendorf L,Schöpfer A,Wagner U,et al.Metastatic patterns of prostate cancer:an autopsy study of 1,589 patients[J].Hum Pathol,2000,31(5):578-583.
[10]王钢,王晓慧,张金山,等.雄激素受体基因(CAG) n重复多态性与前列腺癌[J].中国病理生理杂志,2000,16(10):1076.
[11]Yao H,Ye J.Long chain acyl-CoA synthetase 3-mediated phosphatidylcholine synthesis is required for assembly of very low density lipoproteins in human hepatoma Huh7 cells[J].J Biol Chem,2008,283(2):849-854.
[12]Bu SY,Mashek MT,Mashek DG.Suppression of long chain acyl-CoA synthetase 3 decreases hepatic de novo fatty acid synthesis through decreased transcriptional activity [J].J Biol Chem,2009,284(44):30474-30483.
[13]Cao A,Li H,Zhou Y,et al.Long chain acyl-CoA synthetase-3 is a molecular target for peroxisome proliferatoractivated receptor delta in HepG2 hepatoma cells[J].J Biol Chem,2010,285(22):16664-16674.
[14]Mashek DG,Li LO,Coleman RA.Rat long-chain acyl-CoA synthetase mRNA,protein,and activity vary in tissue distribution and in response to diet[J].J Lipid Res,2006,47(9):2004-2010.
[15]Fujimoto Y,Itabe H,Kinoshita T,et al.Involvement of ACSL in local synthesis of neutral lipids in cytoplasmic lipid droplets in human hepatocyte HuH7[J].Lipid Res,2007,48(6):1280-1292.
Role of ACSL3 expression in suppressing prostate cancer cell metastasis
LI Ke1,CHEN Yi2,DONG Yan3,YE Zhi-qiang4
(1Department of Urology,4Department of Emergency,The Third Affiliated Hospital of Sun Yat-sen University,Guangzhou 510630,China;2Department of Breast Surgery,Sun Yat-sen Memorial Hospital of Sun Yat-sen University,Guangzhou 510120,China;3Department of Biotechnology,School of Life Science and Technology,Jinan University,Guangzhou 510632,China.E-mail:zqye@163.com)
AIM:To analyze the difference of long-chain acyl-CoA synthetase 3(ACSL3)expression between normal prostate epithelial cells and prostate cancer cells.METHODS:ACLS3 mRNA expression between normal prostate epithelial cells and prostate cancer cells was compared using RT-PCR.Meanwhile,ACSL3 gene was amplified from prostate cancer cells,and the eukaryotic expression plasmid pCDNA3.1(+)-Flag-ACLS3 and lentivirus Lenti-ACLS3 were constructed.After transfection of ACSL3-plasmid and lentivirus into the prostate cancer cells,ACSL3 expressive was detected by RT-PCR and Western blotting,and then Matrigel invasion assay was performed to investigate the alteration of the invasive ability of the prostate cancer cells with over-expression of ACSL3.RESULTS:A significant difference of ACSL3 mRNA level between normal prostate epithelial cells and prostate cancer cells was observed.ACSL3 was highly expressed in localized prostate cancer cells compared to metastatic prostate cancer cells,while ACSL3 expression was higher in androgendependent prostate cancer cells than that in androgen-independent prostate cancer cells.Furthermore,the eukaryotic expression plasmid and lentivirus containing ACLS3 gene were successfully constructed.The prostate cancer cell line whichstably over-expressed ACLS3 was established.Up-regulation of ACSL3 inhibited the invasive ability of prostate cancer cells.CONCLUSION:ACSL3 plays an antagonistic role in invasiveness of prostate cancer.
Prostate neoplasms;Long-chain acyl-CoA synthetase 3;Neoplasm invasiveness
R363
A
10.3969/j.issn.1000-4718.2014.02.010
1000-4718(2014)02-0250-06
2013-09-29
2013-11-04
广东省科技计划(No.2011B061300011)
△通讯作者Tel:020-85253010;E-mail:zqye@163.com

