细胞松弛素D对大鼠脊髓星形胶质细胞水通道蛋白和内向整流性钾通道4.1基因表达的影响①
杜文佳,汪玉良,党跃修,雷栓虎,黄良增,汪静,马靖琳,安丽萍
细胞松弛素D对大鼠脊髓星形胶质细胞水通道蛋白和内向整流性钾通道4.1基因表达的影响①
杜文佳,汪玉良,党跃修,雷栓虎,黄良增,汪静,马靖琳,安丽萍
目的探讨不同浓度细胞松弛素D(CytD)对大鼠脊髓星形胶质细胞骨架重构,水通道蛋白(AQP)1、AQP4及内向整流性钾通道4.1(Kir4.1)基因表达的影响。方法原代培养大鼠脊髓星形胶质细胞,加CytD 0.05 μg/ml、0.10 μg/ml、0.20 μg/ml、0.40 μg/ml、0.80 μg/ml和1.00 μg/ml共培养2 h、12 h和24 h。MTT法检测细胞增殖情况;鬼笔环肽联合Hoechst 33342套染后激光共聚焦显微镜下观察共培养2 h后细胞骨架重构情况;RT-PCR法检测共培养2 h时AQP1、AQP4和Kir4.1 mRNA表达水平。结果细胞生存率随CytD浓度升高和作用时间延长而减少。CytD使大鼠脊髓星形胶质细胞微丝发生解聚、弯曲,但极性未失。CytD 0.05 μg/ml、0.10 μg/ml、0.20 μg/ml和0.40 μg/ml上调AQP1、AQP4和Kir4.1 mRNA表达。结论适当浓度CytD可以重建星形胶质细胞骨架,上调大鼠脊髓星形胶质细胞AQP1、AQP4和Kir4.1基因表达。
星形胶质细胞;细胞松弛素;细胞骨架;水通道蛋白;内向整流性钾通道;脊髓;大鼠
[本文著录格式] 杜文佳,汪玉良,党跃修,等.细胞松弛素D对大鼠脊髓星形胶质细胞水通道蛋白和内向整流性钾通道4.1基因表达的影响基因表达的影响[J].中国康复理论与实践,2014,20(7):616-620.
星形胶质细胞在中枢神经系统中具有免疫调节、维持神经元微环境相对稳定和调节突触信号传递等作用[1-4]。中枢神经系统损伤后,胶质细胞产生应激反应,发生水肿,导致细胞骨架重构,进而影响细胞物质运输、基因表达和信号传递等生命过程。水通道蛋白(aquaporin,AQPs)是星形胶质细胞中一组参与跨细胞水转运的膜通道蛋白,它们不仅在维持颅内渗透压及水电解质平衡中发挥着重要作用,同时也参与脑缺血、脑肿瘤和颅内感染等诱发的脑水肿病理过程。本研究采用细胞松弛素D(cytochalasin D,CytD)对体外培养大鼠脊髓星形胶质细胞重构其细胞骨架系统,研究不同浓度CytD作用下,星形胶质细胞形态学、微丝系统的改变及AQP1、AQP4和内向整流性钾通道4.1(inward rectifying potassium channel 4.1,Kir4.1)基因表达的变化。
1 材料和方法
1.1 实验动物
SPF级新生2~3 d Sprague-Dawley大鼠,由甘肃中医学院动物实验中心提供(动物质量合格证号:SCXK甘2004-0006-152)。
1.2 主要仪器与试剂
DMEM/F12培养液、胎牛血清(fetal bovine serum,FBS)和胰蛋白酶:GIBCO公司。青霉素、链霉素:华北制药股份有限公司。阿糖胞苷:上海华联制药有限公司。CytD、多聚赖氨酸和Triton X-100:SIGMA公司。胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)兔多克隆抗体:PROTEINTECH GROUP公司。羊抗兔IgG-FITC:北京中杉公司。Trizol、逆转录试剂盒、RT-PCR试剂盒:INVITROGEN公司。激光共聚焦显微镜:OLYMPUS公司。实时定量PCR仪:BIORAD公司。二氧化碳培养箱:SANYO公司。
1.3 星形胶质细胞的培养
新生Sprague-Dawley大鼠10只,75%酒精浸泡5 min后移至超净工作台,无菌条件下分离脊髓组织;DMEM培养液清洗1次,加入0.25%胰蛋白酶,37℃消化15 min,完全培养液终止消化。反复吹打后,1500 r/min离心10 min,弃上清。200目筛网过滤后加入DMEM-F12培养基(含10%FBS),加入完全培养基,重悬细胞,将其接种至25 cm2培养瓶中,差速贴壁。将细胞转移至5%CO2培养箱中,37℃培养48 h后换液。以后每隔3 d换液1次,待细胞融合成单层并铺满瓶底后,传代培养。
1.4 星形胶质细胞的鉴定
取P2代细胞,以每孔3×103个细胞接种于96孔板,培养12 h。弃培养液,PBS清洗2次,加预冷甲醛200 μl,37℃固定20 min;PBS清洗3次,加入PBS-T 200 μl,4℃10 min后移除PBS-T,PBS清洗5 min;加入PBS-B 200 μl,37℃30 min。加入GFAP一抗100 μl,4℃过夜,PBS清洗5 min;加羊抗兔FITC标记二抗150 μl,37℃ 1 h;PBS洗3次,每次5 min。封片,倒置相差显微镜下观察并拍照,荧光显微镜下检测GFAP表达并拍照。
1.5 MTT检测
P2代星形胶质细胞以3×103/ml接种于96孔板。培养24 h后,分别换入含CytD 0.05 μg/ml、0.10 μg/ml、0.20 μg/ml、0.40 μg/ml、0.80 μg/ml、1.00 μg/ml完全培养液,空白对照组正常换液。培养2 h、12 h和24 h后弃去上清液,每孔加入无血清DMEM/ F12培养液100µl、0.5%MTT 10µl、DMSO 100µl,振荡10 min,酶标仪570 nm波长检测吸光度(OD)。
1.6 激光共聚焦显微观察
P2代星形胶质细胞以每孔5×105接种于24孔板内进行细胞爬片,分别换含CytD 0.05 μg/ml、0.10 μg/ml、0.20 μg/ml、0.40 μg/ml、0.8 μg/ml的完全培养基,空白对照孔正常换液。继续培养2 h后弃培养液,PBS清洗3次,每孔加入4%多聚甲醛1 ml,室温固定20 min。10 μg/ml鬼笔环肽37℃染色1 h,PBS洗3次,每次5 min;加入10 μg/ml Hoechst 33342室温染色15 min,PBS洗3次。抗荧光淬灭封片剂封片,倒置相差显微镜下观察细胞形态,激光共聚焦显微镜下观察,拍照。
1.7 RT-PCR
按照Trizol说明书提取空白对照组以及各浓度CytD培养2 h后星形胶质细胞总RNA,A260、A280检测提取纯度及浓度,1%变性琼脂糖凝胶电泳检测其完整性。取1 μg总RNA为模板,以寡核苷酸(Oligo dT)为引物,按逆转录试剂盒说明书进行操作,所得cDNA-20℃保存。逆转录反应结束后,用RT-PCR试剂盒进行扩增与定量反应,引物序列见表1,反应体系50 μl,扩增条件为50℃ 2 min,95℃预变性2 min后,95℃ 15 s、61.2℃ 35 s,共45个循环,每次延伸结束后读板,采用2-ΔΔCt法对基因表达进行定量分析,所有实验重复3次。

表1 引物序列表
1.8 统计学分析
2 结果
2.1 星形胶质细胞的培养及鉴定
P2细胞GFAP阳性率>95%。倒置相差显微镜观察:GFAP阳性细胞胞体较大,有短而粗大的突起,形态不规则,轮廓较清晰(图1)。
2.2 MTT
培养2 h后,与空白对照组比较,CytD各浓度组细胞的存活率均有所下降,且0.80 μg/ml和1.00 μg/ml组有显著性差异(P<0.05);培养12 h、24 h后,CytD各浓度组细胞存活率进一步下降,与空白对照组均存在显著性差异(P<0.05)。见表2。
2.3 细胞骨架
倒置相差显微镜下观察,空白对照组细胞胞体较大,呈星形或多角形,胞突较多较长,胞核圆形或椭圆形,常偏于胞体一侧。CytD各浓度组细胞体积增大,形状不规则,胞突数量增多,细胞间紧密连接变少,胞核区域不明显。见图2。
激光共聚焦显微观察,空白对照组细胞微丝骨架排布呈明显极性,分布均匀,微丝笔直;Cyt D可使星形胶质细胞微丝骨架发生解聚并弯曲,呈片状,但未丧失排布极性。见图3。
2.4 RT-PCR
与空白对照组比较,Cyt D 0.05 μg/ml、0.10 μg/ ml、0.20 μg/ml和0.40 μg/ml浓度组AQP1表达量上调(P<0.05),各浓度组间比较也均有显著性差异(P<0.05);AQP4表达上调(P<0.05),各浓度组间比较也均有显著性差异(P<0.05);Kir4.1表达上调(P<0.05),各浓度组间比较也均有显著性差异(P<0.05)。见表3。
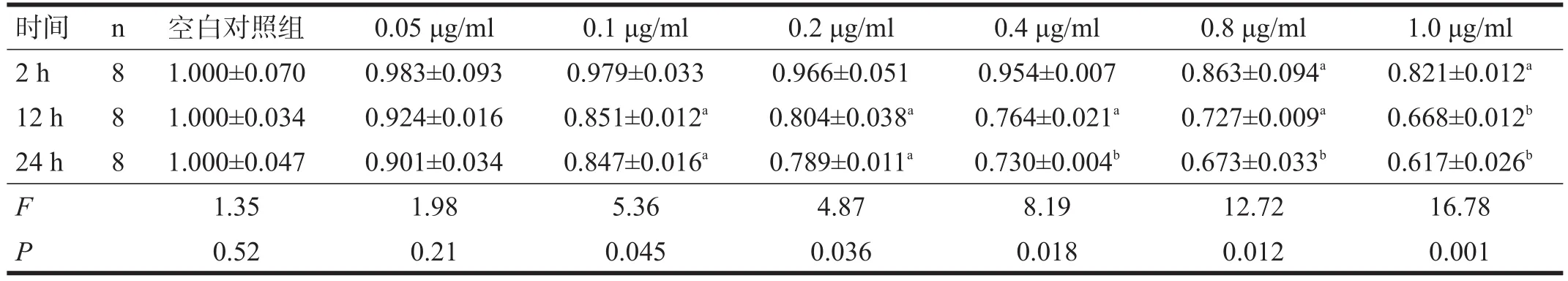
表2 各组细胞生存率比较
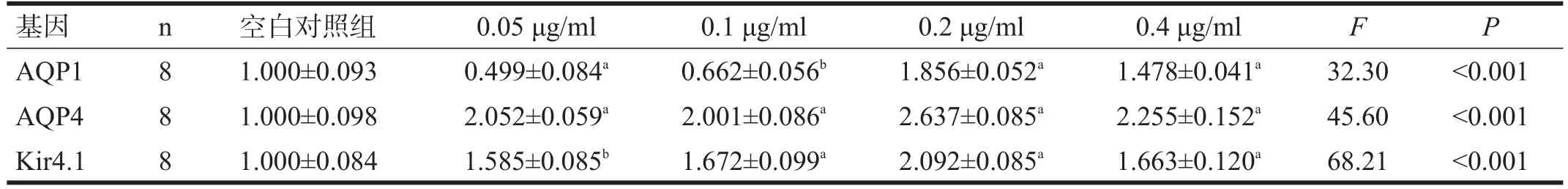
表3 各组细胞AQP1、AQP4和Kir4.1表达比较

图1 细胞培养与鉴定(100×)
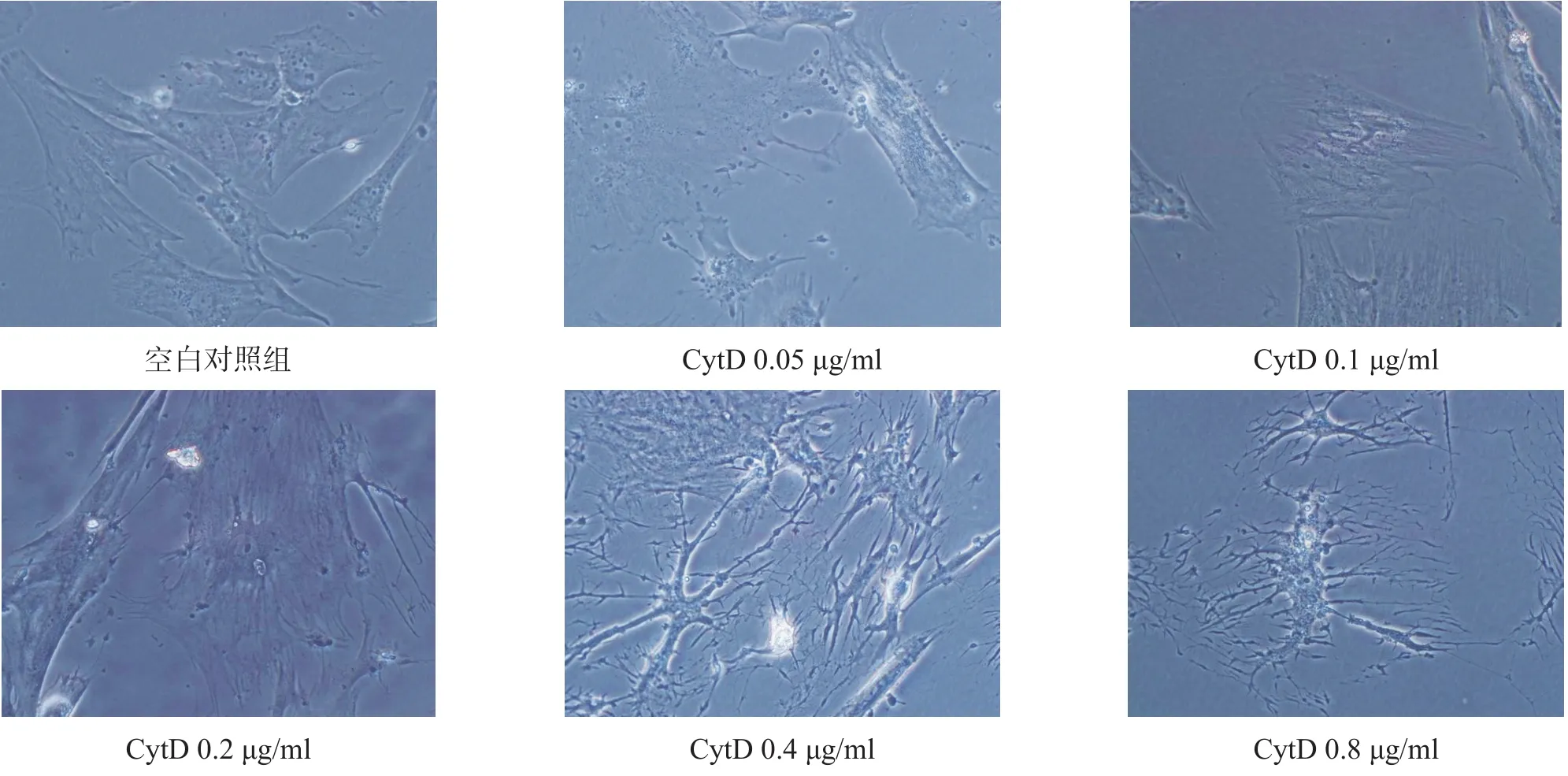
图2 各组细胞培养2 h形态(倒置相差显微镜,400×)

图3 各组细胞培养2 h形态(激光共聚焦显微镜,400×)
3 讨论
细胞骨架是真核细胞中的蛋白网架系统[7]。广义的细胞骨架包括细胞核骨架、细胞质骨架、细胞膜骨架和细胞外基质,形成贯穿于细胞核和细胞质的网架体系[8];通常所称的狭义细胞骨架是指细胞质骨架,由微丝、微管和中间纤维构成[9]。细胞骨架能维持细胞的正常形态,但并非静止的支架系统,而是一个组装与去组装动态平衡的网络,并发挥着多种生物学功能[10]。
CytD是公认的能够破坏细胞微丝的药物[11]。我们采用CytD对大鼠脊髓星形胶质细胞的微丝系统进行干预。我们的研究证实,CytD对星形胶质细胞体外增殖有一定抑制作用,但0.05~0.40 μg/ml浓度共培养2 h,细胞生存率>90%,与空白对照组无显著性差异。
相差显微镜及激光共聚焦显微镜观察,CytD可使星形胶质细胞体积增大,伪足增长,胞突数量增多,细胞间紧密连接丧失;细胞骨架解聚。已有研究报道,星形胶质细胞紧密连接的破坏,可能与临床脑外伤后血脑屏障破坏产生广泛的脑水肿有关[12]。我们推测,星形胶质细胞水肿可能与细胞骨架解聚存在着一定关系。
在中枢神经系统中分布着几种AQPs,其中研究较多的有AQP1、AQP4和AQP9。有研究显示,AQP1和AQP4是中枢神经系统最主要的AQPs,与脑脊液的形成存在密切联系;由于分布位置的特殊性,AQP4在脑水肿颅内水平衡调节上可能发挥着重要作用[13-15]。
AQP1和AQP4与脊髓损伤后水肿的形成也关系密切。有研究表明,星形胶质细胞膜上AQP4和Kir4.1在某些胶质细胞特殊膜域有密切的共同表达,推测AQP4介导的水分子转运可能与Kir4.1调节K+跨膜转运作用相偶联[16-17]。关于细胞骨架与膜蛋白之间的关系,目前研究较多的是细胞骨架与心肌快钠内流(INa)的关系。已有研究表明,细胞骨架的重构与心肌细胞膜蛋白功能存在密切联系[18]。星形胶质细胞与细胞骨架之间的关系鲜有报道。
本研究中RT-PCR结果显示,CytD可以上调AQP1、AQP 4和Kir4.1 mRNA的表达水平,推测星形胶质细胞骨架对与水肿相关的离子通道及膜蛋白具有调节作用,细胞骨架解聚可能导致细胞水肿发生。
本文通过CytD重构星形胶质细胞的细胞骨架,应用形态学及RT-PCR等方法检测星形胶质细胞水通道蛋白以及K+通道基因表达水平。结果提示,应用CytD后,星形胶质细胞骨架发生解聚,AQPs、Kir4.1表达水平上调;不同浓度CytD对AQPs、Kir4.1表达的调控可在2 h内实现,并存在量效关系。我们推测,微丝解聚可能会引起细胞水肿,其机制可能与上调水肿相关基因表达有关。这些为临床治疗脊髓损伤、脊髓水肿提供了基础实验资料。
为了进一步研究细胞骨架解聚与细胞水肿的关系,还需进一步进行体内实验。
[1]Nag S.Morphology and properties of astrocytes[J].Methods Mol Biol,2011,686:69-100.
[2]Figley CR,Stroman PW.The role(s)of astrocytes and astrocyte activity in neurometabolism,neurovascular coupling,and the production of functional neuroimaging signals[J].Eur J Neurosci,2011,33(4):577-588.
[3]Barker AJ,Ullian EM.Astrocytes and synaptic plasticity[J]. Neuroscientist,2010,16(1):40-50.
[4]魏开斌,卓锋,刘红,等.静脉移植人脐带间充质干细胞治疗急性脊髓损伤[J].中华实验外科杂志,2012,29(12):2579.
[5]Wang F,Feng XC,Li YM,et al.Aquaporins as potential drug targets[J].Acta harmacol Sin,2006,27(4):395-401.
[6]Janmey PA.The cytoskeleton and cell signaling:componentlocalization and mechanical coupling[J].Physiol Rev,1998,78 (3):763-781.
[7]Ochi M.Clinical results of transplantation of tissue-engineered cartilage and future direction of cartilage rep air-novel approach with minimally invasive procedure[J].Yonsei Med J, 2004,45(12):45-74.
[8]Redman SN,Oldfield SF,Archer CW,et al.Current strategies for articular cartilage repair[J].Eur Cell Mater,2005,14(9): 23-32.
[9]Buckwalter JA,Mow VC,Ratliff A.Restoration of injured or degenerated articular surfaces[J].J Am Acad Orthop Surg, 1994,2(4):192-201.
[10]Iwata H.Pharmacologic and clinical aspects of intra articular injection of hyaluronate[J].Clin Orthop Relat Res,1993,289 (4):285-291.
[11]王彦明,余家阔,于长隆,等.Pridie钻孔术修复膝关节软骨全层缺损的临床疗效观察[J].中国微创外科杂志,2006,6(11): 8612-8631.
[12]王克万,漆松涛,杨志焕,等.培养大鼠星形胶质细胞牵张损伤后超微结构的变化[J].第一军医大学学报,2002,22(8): 687-696.
[13]McConnell NA,Yunus RS,Gross SA,et al.Water permeability of an ovarian antral follicle is predominantly transcellular and mediated by aquaporins[J].Endocrinology,2002,143(8): 2905-2912.
[14]Gohara T,Ishida K,Nakakimura K,et al.Temporal profiles of aquaporin 4 expression and astrocyte response in the process of brain damage in fat embolism model in rats[J].J Anesth,2010, 24(2):225-233.
[15]Zeng HK,Wang QS,Deng YY,et al.Hypertonic saline ameliorates cerebral edema through downregulation of aquaporin-4 expression in the astrocytes[J].Neuroscience,2010,166(3): 878-885.
[16]Nagelhus EA,Horio Y,Inanobe A,et al.Irnrnunogold evidence suggests that coupling of K+siphoning and water transport in rat retinal Muller cells is mediated by a coenrichment of Kir4.1 and AQP4 in specific membrane domains[J].Glia, 1999,26(1):47-54.
[17]Nagelhus EA,Mathilsen TM,Ottersen OP.Aquaporin-4 in the central nervous system:cellular and subcellular distribution and coexpression with Kir4.1[J].Neuroseience,2004,129(4): 905-913.
[18]Berdiev BK,Prat AG,Cantiello HF,et al.Regulation of epithelial sodium channels by short actin filaments[J].Biol Chem,1997,271(30):17704-17710.
Effects of Cytochalasin D on Expression of Aquaporins and Inward Rectifying Potassium Channel 4.1 Gene in Spinal Cord Astrocytes of Rats
DU Wen-jia,WANG Yu-liang,DANG Yue-xiu,et al.Department of Orthopedics,The Second Hospital of Lanzhou University, Orthopaedics Key Laboratory of Gansu Province,Lanzhou,Gansu 730030,China
ObjectiveTo investigate the expression of aquaporin(AQP)1,AQP4,inward rectifying potassium channel 4.1(Kir4.1)and cytoskeleton features of rat spinal cord astrocytes after cytochalasin D(CytD)intervention.MethodsSpinal cord astrocytes isolated from 2~3-day-old rats were cultured till confluency.MTT was used to assess survival rate of astrocytes 2 h,12 h and 24 h after co-cultured with 0.05 μg/ml,0.10 μg/ml,0.20 μg/ml,0.40 μg/ml,0.80 μg/ml and 1.00 μg/ml of CytD,respectively.Confocal microscopy was used to observe cytoskeleton features of astrocytes 2 h after co-cultured with 0.05 μg/ml,0.10 μg/ml,0.20 μg/ml,0.40 μg/ml of CytD.The expression of AQP1, AQP4,Kir4.1 mRNA were determined with real-time PCR 2 h after co-cultured with 0.05 μg/ml,0.10 μg/ml,0.20 μg/ml,0.40 μg/ml,0.80 μg/ml and 1.00 μg/ml of CytD.ResultsThe survival rate of rat spinal cord astrocytes reduced with the time of co-culture and concentration of CytD(P<0.05).The cytoskeleton of astrocytes was reconstructed.The expression of AQP1,AQP4 and Kir4.1 mRNA increased after co-cultured with 0.05~0.40 μg/ml of CytD.ConclusionThe appropriate dosage of CytD may remodel the cytoskeleton and increase the mRNAexpression ofAQP1,AQP4 and Kir4.1 in spinal cord astrocytes of rats.
astrocyte;cytochalasin;cytoskeleton;aquaporin;inward rectifying potassium channel;spinal cord;rats
10.3969/j.issn.1006-9771.2014.07.003
R651.2
A
1006-9771(2014)07-0616-05
2013-10-22
2013-11-27)
1.甘肃省技术研究与开发专项计划项目(No.1004TCYA028);2.兰州大学第二医院2010年度院内科研项目(No.YJ2010-48)。
1.兰州大学第二医院骨科,甘肃兰州市730030;2.甘肃省骨关节病重点实验室,甘肃兰州市730030。作者简介:杜文佳(1980-),男,甘肃山丹县人,硕士研究生,主要研究方向:脊髓损伤与骨肿瘤。通讯作者:汪玉良,男,主任医师,硕士研究生导师。

