含锶放射性废水的处理方法研究进展
骆 欣
(华北科技学院 环境工程学院,北京东燕郊 101601)
1 放射性锶的来源及危害
自19世纪末发现X射线和镭元素以来,核科学技术一直在不断地发展成熟,已逐渐应用于军事、能源、工业、农业、医学及其他领域中。然而,在核技术的开发利用过程中,不可避免地产生放射性“三废”。其中,放射性废水所含的放射性总量相当大,因此迫切需要开发高效的放射性废水处理技术。
放射性锶(90Sr)是由于235U和239Pu发生核裂变产生的污染物,通常存在于核反应产生的废弃物中,是放射性废水中主要核素之一。90Sr为β射线辐射源,具有持续的放射性,半衰期长达28.9年[1]。β射线为带负电的电子流,可以引起皮肤的放射性损伤。放射性锶还可以经过呼吸、饮食等途径进入人体,发生内照射,破坏人体正常的生理机能,诱发病变。此外,锶与钙具有相似的生化性质,可以参与钙的代谢过程,容易进入人体的骨骼中,难以排出体外,引起骨癌、造血功能障碍等疾病[2]。由于高裂变产率和严重的危害性,90Sr一直被美国环境保护署认为是环境中最重要的放射性同位素[3]。为了保护人类的健康和生态环境,进行90Sr的去除是十分必要的。
2 水中放射性锶的处理方法
放射性核素用任何水处理方法都不能改变其固有的放射性衰变特性,其处理一般遵循的原则是将放射性废水浓缩处理后,将其浓缩产物与人类的生活环境长期隔离,任其自然衰减[4]。目前国内外出现的对放射性锶的浓缩处理方法有化学沉淀法、离子交换/吸附法、膜处理法和生物处理法等。
2.1 化学沉淀法
化学沉淀法主要是基于溶度积的原理,使放射性元素形成难溶盐,从液相中去除。表1列出了25℃时一些锶难溶盐的溶度积(Ksp)。
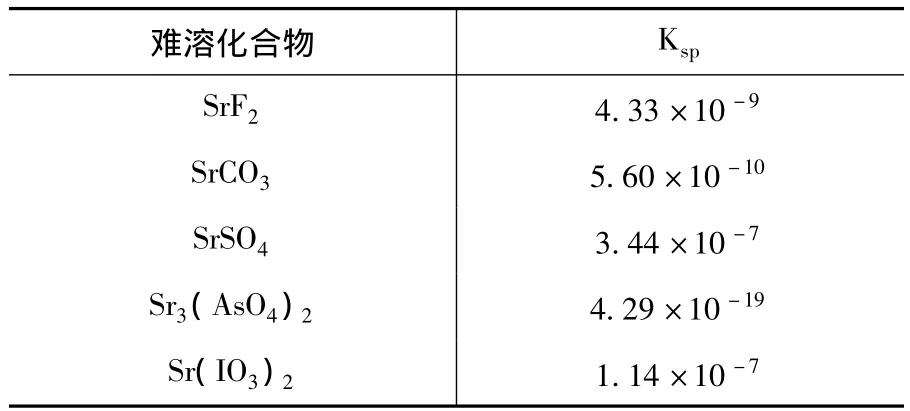
表1 锶难溶化合物的[5]Ksp
在放射性废水中,大多数核素的浓度极低,通常被视为痕量元素。因此,用于放射性废水处理的化学沉淀难以采用传统的沉淀法,通常是利用共沉淀的作用。通用的沉淀剂有磷酸盐、石灰、苏打、钡盐等。
Vokovich等[6]研究了磷酸盐沉淀法去除核燃料后处理产生的熔盐废物中的裂变元素。沉淀剂为磷酸锂和磷酸钠。在温度为750℃、NaCl与KCl等摩尔熔体的条件下,锶可以完全形成磷酸盐沉淀,去除率达到100%。Tan等[7]通过水热的方法生成羟磷灰石,同时实现锶的共沉淀。研究发现,初始pH值和Sr/(Sr+Ca)的摩尔比越高,残留的Sr2+浓度越低,锶的去除效率越高。最佳的条件是初始pH为12、Sr/(Sr+Ca)的摩尔比为0.2,此时出水的锶浓度为2.0 mg/L,锶的去除率为99.66%。该方法过程简单,产生的二次废物少。Pacary等[8]采用硫酸钡与锶共沉淀,建立了预测模型。试验温度为25℃,原水锶浓度为10 mg/L。结果表明,去污因数(DF)与停留时间是准线性关系,当停留时间为60 min时,DF可达300。在已知沉淀密度和晶体生长参数的条件下,所建立的模型能够很好地预测锶的去污效果。
随着研究的深入,沉淀剂也有所改进。Gäfvert等[9]研究了瑞典博尔门湖水中放射性核素的净化,采用的工艺是混凝-絮凝与砂滤相结合。混凝剂分别选用Al2(SO4)3和FeCl3,并且在砂滤过程中投加石灰。结果显示,锶的去除率为60% ~80%。Rout等[10]等利用聚丙烯酰胺(PAM)来强化磷酸钙和硫酸钡的除锶效果。长链聚合物通过吸附和卷扫等作用进一步去除溶液中的离子,锶的DF可提高3~5倍。与此同时,通过絮凝,沉降速率得到提高,出水浊度显著下降,最小值可达0.8 NTU。Hwang等[11]在处理含锶废水中发现加入聚丙烯酸(PAA)絮凝剂有助于提高锶的去除效果。当采用NTR7410膜、pH>7时,PAA可使锶的去除效率由40%左右提升至接近100%。
2.2 离子交换/吸附法
离子交换法是当废液通过离子交换剂时,呈离子状态的放射性核素交换到离子交换剂上,使废液得到净化。吸附法是用多孔性的固体吸附剂处理放射性废水,使其中所含的一种或数种元素吸附在吸附剂的表面上,从而达到去除的目的。目前,离子交换/吸附法已广泛应用于放射性废水的处理。
2.2.1 沸石类
许多研究者研究天然和合成沸石作为无机离子交换剂来处理放射性废物、固定放射性废物和回填。这些物质由结晶的水合铝矽酸盐构成,具有不易变形的三维结构,隧道和洞穴较发达。沸石的离子交换特征已被广泛关注,特别是用于放射性废水的处理。在中、低放废液中的阳离子核素可以与沸石的Na+交换而被去除。
Rahmana等[12]评估了合成沸石 NaA-X 对锶的吸附作用。在25℃、pH 7条件下,90 min可达到吸附平衡。Sr2+的分配系数(Kd)随溶液pH的增加而增加,当pH≥6时达到最大。其等温数据可以用Langmuir等温方程来描述。通过等温方程得出锶的最大吸附容量为307.38mg/g。在酸性水溶液中,沸石对阳离子吸附弱,源于低pH下,吸附剂的表面质子化而呈现更强的正电性或更弱的负电性。同时,酸性溶液中沸石组分可溶。
天然沸石成本较低,因而在水处理中具有吸引力。斜发沸石是天然沸石中数量最多的。通常认为斜发沸石去除90Sr是由于竞争性离子交换作用。Osmanlioglu等[13]考察了土耳其天然斜发沸石对放射性废液中几种主要核素的去除。当放射性废液中含高浓度非活跃盐时,沸石作为吸附剂没有明显效果。在不含K+条件下,当地的斜发沸石可以有效地去除锶。近年来,天然沸石的应用扩展到修复地下水污染。纽约州西部的西谷示范项目使用一种天然斜发沸石材料作为渗滤反应墙,可有效地去除地下水中90Sr,吸附等温线符合Langmuir等温方程,最大吸附容量为 1.692 mg/g[14]。
2.2.2 金属氧化物及其混合物
金属氧化物具有高的吸附能力、良好的热辐射和化学稳定性,并适合与多种固定基质结合。因此,金属氧化物的吸附是一种很有前景的处理放射性废液的方法。
Znan和Altas等制备了Mn-Zr混合的水合氧化物来去除锶,该混合物在酸性环境中对锶具有高捕获能力,可以用于处理酸性废液[15]。Tel等[16]研究了ZrO2和 TiO2-ZrO2凝胶微球吸附锶的影响因素。ZrO2和TiO2-ZrO2对锶的吸附均随pH值的升高而增加,随初始锶浓度的升高而降低。最佳条件为pH 9~10,进水锶浓度10~50 mg/L。通过Langmuir等温方程得出,在温度为30℃的条件下,ZrO2和 TiO2-ZrO2的最大吸附容量分别为10.52 mg/g和28.01 mg/g。TiO2-ZrO2制备简易,呈球状,易于柱应用。Gürboga 等[17]制备了TiO2-SiO2凝胶球用于吸附锶。当温度为23℃、TiO2比例60%、pH 10.6时,锶的去除率为84.6%。在前120 min吸附速率快,而后缓慢,直至240 min达到平衡,吸附等温线符合Freundlich模式。溶液中Ca2+和Mg2+的存在会抑制锶的吸附。
2.2.3 有机-无机混合离子交换剂
多数情况,无机离子交换剂会产生运行问题,如压力下降和过滤堵塞。因而,近年来开始研究制备和应用有机-无机混合离子交换剂来处理放射性废水。
Inan等[15]制备了Zr-MnO2/PAN混合球体。混合球体具有无定形结构,比表面积为215.50 m2/g。最佳去除锶的条件为pH 7.7、温度51.2℃、初始锶浓度20 mg/L、搅拌时间222 min,最大去除率接近90%。Parka等[18]研究了磷钼酸铵-聚丙烯氰(AMP-PAN)去除放射洗衣废水中钴、锶和铯。结果显示,其对锶的最大吸附能力是15.66 mg/g。Valsala 等[19]制备了水合 MnO2和PMMA混合物,粒径为3~5 mm,能够应用于柱运行,可有效地去除低放废水中的锶。当pH值为8时,最大去除效率为93%左右。
2.2.4 其他吸附剂
Mashkani等[20]将细绿萍的表面进行化学改性,提高生物吸附作用。对于低浓度的锶,改性后的吸附剂表现出良好的效果。最佳pH为9,接触30 min后基本可达到吸附平衡,没有解吸,最大吸附容量是212.1 mg/g。吸附后,可以利用HNO3来回收锶,并使吸附剂得到再生。再生后的吸附剂对锶的吸附率为92.8%。Ahmadpour等[21]研究了三种农业废弃物——杏壳、茄子壳、苔藓被处理后用于吸附水中锶离子。其中,杏壳较其他两种吸附剂,对锶具有更强的亲和力。当初始锶浓度分别为45 mg/L和102 mg/L时,其最佳投加量分别为0.2 g/L和0.3 g/L。接触3 min即可获得高的吸附效率,吸附等温线符合Langmuir等温式,最大吸附容量为116.3 mg/g。低成本的农业副产物可以成为有效的吸附剂来去除废液中的锶。
2.3 其他处理方法
膜技术具有出水水质好、物料无相变、低能耗等优点,已应用于放射性废水的处理。常用的膜技术主要有电渗析、反渗透、纳滤、超滤、微滤等。牟旭凤等[22]采用聚丙烯酸聚合物辅助纳滤技术处理模拟放射性废水,对Sr2+的去除率达到99%以上。Hwang等[11]采用絮凝-纳滤工艺净化废水中的锶,取得较高的除锶效果。同时,在膜表面PAA复合物的形成和吸附会造成膜污染,维持高pH环境有助于减缓膜污染。Rao等[23]将磷酸钙沉淀法与超滤相结合去除放射性废水中的锶。对于低浓度的溶液,经2 h沉淀后的上清液经过超滤膜,锶的DF可达200。曹井国等[24]研究了混凝共沉淀-微滤工艺去除水中锶,结果表明,该工艺对锶具有良好的去除效果,平均 DF可达到157。同时,在试验中发现,沉淀中的锶元素存在返溶现象,而连续运行可克服锶的返溶问题。Weerasekara等[25]将金属氧化物吸附与微滤工艺结合,锶的去除效率分别达到99%和90%以上。生物法是近年来兴起的放射性废水治理技术之一,主要用于放射性污染的修复。Shraddha[26]采用一种香根草对溶液中137Cs和90Sr进行吸附。90Sr更多地吸附于嫩枝。溶液中初始90Sr的活度为5×103kBq/L,经168 h吸附后,去除率达到94%。将香根草用于实际低放废水处理,经15 d后,放射性活度由7.5×104Bq/L降至低于检出限。Ngwenya等[27]采用硫酸盐还原菌去除溶液中的Sr2+,当初始浓度为25~500 mg/L时,吸附等温线符合 Langmuir等温式,对锶的最大吸附量为416.7 mg/g。
3 结语
在放射性废水处理中,化学沉淀法具有过程简单、费用低廉,适用性广的优点。然而,DF较低,一般为10~102,并且形成的污泥量大,浓缩困难。离子交换/吸附法具有较高的去污因数和浓缩倍数,DF为102~103,浓缩倍数可达102~104。然而,锶的去除受竞争离子影响,选择性差是限制离子交换/吸附在含锶废水处理中应用的原因之一。膜技术的出水水质好、浓缩倍数高、运行稳定可靠。但是,该方法对原水水质要求较高,膜污染是限制其应用的重要因素。生物法虽对环境友好,但处理时间长,去污倍数有待提高,在实际应用中还需深入研究。放射性废水的处理应综合考虑处理效率、污泥浓缩、处理费用以及安全可靠,采用多种方法的组合工艺将是未来放射性废水处理的发展方向。
[1] Zhang A Y,Xiao C L,Kuraoka E,et al.Molecular modification of a novel macroporous silica-based impregnated polymeric composite by tri-n-butyl phosphate and its application in the adsorption for some metals contained in a typical simulated HLLW[J].Journal of Hazardous Materials,2007,147(1-2):601-609.
[2] Rahman R O A,Ibrahim H A,Hanafy M,et al.Assessment of synthetic zeolite NaA-X as sorbing barrier for strontium in a radioactive disposal facility[J].Chemical Engineering Journal,2010,157(1):100-112.
[3] Sureda R,Martínez-Lladó X,Rovira M,et al.Sorption of strontium on uranyl peroxide:implications for a high-level nuclear waste repository[J].Journal of Hazardous Materials,2010,181(1-3):881-885.
[4] 杨庆,侯立安,王佑君.中低水平放射性废水处理技术研究进展[J].环境科学与管理,2007,32(9):103-106,117.
[5] Lide D R.CRC handbook of chemistry and physics[M].Florida:McGraw-Hill,2009.
[6] Volkovich V A,Griffiths T R,Thied R C.Treatment of molten salt wastes by phosphate precipitation:removal of fission product elements after pyrochemical reprocessing of spent nuclear fuels in chloride melts[J].Journal of Nuclear Materials,2003,323(1):49-56.
[7] Tan S H,Chen X G,Sun J.Hydrothermal removal of Sr2+in aqueous solution via formation of Sr-substituted hydroxyapatite[J].Journal of Hazardous Materials,2010,179(1-3):559-563.
[8] Pacary V,Barré Y,Plasari E.Method for the prediction of nuclear waste solution decontamination by coprecipitation of strontium ions with barium sulphate using the experimental data obtained in non-radioactive environment[J].Chemical Engineering Research and Design,2010,88(9):1142-1147.
[9] Gäfvert T,Ellmark C,Holm E.Removal of radionuclides at a waterworks[J].Journal of Environmental Radioactivity,2002,63(2):105-115.
[10] Rout T K,Sengupta D K,Kaur G,et al.Enhanced removal of dissolved metal ions in radioactive effluents by flocculation[J].International Journal of Mineral Processing,2006,80(2-4):215-222.
[11] Hwang E D,Lee K W,Kwang H C,et al.Effect of precipitation and complexation on nanofiltration of strontium-containing nuclear wastewater[J].Desalination,2002,147(1-3):289-294.
[12] Rahman R O A,Ibrahim H A,Hanafy M,et al.Assessment of synthetic zeolite Na A-X as sorbing barrier for strontium in a radioactive disposal facility[J].Chemical Engineering Journal,2010,157(1):100-112.
[13] Osmanlioglu A E.Treatment of radioactive liquid waste by sorption on natural zeolite in Turkey[J].Journal of Hazardous Materials,2006,137(1):332-335.
[14] Rabideau A J,Benschoten J V,Patel A,et al.Performance assessment of a zeolite treatment wall for removing Sr-90 from groundwater[J].Journal of Contaminant Hydrology,2005,79(1-2):1-24.
[15] Inan S,Altas Y.Preparation of zirconium-manganese oxide/polyacrylonitrile(Zr-Mn oxide/PAN)composite spheres and the investigation of Sr(Ⅱ)sorption by experimental design[J].Chemical Engineering Journal,2011,168(3):1263-1271.
[16] Tel H,Altas Y,Eral M,et al.Preparation of ZrO2and ZrO2-TiO2microspheres by the sol-gel method and an experimental design approach to their strontium adsorption behaviours[J].Chemical Engineering Journal,2010,161(1-2):151-160.
[17] Gurbogal G,Tel H.Preparation of TiO2-SiO2mixed gel spheres for strontium adsorption[J].Journal of Hazardous Materials,2005,120(1-3):135-142.
[18] Park Y,Lee Y C,Shin W S,et al.Removal of cobalt,strontium and cesium from radioactive laundry wastewater by ammonium molybdophosphate-polyacrylonitrile(AMP-PAN)[J].Chemical Engineering Journal,2010,162(2):685-695.
[19] Valsala T P,Joseph A,Sonar N L,et al.Separation of strontium from low level radioactive waste solutions using hydrous manganese dioxide composite materials[J].Journal of Nuclear Materials,2010,404:138-143.
[20] Mashkani S G,Tajer P,Ghazvini M.Biotechnological potential of Azolla filiculoides for biosorption of Cs and Sr:Application of micro-PIXE for measurement of biosorption[J].Bioresource Technology,2009,100(6):1915-1921.
[21] Ahmadpour A,Zabihia M,Tahmasbi M,et al.Effect of adsorbents and chemical treatments on the removal of strontium from aqueous solutions[J].Journal of Hazardous Materials,2010,182(1-3):552-556.
[22] 牟旭凤,白庆中,陈红盛,等.聚合物辅助超滤/纳滤技术处理模拟放射性废水[J].给水排水,2006,32(增刊):174-177.
[23] Rao S V S,Paul B,Lal K B,et al.Effective removal of cesium and strontium from radioactive wastes using chemical treatment followed by ultra filtration[J].Journal of Radioanalytical and Nuclear Chemistry,2000,246(2):413-418.
[24] Cao J G,Gu P,Zhao J,et al.Removal of strontium from an aqueous solution using co-precipitation followed by microfiltration(CPMF)[J].Journal of Radioanalytical and Nuclear Chemistry,2010,285(3):539-546.
[25] Weerasekara N A,Choo K H,Choi S J.Metal oxide enhanced microfiltration for the selective removal of Co and Sr ions from nuclear laundry wastewater[J].Journal of Membrane Science,2013,447:87-95.
[26] Shraddha S,Susan E,Vidya T,et al.Phytoremediation of137cesium and90strontium from solutions and low-level nuclear waste by Vetiveria zizanoides[J].Ecotoxicology and Environmental Safety,2008,69(2):306-311.
[27] Ngwenya N,Chirwa E M N.Single and binary component sorption of the fission products Sr2+,Cs+and Co2+from aqueous solutions onto sulphate reducing bacteria[J].Minerals Engineering 2010,23(6):463-470.

