应用PRO/Ⅱ软件研究碳酸二甲酯-甲醇体系和氨-甲醇体系的汽液平衡
刘 丹,韩 晖
(亚申科技研发中心(上海)有限公司,上海 201203)
碳酸二甲酯(DMC)是近年来国内外化工界广泛关注的一种新型绿色化工产品[1],其分子结构中含甲基、甲氧基、羰基甲氧基和羰基4种官能团,因此具有多种反应活性,被誉为21世纪有机合成的“新基石”。
DMC的合成方法主要有光气法、甲醇氧化羰基化法、酯交换法和尿素醇解法等。尿素醇解法以大宗的化工产品尿素和甲醇为原料,生产成本低,该法适合合成氨和尿素的企业,促进了合成尿素行业产品的多元化,提高了产品的附加值。尿素醇解法分为间接尿素醇解法和直接尿素醇解法两种。间接尿素醇解法是由尿素和烷基二醇(主要为乙二醇或丙二醇)反应合成碳酸亚烃酯(碳酸乙烯酯或碳酸丙烯酯)和氨,然后碳酸亚烃酯与甲醇进行酯交换得到DMC和烷基二醇。直接尿素醇解法是尿素先与甲醇反应生成氨基甲酸甲酯和氨,然后氨基甲酸甲酯与甲醇进一步反应合成DMC,并释放出氨气,氨气可作为合成尿素的原料循环使用。
由工艺路线可见,无论间接尿素醇解法还是直接尿素醇解法,反应产物均是含有DMC、甲醇和氨的混合物。由于碳酸二甲酯-甲醇(DMCMeOH)会形成二元共沸物(常压下,质量组成为MeOH 70%、DMC 30%)[2],普通的分离方法难以达到产品分离的要求,目前常用的分离方法主要有加压精馏法[3-6]和萃取精馏法[7-10]等。无论采用何种分离方法,DMC-MeOH和氨-甲醇(NH3-MeOH)两种关键体系的汽液平衡的研究都显得尤为重要。
模拟计算的可靠性取决于基础数据和热力学模型计算的准确性。目前极性体系的相平衡计算依赖于二元交互作用参数,而二元交互作用参数需从实验或实际生产的汽液平衡数据回归得到,故在对极性体系进行过程模拟时,必须首先考虑关键组分的二元交互作用参数。DMC-MeOH和NH3-MeOH二元体系是典型的极性非理想体系。常用于极性非理想体系的液相活度系数法有UNIQUAC,NRTL,Wilson;气相的非理想性则采用SRK方程来校正[11]。
本工作采用SIMSCI公司开发的化工流程模拟软件PRO/Ⅱ,根据文献[12]报道的DMC-MeOH常压汽液平衡数据对该体系二元交互作用参数进行了回归,且在回归中强调最低共沸点与甲醇沸点间汽液平衡数据的权重关系;提出了NH3-MeOH体系汽液平衡的研究在尿素醇解法制备DMC分离工艺中的重要性,且根据文献[13-14]报道的NH3-MeOH汽液平衡数据对二元交互作用参数进行回归,以期对工业设计提供理论指导。
1 DMC-MeOH体系汽液平衡的研究
Luo等[15]对常压下DMC-MeOH体系的汽液平衡数据进行了测定,采用UNIFAC和NRTL模型对常压汽液平衡数据进行了回归和预测;Rodriguez等[12]采用高精度汽液平衡装置对DMC-MeOH体系进行测定,得到了较完整的常压汽液平衡数据;马新宾等[16-17]测定了DMC-MeOH的常压汽液平衡数据,并用Wilson方程进行了关联。张立庆等[18]用Wilson方程、NRTL方程和UNIFAC模型对其测定的DMC-MeOH体系的常压汽液平衡数据进行了拟合。
DMC-MeOH二元体系为最大正偏差系统,出现的最低共沸点(约63.8 ℃)与甲醇沸点(64.7℃)非常接近,因此对测定装置的控制精度提出较高的要求。文献[12,15-18]中报道的有关在共沸点温度与甲醇沸点范围内的汽液平衡数据均很少,而该段汽液平衡数据测定的准确性对工程设计计算非常重要。本工作根据Rodriguez等[12]常压下测定的DMC-MeOH体系汽液平衡数据,采用NRTL模型进行回归,NRTL模型表达式见式(1)~(6)。

值得注意的是,回归中强调最低共沸点与甲醇沸点间汽液平衡数据权重的重要性,选择加权系数的方法,在PRO/Ⅱ回归功能Thermo Data Manager中,设置数据的权重。根据回归后的平均相对误差,合理调整各点的权重。对误差小的点给予大的权重,对误差大的点给予小的权重。最终对模型中的二元交互作用参数进行了回归,将模型的计算结果与常压下实验数据进行了比较。
在101.3 kPa下,比较DMC-MeOH体系NRTL模型下汽液平衡数据的实验值和模型计算值,比较结果见表1。由表1可见,甲醇气相组成的平均相对误差为0.13%,温度的平均相对误差为0.04%。图1为对应的DMC-MeOH体系的t-x-y相图以及共沸点处的局部放大图。由图1可见,选用NRTL模型在常压下回归参数得到的计算值与实验值吻合较好,即使在最低共沸点与甲醇沸点较窄的温度区间内,考虑权重后计算值与实验值仍可较好地吻合。表明所选用的模型适用,参数回归准确,从而保证了热力学模型计算的可靠性,为DMC分离过程模拟提供了可靠的理论依据。回归得到的NRTL模型参数见表2。
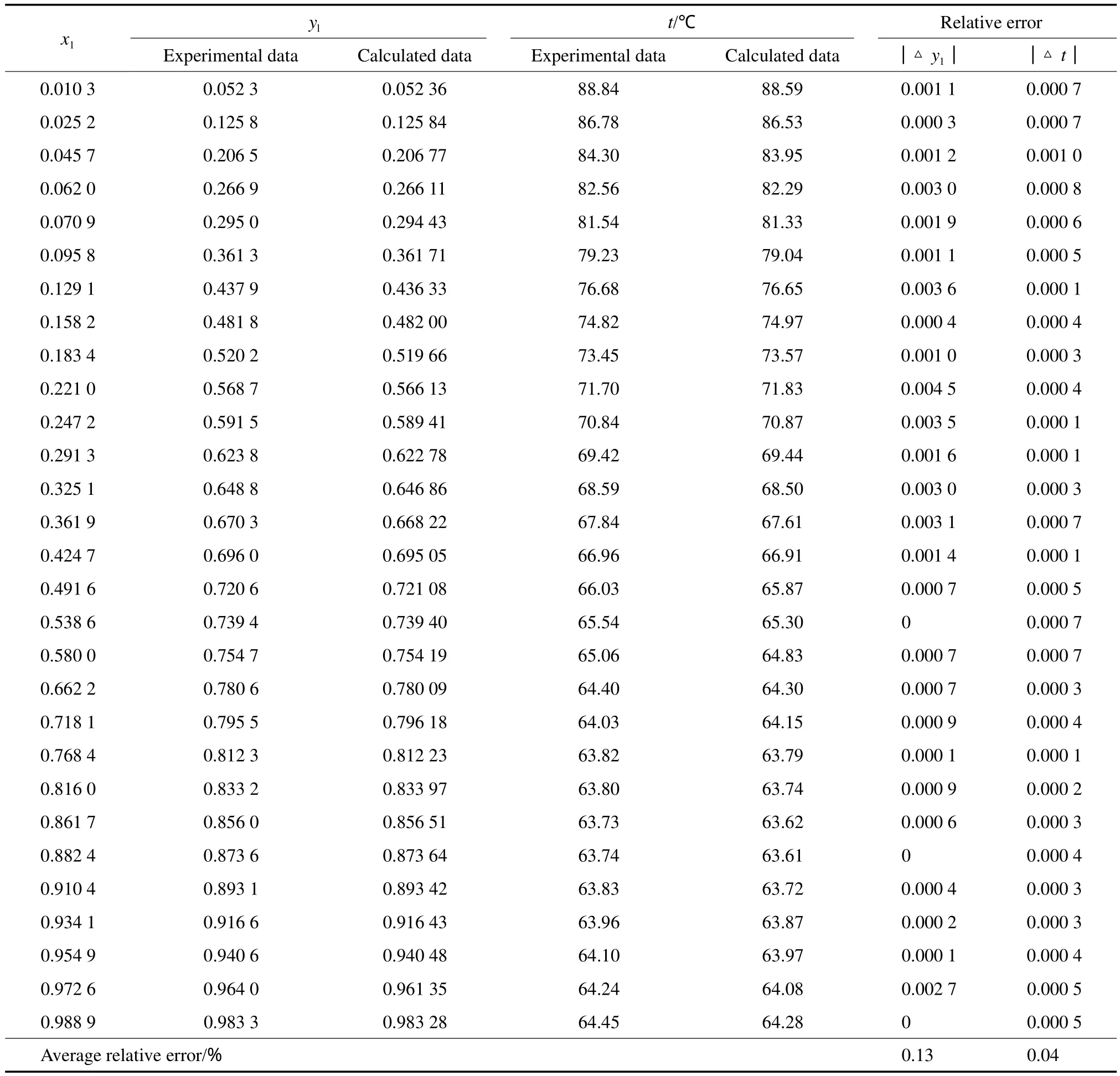
表1 101.3 kPa下MeOH(1)-DMC(2)体系t-x-y实验值[12]与模型计算值的比较Table 1 Comparison between the experimental and calculated data of t-x-y for MeOH(1)-DMC(2) system at 101.3 kPa

图1 MeOH-DMC体系的t-x-y相图(a)以及共沸点处的局部放大图(b)Fig.1 t-x-y Phase diagram of MeOH-DMC system(a) and the local enlargement of the azeotropic point(b).
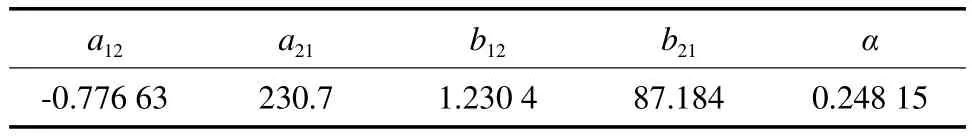
表2 NRTL模型中DMC(1)-MeOH(2)体系的二元交互作用系数Table 2 Binary interaction coef fi cients of the NRTL equation for the DMC(1)-MeOH(2) system
2 NH3-MeOH体系汽液平衡的研究
在尿素醇解法制备DMC的分离工艺中,NH3-MeOH体系汽液平衡的研究目前未见文献报道,大多文献报道的是有关DMC-MeOH体系汽液平衡的研究[19-22],但NH3和MeOH是DMC分离工艺中的关键组分,NH3和MeOH的分离温度范围为10~80℃,压力范围为0.1~1.0 MPa,因此对DMCMeOH体系汽液平衡的深入研究在DMC的分离工艺中尤为重要。
PRO/Ⅱ9.1软件中UNIQUAC和NRTL两种模型都有NH3-MeOH的二元交互作用参数,但仅适用于温度0~20 ℃、压力0.017~0.790 MPa的范围,在工程上使用时有局限性。本工作根据文献[13-14]报道的NH3-MeOH体系的汽液平衡数据,建立了Wilson模型进行回归,将温度、压力适用范围进一步补充和拓宽,以期对工业生产提供一定的理论支持。
Wilson模型见式(7)~(10)。表3~6为NH3-MeOH体系Wilson模型下汽液平衡数据实验值和模型计算值的比较。由表3~6可见,NH3气相组成的平均相对误差最大为0.98%,最小为0.09%;NH3液相组成的平均相对误差最大为5.35%,最小为2.95%。由此可见,NH3液相组成的平均相对误差比气相组成的平均相对误差整体偏大。图2为对应的NH3-MeOH体系的p-x-y相图。由图2可见,Wilson模型对NH3-MeOH体系的整体关联性较好。回归得到的Wilson模型参数见表7。
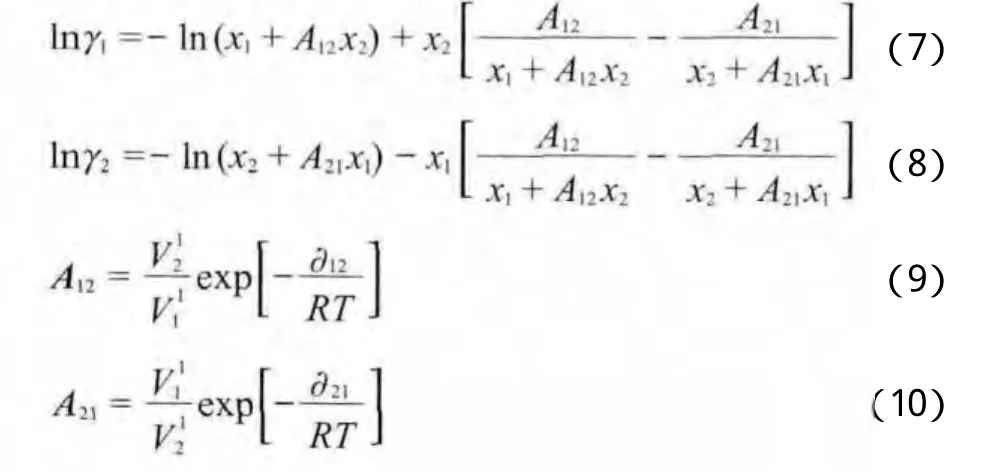
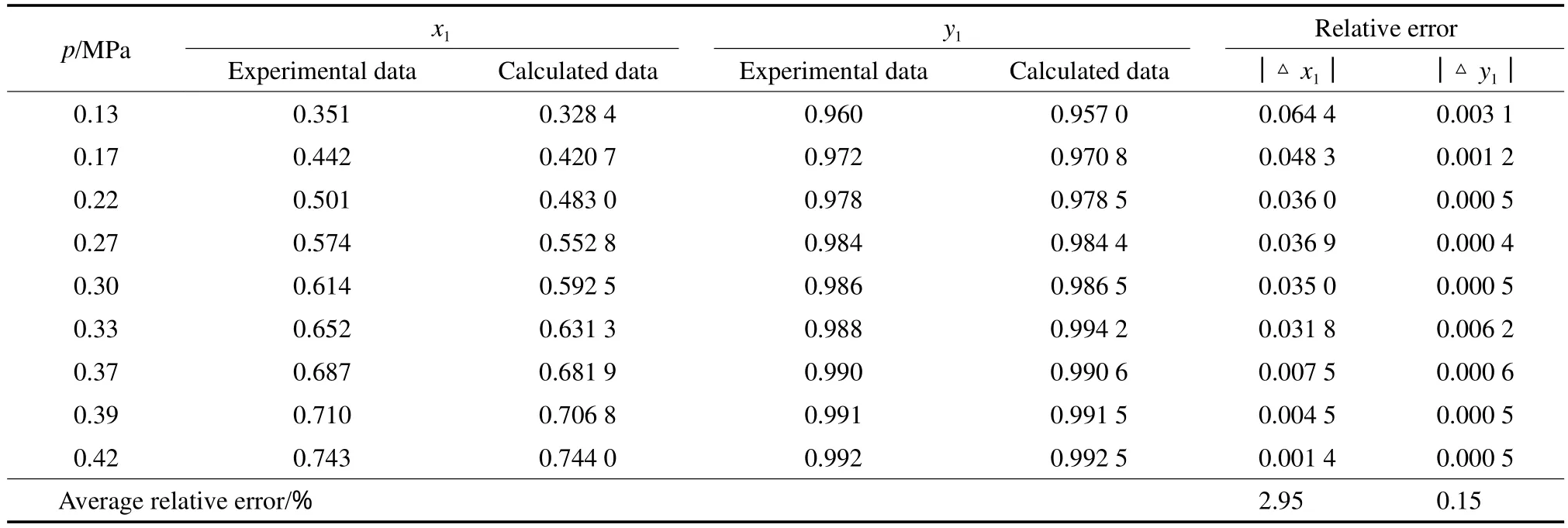
表3 10 ℃下NH3(1)-MeOH(2)体系的p-x-y实验值[13]与模型计算值的比较Table 3 Comparison between the experimental and calculated data of p-x-y for the NH3(1)-MeOH(2) system at 10 ℃

表4 20 ℃下NH3(1)-MeOH(2)体系的p-x-y实验值[13]与模型计算值的比较Table 4 Comparison between the experimental and calculated data of p-x-y for the NH3(1)-MeOH(2) system at 20 ℃
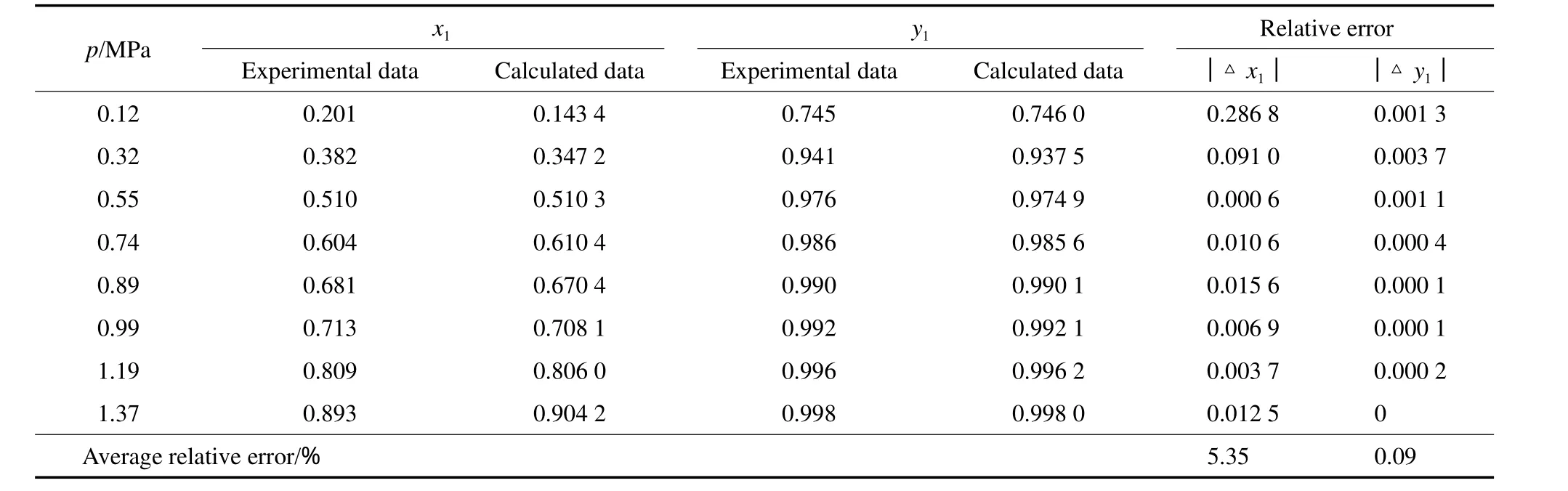
表5 40 ℃下NH3(1)-MeOH(2)体系的p-x-y实验值[14]与模型计算值的比较Table 5 Comparison between the experimental and calculated data of p-x-y for the NH3(1)-MeOH(2) system at 40 ℃
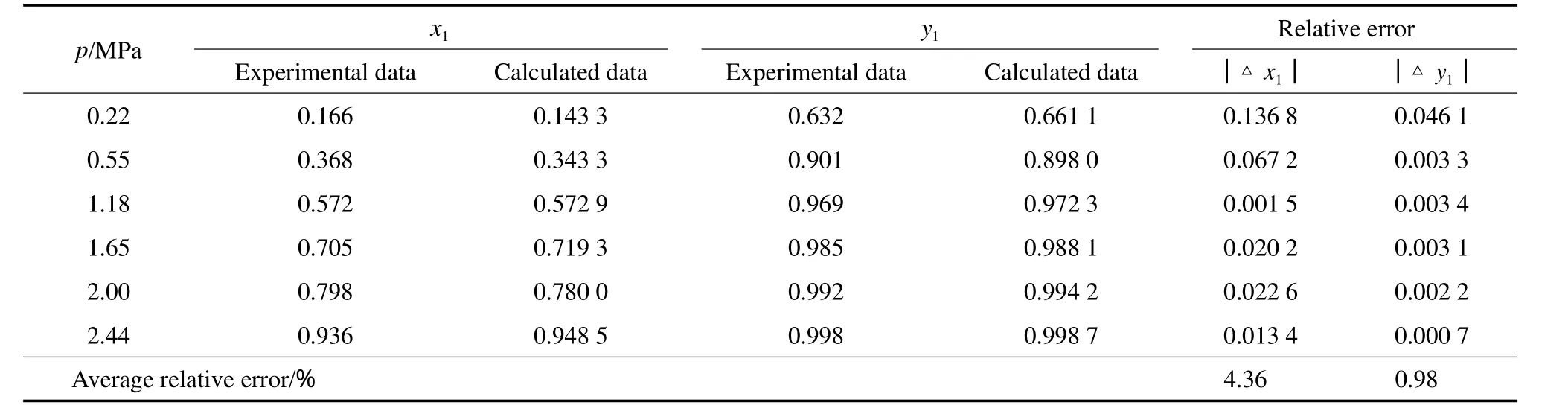
表6 60 ℃下NH3(1)-MeOH(2)体系的p-x-y实验值[14]与模型计算值的比较Table 6 Comparison between the experimental and calculated data of p-x-y for the NH3(1)-MeOH(2) system at 60 ℃
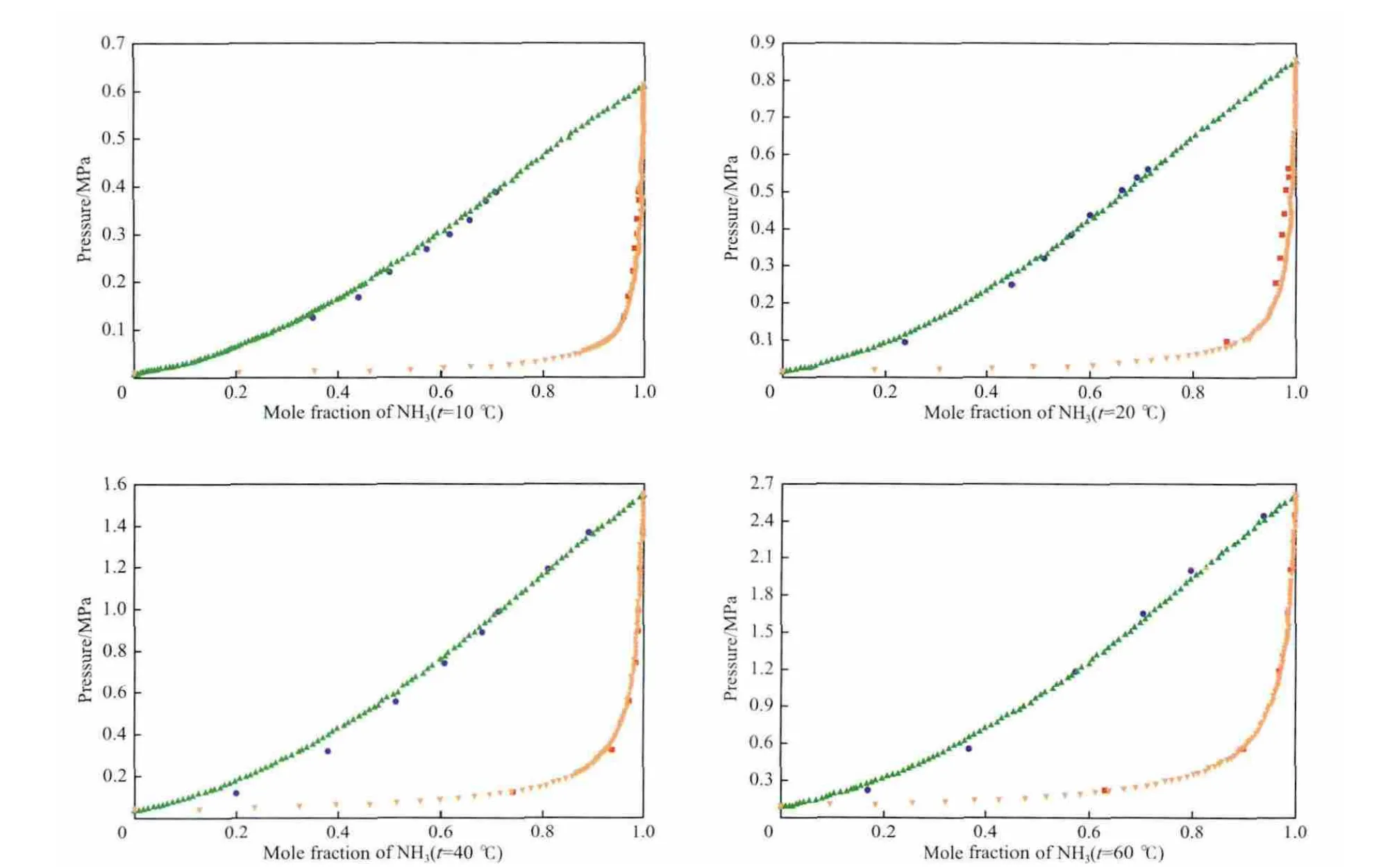
图2 NH3-MeOH体系的p-x-y相图Fig.2 p-x-y Phase diagram of the NH3-MeOH system.
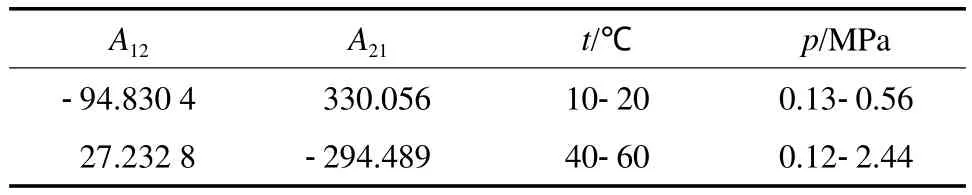
表7 Wilson模型中NH3(1)-MeOH(2)体系的二元交互作用参数Table 7 Binary interaction parameters of the Wilson equation for the NH3(1)-MeOH(2) system
3 结论
1)利用化工流程模拟软件PRO/Ⅱ,采用NRTL模型对文献报道的常压下DMC-MeOH体系的汽液平衡数据进行了回归,考虑了最低共沸点与甲醇沸点间数据的权重关系,得到了DMCMeOH体系NRTL模型中的二元交互作用参数,模型的计算值与实验值吻合较好,甲醇气相组成的平均相对误差为0.13%,温度的平均相对误差为0.04%。
2)提出了NH3-MeOH体系汽液平衡的研究在尿素醇解法制备DMC分离工艺中的重要性,应用Wilson模型对文献报道的NH3-MeOH体系的汽液平衡数据进行回归,汽液平衡数据的计算值与实验值吻合较好,可用于较宽温度和压力范围内的分离计算。
符 号 说 明
AijWislon模型交互作用参数
aij,bij,α NRTL模型交互作用参数
GijNRTL模型参数
p 压力,MPa
R 气体常数, 8.314 J/(mol·K)
T 温度,K
t 温度,℃
︱△t︱ 温度相对误差
x 液相摩尔分数
︱△x︱ 液相组成相对误差
y 汽相摩尔分数
︱△y︱ 汽相组成相对误差
γi物质i的活度系数
τijNRTL模型参数,K
∂ijWislon模型参数
[1]姜忠义.酯交换法合成碳酸二甲酯的催化精馏过程研究[J].化学工程,2001,29(3):29-33.
[2]李文清,施云海,肖文德,等.甲醇-碳酸二甲酯、甲醇-氯苯和碳酸二甲酯-氯苯二元系常压汽液相平衡的研究[J].石油化工,1996,25(12):839-845.
[3]李春山,张香平,张锁江,等.加压-常压精馏分离甲醇-碳酸二甲酯的相平衡和流程模拟[J].过程工程学报,2003,3(5):453-458.
[4]Shi Yunhai,Liu Honglai,Wang Kun,et al.Measurements of Isothermal Vapor-Liquid Equilibrium of Binary Methanol/Dimethyl Carbonate System Under Pressure[J].Fluid Phase Equilibria,2005,234(1):1-10.
[5]张军亮,王峰,彭伟才,等.分离碳酸二甲酯和甲醇的常压-加压精馏工艺流程的模拟[J].石油化工,2010,39(6):646-650.
[6]梅支舵,殷芳喜.加压分离甲醇与碳酸二甲酯共沸物的新技术研究[J].安徽化工,2001,109(1):2-3.
[7]张立庆,李菊清,丁江浩,等.碳酸二甲酯-甲醇-邻二甲苯三元体系汽液相平衡研究[J].石油与天然气化工,2004,33(1):4-6.
[8]李光兴,熊国玺.糠醛萃取精馏分离甲醇-碳酸二甲酯二元共沸物研究[J].化学工程,2000,28(4):21-23.
[9]潘鹤林,田恒水,于水.萃取精馏分离甲醇-碳酸二甲酯二元恒沸物[J].华东理工大学学报,1998,24(4):389-392.
[10]李振花,刘新刚,马新宾,等.甲醇、碳酸二甲酯、草酸二甲酯二元体系汽液平衡测定与关联[J].化学工程,2006,34(2):94-96.
[11]陆恩锡,张慧娟.化工过程模拟——原理与应用[M].北京:化学工业出版社,2011:32-40.
[12]Rodriguez A,Canosa J,Doninguez A,et al.Isobaric Vapour-Liquid Equilibria of Dimethyl Carbonate with Alkanes and Cyclohexane at 101.3 kPa[J].Fluid Phase Equilib,2002,198(1):95-109.
[13]Feng Yaosheng,Xie Rongjin,Wu Zhaoli.Vapor-Liquid Equilibria for Ammonia Plus Methanol[J].J Chem Eng Data,1999,44(3):401-404.
[14]Versteeg G F.Vapor-Liquid Equilibria for the Ammonia-Methanol-Water System[J].J Chem Eng Data,1988,33(1):26-29.
[15]Luo Huping,Xiao Wende,Zhu Kaihong.Isobaric Vapor-Liquid Equilibria of Alkyl Carbonates with Alcohols[J].Fluid Phase Equilib,2000,175(1/2):91-105.
[16]马新宾,李振花,夏清,等.草酸二甲酯对甲醇-碳酸二甲酯二元物系汽液平衡的影响[J].石油化工,2001,30(9):699-702.
[17]陈兵,李光兴,郑宇印.碳酸二甲酯-甲醇体系汽液平衡数据的测定及关联[J].高校化学工程学报,1997,11(2):193-196.
[18]张立庆,孙素敏.甲醇与碳酸二甲酯共沸物体系汽液平衡的计算[J].武汉理工大学学报,2001,23(4):4-13.
[19]程俊.DMC-MeOH的气液平衡及其共沸体系的分离研究[J].石油与天然气化工,2010,39(1):18-21.
[20]张立庆,朱仙良,朱鸣航.碳酸二甲酯-甲醇二元体系汽液平衡数据的推算与关联[J].计算机与应用化学,2001,18(3):681-682.
[21]Koga K.Separation of Dimethyl Carbonate:JP,2212456[P].1990-08-23.
[22]Ma Xinbin,Liu Xingang,Li Zhenhua,et al.Vapor-Liquid Equilibria for the Ternary System Methanol+Dimethyl Carbonate+Dimethyl Oxalate and Constituent Binary Systems at Different Temperatures[J].Fluid Phase Equilib,2004,221(1/2):51-56.

