延边黄牛PPARG基因多态性及与肉质性状的关联性
杨 震 曹 阳 张立春 严昌国 梁成云 李官浩 金海国
YANG Zhen1,2 CAO Yang 2 ZHANG Lic-hun2 YAN Chang-guo1 LIANG Cheng-yun1 LI Guan-hao1 JIN Hai-guo2
(1.延边大学,吉林 延边 133002;2.吉林省农业科学院畜牧分院,吉林 公主岭 136100)
(1.College of Agriculture,Yanbian University,Yanji,Jilin 133002,China;2.Branch of Animal Husbandry,Jilin Academy of Agricultural Sciences,Gongzhuling,Jilin 136100,China)
过氧化物酶体增殖物激活受体(PPARs),是核内激素手提家族中最具代表性的一元,过氧化物酶体可使其激活,从而增加其数量和体积[1,2]。PPARγ是PPAR家族中最具脂肪细胞专一性的成员,而且它在脂肪细胞分化诱导过程中是在大多数脂肪细胞特异基因的表达之前被诱导的,在脂肪组织内均表达丰富,具有控制和调节脂肪细胞分化和脂质贮存[3-5],影响 胰 岛 素 的 作 用,可 调 节 体 内 葡 萄 糖 平 衡[6-8]。PPARγ基因是脂肪细胞分化的特定转录因子,其表达量可增加脂肪细胞的分化,促进脂肪细胞的成熟。同时,PPARγ信号通路控制脂质的吸收、运输、贮存和消化[9]。PPARγ基因同样可以促进成纤维细胞和前脂肪细胞向脂肪细胞的分化[10,11],并 激 活 与 脂 类 代 谢 相 关 的 基 因,如 脂 蛋 白 脂 酶(LPL)、脂肪酸结合蛋白(FABP)等[12-14]。
肉类的经济性状一般都是由多个基因调控影响的[15],利用单核苷酸多态性(SNP)技术寻找候选基因功能区域和经济性状的关联性分析,已被广泛应用于牛功能基因的筛选[16-20]。此外,突变表型的差异是影响肉类动物经济性状的关键因素[21]。体脂、腹脂、肌内脂肪以及肌纤维的数量和体积等均是评价牛肉品质的重要指标,其中肌内脂肪含量尤为重要。肌内脂肪主要由分布在肌内外膜和肌束膜的脂肪构成,其中含有油酸、亚油酸、亚麻酸等对人体健康有益的多种不饱和脂肪酸[22]。肌内脂肪含量丰富的牛肉断面呈现不规则的大理石纹状,其肉质柔软鲜嫩多汁。脂肪细胞的体积和数量是衡量动物肌内脂肪含量的重要指标[23]。本试验拟采用PCR—单链构象多态性(SSCP)技术检测延边黄牛PPARG基因单核苷酸多态性,并将其与延边黄牛肉质性状进行关联性分析,以期找到延边黄牛在该基因上的多态位点和多态信息,发现新的影响延边黄牛牛肉品质的分子标记,从而改善延边黄牛牛肉品质和生产性能。
1 材料与方法
1.1 材料来源
供试群体延边黄牛83头统一标准饲养于吉林省珲春市吉兴牧场,采用ACD抗凝(VACD∶V血液=1∶6)方法颈椎静脉取血10 m L,将标记好的血样保存于-20℃冰箱。
1.2 主要试剂
PMD18-T Vector:中国 TaKaRa公司;
DNA凝胶回收试剂盒:美国Axygen公司;
D2000 Marker、d NTPs、10×PCR Buffer、DNA 聚合酶:北京天根生化科技有限公司。
1.3 方法
1.3.1 基因组DNA提取 利用AxyPrep公司生产的血液基因组DNA小量制备试剂盒提取延边黄牛血液基因组DNA,最后在1%琼脂糖水平电泳中检测延边黄牛基因组的完整性和纯度,将完整性和纯度较好的基因组保存于-20℃冰箱。
1.3.2 引物设计与合成 依据NCBI数据库中提供的黄牛PPARG基因序列(Gene ID:281993),利 用 Oligo 7.37 和Primer Premier 5.0等软件进行引物设计,引物扩增长度为185 bp,引物由北京六合华大基因科技股份有限公司合成。引物序列:
(1)上游引物 F:5'-AAGAAGCCCATTCCCAGATAC-3'
(2)下游引物 R:5'-ACCTTCCTAGTGCCATCCAG-3'
1.3.3 PCR 扩 增 PCR 反 应 体 系 为 20μL:DNA 模板1.0μL,上下游引物各0.6μL,DNA 聚合酶0.8μL,d NTPs 1.0μL,10×PCR Buffer 2.0μL,加水补至20μL。反应条件:94℃预变性4 min,94℃变性40 s,66.5℃复性40 s,72℃延伸30 s,32个循环,72℃再延伸8 min,最后于2.0%琼脂糖水平电泳中检测扩增产物的特异性。
1.3.4 PCR-SSCP 分 析 将 2.5μL 的 PCR 产 物和7.5μL的Loading Buffer混合于小离心管中,放于100℃水浴锅中变性10 min,然后将变性后的混合物迅速冰浴10 min,最后用12%非变性聚丙烯酰胺凝胶(Acr∶Bis为29∶1)检测分型。电泳条件:电压160 V,18 h,温度4℃,1×TBE电泳缓冲液。经硝酸银染色后,进行基因分型,每个基因型随机挑选10个样品送于北京六合华大基因科技股份有限公司测序,并用DNAStar7.0等软件进行序列对比。
1.3.5 肉质性状测定 随机挑选21头延边黄牛进行屠宰,并测定其肉质性状,包括颜色、p H24值、剪切力、蒸煮损失和眼肌面积。
1.3.6 序列分析与数据处理 利用DNAstar7.0等软件对测序结果进行分析和比对;并利用SPSS 19.0软件对基因型与延边黄牛肉质性状的进行关联性分析,肉质性状指标由平均值±标准差组成。
2 结果与分析
2.1 PCR扩增结果
采用本试验设计的PPARG基因特异性引物,在延边黄牛群体能很好的扩增出185 bp的目的片段(见图1),无非特异性条带,可以用于PCR-SSCP分析。
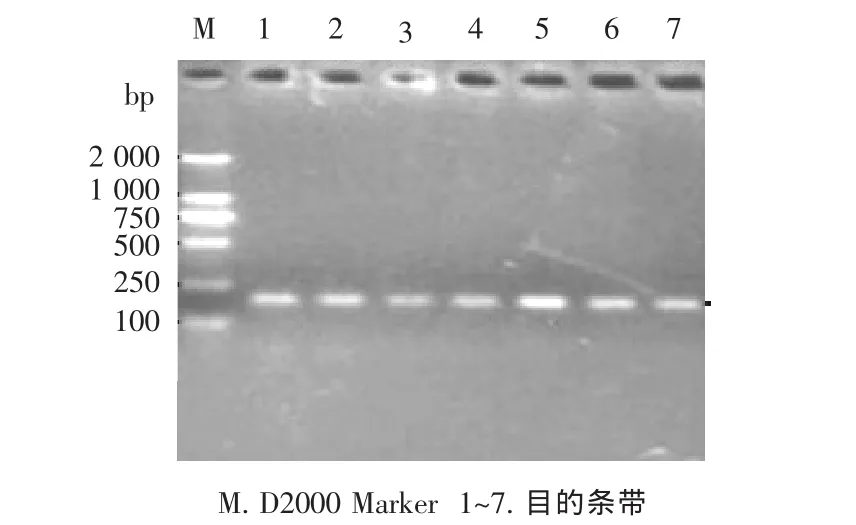
图1 PPARG基因PCR产物1%琼脂糖凝胶电泳Figure 1 1%agarose gel electrophoresis of PCR products in PPARG Gene
2.2 PCR-SSCP检测结果
PCR-SSCP检测结果发现,延边黄牛群体可分为3种基因型(见图2),分别定义为CC、TT和CT。
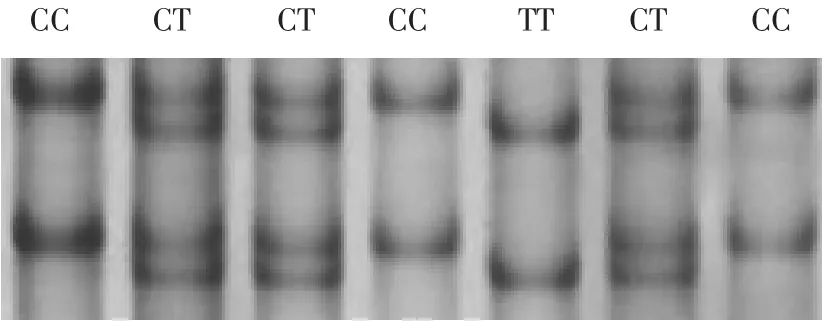
图2 PPARG基因PCR-SSCP检测结果Figure 2 SSCP test results of PCR products in PPARG Gene
2.3 序列分析结果
利用DNAStar7.0软件将测序序列与NCBI数据库提供的黄牛序列(Gene ID:281993)比对后发现,在26 106 bp处TT基因型发生了A→G的突变。比对结果见图3。
2.4 基因频率和基因型频率分析
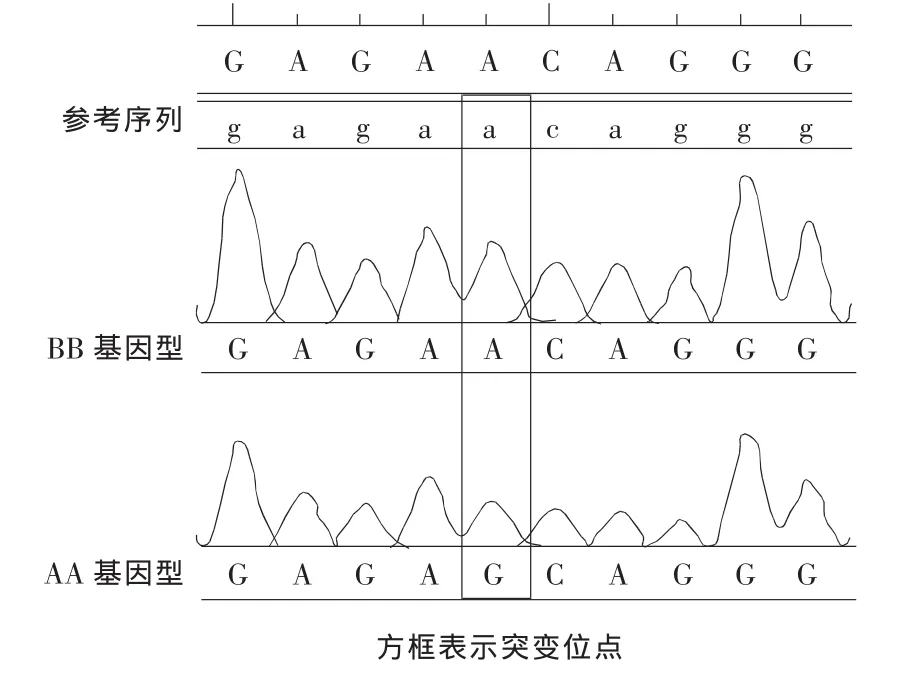
图3 纯合个体基因型和NCBI数据库中黄牛PPARG基因序列的比对Figure 3 Homozygous genotype and the NCBI database of genetic sequences of cattle for PPARG
经PCR-SSCP分型后统计基因型频率及等位基因频率结果见表1。由表1可知,C等位基因为优势等位基因,基因型CC为优势基因型,并且经卡方检验发现,延边黄牛处于Hardy-Weinberg平衡状态(P>0.05)。
2.5 不同基因型与延边黄牛部分肉质性状的关联分析
表1 延边黄牛PPARG基因等位基因频率及基因型频率分布Table 1 Distribution of genotype and allele frequencies of PPARG gene in Yanbian cattle
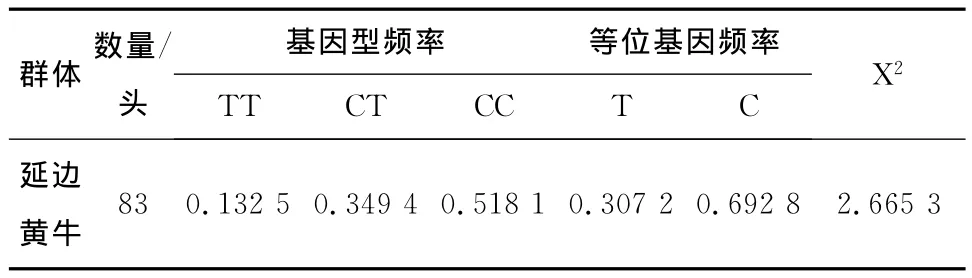
表1 延边黄牛PPARG基因等位基因频率及基因型频率分布Table 1 Distribution of genotype and allele frequencies of PPARG gene in Yanbian cattle
df 0.05(1)=3.84。
群体数量/头基因型频率 等位基因频率TT CT CC T C X2延边黄牛83 0.132 5 0.349 4 0.518 1 0.307 2 0.692 8 2.665 3
利用SPSS19.0统计软件对延边黄牛部分肉质性状进行方差分析,结果(表2)表明,TT基因型所对应的个体CIE L*、蒸煮损失和眼肌面积显著高于CT和CC基因型个体,剪切力显著低于CT和CC基因型个体,且差异显著(P<0.05)。CC、CT、TT 3种基因型在其余肉质性状上无显著差异。
3 讨论
表2 PPARG基因各基因型肉质性状均值差异显著性检验Table 2 Significance test of meat trait means for different genotypes of PPARG gene
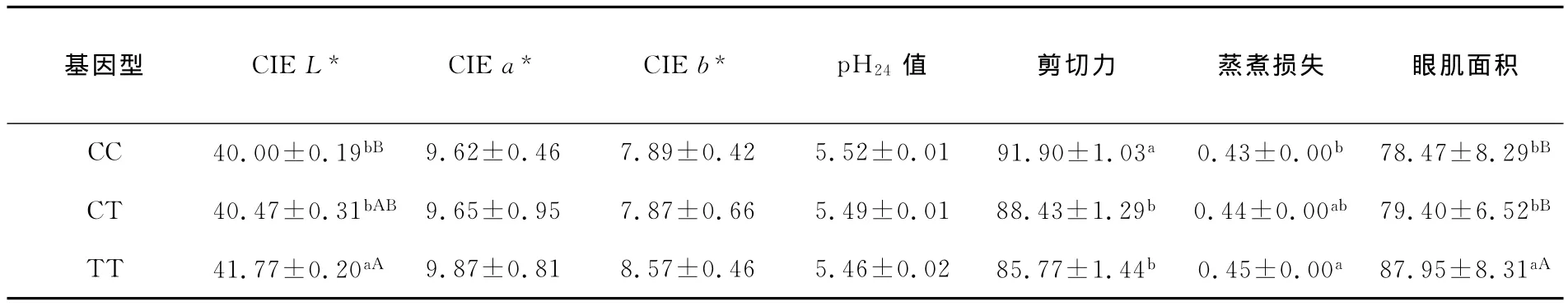
表2 PPARG基因各基因型肉质性状均值差异显著性检验Table 2 Significance test of meat trait means for different genotypes of PPARG gene
同行数据上标不同小写字母表示差异显著(P<0.05);同行数据上标不同大写字母表示差异显著(P<0.01);字母相同或无字母标注表示差异不显著(P>0.05);p H 24表示24 h所测p H值。
基因型 CIE L* CIE a* CIE b* p H 24值 剪切力 蒸煮损失 眼肌面积CC 40.00±0.19bB 9.62±0.46 7.89±0.42 5.52±0.01 91.90±1.03a 0.43±0.00b 78.47±8.29bB CT 40.47±0.31bAB 9.65±0.95 7.87±0.66 5.49±0.01 88.43±1.29b 0.44±0.00ab 79.40±6.52bB TT 41.77±0.20aA 9.87±0.81 8.57±0.46 5.46±0.02 85.77±1.44b 0.45±0.00a 87.95±8.31aA
PPARG基因多态性与延边黄牛部分肉质性状关联分析表明:基因型TT对肉亮度CIE L*和眼肌面积有影响且极显著高于CC、CT 2个基因型个体(P<0.01),基因型TT对剪切力有影响且显著低于CC、CT 2个基因型个体(P<0.05),基因型TT对蒸煮损失也有影响且显著高于CC、CT 2个基因型个体(P<0.05),但 CC、CT、TT 3种基因型在肉红色度、黄色度及p H24值无显著差异。试验结果表明PPARG基因可作为影响肉牛肌内脂肪沉积的重要候选基因,用于分子标记辅助选择(MAS)育种。本试验发现,C等位基因是群体中的优势等位基因,但含有T等位基因个体的肉质性状指标优于其他个体。因此,推测等位基因T可能影响肉牛的体质量和脂肪沉积,为地方优势等位基因,其结果需进一步验证。
4 结论
综上所述,PPARG基因多态性对延边黄牛肉质性状有一定影响,在脂肪沉积方面尤为突出。目前国内外关于PPARG基因在延边黄牛肌内脂肪含量的研究较少,本试验通过对延边黄牛PPARG基因多态性研究为其功能研究奠定了良好的基础。并可依据该基因多态性位点对延边黄牛的肉质性状进行分子标记辅助选择,促进延边黄牛的分子育种进程。
1 Issemann I,Green S.Activation of a member of the steroid hormone receptor super family by peroxisome proliferators[J].Nature,1990,347(6 294):645~650.
2 解相林,王栋,王慧.PPAR基因多态性与肉鸡脂肪性状的相关性研究[J].畜牧兽医学报,2005,36(12):1 261~1 264.
3 Forman B M,Chen J,Evans R M.Hypolipidemic drugs,polyunsaturated fatty acids,and eicosanoids are ligands for peroxi-some proliferator-activated receptorsαandδ[J].Proceedings of the National Academy of Sciences,1997,94(9):4 312~4 317.
4 Kliewer S A,Lenhard J M,Willson T M,et al.A prostaglandin J2metabolite binds peroxisome proliferator-activated receptorγ and promotes adipocyte differentiation[J].Cell,1995,83(5):813~819.
5 Tontonoz P,Hu E,Spiegelman BM.Stimulation of adipogenesis in fibroblasts by PPAR gamma 2,a lipid-activated transcription factor[J].Cell,1994,79(7):1 147~1 156.
6 Berger J,Moller D E.The mechanisms of action of PPARs[J].Annual Review of Medicine,2002,53(1):409~435.
7 Spiegelman B M.PPAR-gamma:adipogenic regulator and thiazolidinedione receptor[J].Diabetes,1998,47(4):507~514.
8 Walczak R,Tontonoz P.PPARadigms and PPARadoxes:expanding roles for PPARγin the control of lipid metabolism[J].Journal of Lipid Research,2002,43(2):177~186.
9 Schoonjans K,Staels B,Auwerx J.The peroxisome proliferator activated receptors(PPARS)and their effects on lipid metabolism and adipocyte differentiation[J].Biochim Biophys Acta,1996,1 302(2):93~109.
10 Matsusue K,Peters J M,Gonzalez F J.PPARbeta/delta potentiates PPARgamma-stimulated adipocyte differentiation[J].FASEB J.,2004,18(12):1 477~1 479.
11 Evans R M,Barish G D,Wang Y X.PPARs and the complex journey to obesity[J].Nature Medicine,2004,10(4):355~361.
12 Escher P,Wahli W.Peroxisome proliferator-activated receptors:insight into multiple cellular functions[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2000,448(2):121~138.
13 Rosenson R S.Effects of peroxisome proliferator-activated receptors on lipoprotein metabolism and glucose control in type 2 diabetes mellitus[J].The American Journal of Cardiology,2007,99(4):96~104.
14 Choudhary V,Kumar P,Bhattacharya T K,et al.DNA polymorphism of insulin-like growth factor-binding protein-3 gene and its association with birth weight and body weight in cattle[J].Journal of Animal Breeding and Genetics,2007,124(1):29~34.
15 Wang J,Shaner N,Mittal B,et al.Dynamics of Z-band based proteins in developing skeletal muscle cells[J].Cell Motility and the Cytoskeleton,2005,61(1):34~48.
16 Xu X,Xing S,Du Z Q,et al.Porcine TEF1 and RTEF1:Molecular characterization and association analyses with growth traits[J].Comparative Biochemistry and Physiology Part B:Bi-ochemistry and Molecular Biology,2008,150(4):447~453.
17 Zhou G,Dudgeon C,Li M,et al.Molecular cloning of the HGD gene and association of SNPs with meat quality traits in Chinese red cattle[J].Molecular Biology Reports,2010,37(1):603~611.
18 Liu H,Tian W,Zan L,et al.Mutations of MC4R gene and its association with economic traits in Qinchuan cattle[J].Molecular Biology Reports,2010,37(1):535~540.
19 Zhang C L,Wang Y H,Chen H,et al.Association between variants in the 5′-untranslated region of the bovine MC4R gene and two growth traits in Nanyang cattle[J].Molecular Biology Reports,2009,36(7):1 839~1 843.
20 Juszczuk-Kubiak E,Wyszyńska-Koko J,Wicińska K,et al.A novel polymorphisms in intron 12 of the bovine calpastatin gene[J].Molecular Biology Reports,2008,35(1):29~35.
21 Sambrook J,Russell D W.Molecular cloning A laboratory manual[M].3rd edition.Beijing:Science Press,2002.
22 Nishimura T,Hattori A,Takahashi K.Structural changes in intramuscular connective tissue during the fattening of Japanese black cattle:effect of marbling on beef tenderization[J].Journal of Animal Science,1999,77(1):93~104.
23 Albrecht E,Teuscher F,Ender K,et al.Growth and breed related changes of marbling characteristics in cattle[J].Americana Society of Animal Science,2006(84):1 067~1 075.

