人参皂苷Rb1联合亚低温对大鼠局灶性脑缺血再灌注损伤保护作用的实验研究*
刘俊伟 张慧玲 李 斌 刘旭玲 王均炉 汪炜建△
(1.山西省阳煤集团总医院,山西 阳泉 045000;2.温州医科大学附属第一医院,浙江 温州 325000)
人参皂苷Rb1联合亚低温对大鼠局灶性脑缺血再灌注损伤保护作用的实验研究*
刘俊伟1张慧玲1李 斌1刘旭玲2王均炉2汪炜建2△
(1.山西省阳煤集团总医院,山西 阳泉 045000;2.温州医科大学附属第一医院,浙江 温州 325000)
目的 观察人参皂苷Rb1联合亚低温对大鼠脑缺血再灌注损伤的保护作用,探讨其可能的作用机制。方法 SD大鼠40只,按随机数字表法分为假手术组(Sham组)、模型组(M组)、人参皂苷Rb1治疗组(G组)(40mg/kg)、亚低温治疗组(H组),控制肛温在(33±1)℃,缺血后持续2h,亚低温联合人参皂苷Rb1治疗组(HG组)。除Sham组外,其余各组均采用Zea Longa法制作局灶性脑缺血再灌注损伤模型(MCAO模型),各组于再灌注后24h对其进行神经功能缺损程度评分;评分后麻醉取血,测血清中S100β的变化。断头取脑组织,采用TTC法进行脑梗死体积测定。结果 神经功能缺损程度评分除Sham组之外,其余各组大鼠于再灌注24h后均出现神经缺失症状。单独使用H或G能够显著改善24h时间点神经功能,梗死率和降低S100β表达(P<0.05),联合应用疗效均明显增强(P<0.01),且联合用药与单独应用任一药物相比在各项指标差异均有统计学意义(P<0.01)。结论 大鼠脑缺血后即刻实施亚低温(33±1)℃或40mg/kg腹腔注射人参皂苷Rb1均有不同程度的脑保护作用,两者联合应用具有增强作用。
亚低温 人参皂苷Rb1 脑缺血 再灌注损伤 S100β
大量研究表明亚低温可以通过多种机制对脑缺血再灌注损伤起到保护作用。但也有文献报道,亚低温过程中容易发生低血压、电解质紊乱、心律失常,干扰凝血系统增加血液凝固的危险及呼吸系统感染增加等并发症。现阶段国内外的学者在脑缺血再灌注损伤的治疗方面都比较赞同多种干预联合治疗,希望达到更好的治疗效果。适当的中医药联合亚低温治疗能更好地起到脑神经保护作用。人参皂苷Rb1是人参中的主要活性成分之一,是人参二醇型最具代表的活性成分。本实验拟在建立稳定、可靠的局灶性脑缺血再灌注损伤模型基础上,研究人参皂苷Rb1联合亚低温对大鼠脑缺血再灌注损伤的保护作用,并对其可能的机制进行探讨。
1 材料与方法
1.1 动物 健康成年雄性SD大鼠24只,体质量260~300g(上海斯莱克实验动物中心提供)。
1.2 材料与试剂 人参皂苷Rb1购于上海同田生物技术公司。血清S100β定量双抗体夹心ELISA试剂盒(上海西唐生物有限公司)。绿化三苯基四氮唑TTC试剂购于美国Sigma公司。TM902电子测温计购于北京云飞五金机电有限公司
1.3 分组与造模 雄性SD大鼠40只随机分为5组,假手术组(Sham组,n=8),模型组(M组,n=8),人参皂苷Rb1治疗组(G组,n=8),亚低温治疗组(H组,n=8)、人参皂苷Rb1联合亚低温治疗组(HG组,n=8)。随机抽取8只SD大鼠为Sham组,Sham组只做手术操作,不插入线栓。除Sham组外其余4组均参照Zea Longa的方法建立局灶性脑缺血再灌注损伤模型,大鼠均选择右侧为栓塞侧。术前12h禁食,自由饮水。参照改良Zea Longa等[1]的方法,采用颈外动脉插入线栓法制作模型。所有大鼠称重后,用10%水合氯醛350mg/kg腹腔注射麻醉大鼠,颈部备皮,75%酒精消毒后,颈部正中切口长约3~4cm,依次钝性分离肌肉,组织,暴露右侧迷走神经,颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),分离迷走神经是注意避免损伤,以免引起呼吸骤停。将提前准备好的丝线分别在CCA近心端,ECA远端挂线(ECA挂线3条,在CCA距分叉处5mm处结扎远心端两条丝线)。动脉夹夹住CCA近心端与ICA远心端。沿着ECA动脉结扎两线间将其剪断,在ECA距CCA分叉处之间,距离短端2mm左右剪一小口。将提前准备好线栓沿小切口插入约5mm后,将预先放置在ECA根部的丝线打结将其固定,然后松开ICA远心端的动脉夹,将线栓缓慢地向ICA入颅方向推进大约18~19mm后再将固定丝线收紧再次打结,防止大鼠出血。在向颅内送线栓时如果遇到阻力时,应停止并调整进线栓方向,一般都可以成功地完成,缝合皮肤。此时即完成右侧大脑中动脉阻塞(MCAO)模型,记录此刻时间,约2h后拔出线栓实现再灌注。在手术全过程中使用电子体温计探头插入大鼠肛门监测大鼠体温。Sham组、M组、G组体温维持在36~37℃;H组和HG组体温维持在32~34℃。
1.4 给药方法 Sham组:不插入线栓,只做栓塞模型的手术操作。M组:线栓插入后腹腔注射0.9%氯化钠注射液4mL/kg。G组:插入线栓后立即腹腔注射40mg/kg。H组:插入线栓后腹腔注射相同剂量的0.9%氯化钠注射液,将电子体温计探头插入大鼠肛门(插入深度大于3cm)检测大鼠体温,同时利用酒精喷洒大鼠腹部物理降温,10min内诱导到目标温度,并利用冰块,炽热灯泡,电热毯控制大鼠体温在(33±1)℃。维持3h后室温条件下复温。HG组:插入线栓后如G组腹腔注射等量的人参皂苷(40mg/kg),同时诱导亚低温并维持体温在(33±1)℃。
1.5 指标检测 大鼠神经功能障碍评分:各组大鼠于脑缺血再灌注损伤(MCAO)后24h时间点,参照的Zea Longa等的神经功能缺失5分法标准,对大鼠神经系统进行评定。0分:正常,无神经功能缺失症状。1分:轻度局灶性神经功能缺损,即提尾悬空不能伸展左侧前爪。2分:中度局灶性神经功能缺损,即行走向左侧转圈。3分:重度局灶性神经功能缺损,即行走困难,并有向左侧倾倒征象。4分:无自发活动行动,意识水平下降。5分:死亡。
1.6 脑组织TTC染色 参照Lin等的方法进行TTC染色。大鼠于MCAO后24h,进行神经功能评分后将脑组织取出置于-20℃冰箱内15min,沿冠状面间隔2mm连续行5个切片,切片立即置于2%TTC磷酸缓冲液中,避光37℃恒温孵育30min,15min中时翻转1次,以达到染色均匀。梗死灶被染为白色,正常组织为红色。将所有脑切片同侧顺序排列,用数码相机Canon A480拍照后应用图像分析软件Image Pro Plus 6.0(IIP6.0)进行图像分析处理。按照以下公式计算脑梗死体积:脑梗死率=梗死区域体积/对侧大脑的体积×100%。血清S100β的检测:脑缺血再灌注后24h 10%水合氯醛麻醉大鼠后,心脏取血,离心(4000转/min离心10min)取血清。严格按照大鼠S100β定量双抗体夹心ELISA试剂盒操作说明检测血清中S100β的浓度。
1.7 统计学处理 应用SPSS17.0统计软件处理。数据以(±s)表示,多组样本均数比较进行方差齐性检验,组间比较采用单因素方差分析,方差齐性者两两比较用LSD法,方差不齐者进行Dunnett′s检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组神经功能障碍评分比较 见表1。参照文献[1]大鼠脑神经功能缺失5分法标准,对各组大鼠于再灌注后24h给予神经功能评分。与M组比,H组和G组及HG组神经功能评分降低有统计学意义(P<0.05或P<0.01)。HG组与H组及G组相比,改善更明显(P<0.05)。
表1 神经行为学评分(分,±s)
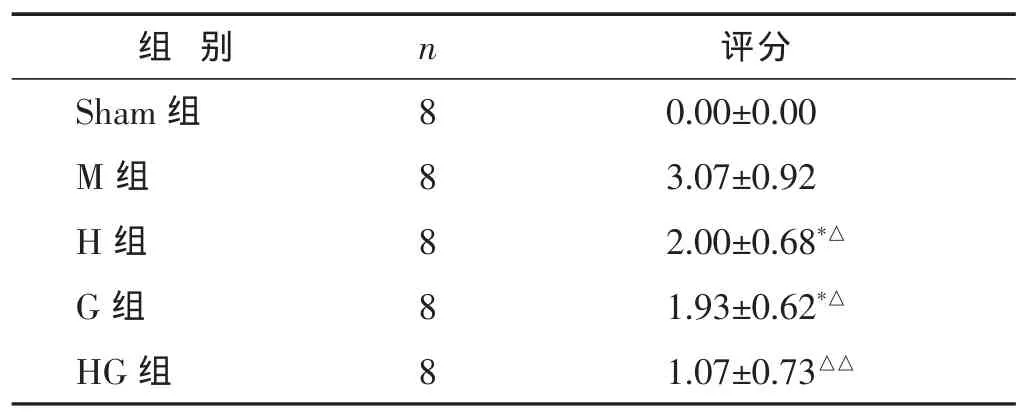
表1 神经行为学评分(分,±s)
与HG组比较,*P<0.05,**P<0.01;与M组比较,△P<0.05,△△P<0.01。下同。
组 别 n Sham组 8 M组 8 H组 8评分0.00±0.00 3.07±0.92 2.00±0.68*△G组 8 1.93±0.62*△HG组 8 1.07±0.73△△
2.2 各组脑梗死体积结果比较 见表2。由于Sham组梗死体积为0,除Sham组外各组均出现不同程度的梗死区域。通过IPP6.0图像软件采集后计算出脑梗死率。与M组比,G组或H组梗死率明显减少(P<0.05),HG组梗死率减少最明显(P<0.01);与H或G组比,HG组脑梗死率在大鼠脑缺血再灌注后24h梗死率明显减少(P<0.01)。
表2 大鼠脑梗死率和血清S100β含量(±s)
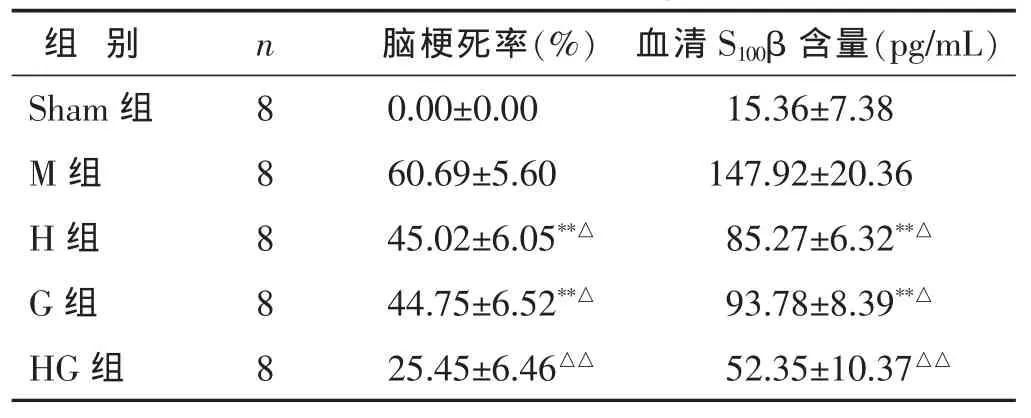
表2 大鼠脑梗死率和血清S100β含量(±s)
组 别 n Sham组 8 M组 8 H组 8 G组 8 HG组 8脑梗死率(%) 血清S100β含量(pg/mL)0.00±0.00 15.36±7.38 60.69±5.60 147.92±20.36 45.02±6.05**△ 85.27±6.32**△44.75±6.52**△ 93.78±8.39**△25.45±6.46△△ 52.35±10.37△△
2.3 各组血清S100β含量比较 见表2。与模型组比,G组或H组血清中S100β含量明显减少(P<0.05),HG组血清中S100β含量减少最明显(P<0.01);与G或H组比,HG组血清中S100β含量在大鼠脑缺血再灌注后24h明显减少(P<0.01)。
3 讨论
脑缺血再灌注损伤的发病机制十分复杂,其中包含兴奋性氨基酸毒性增加,自由基的大量释放引起的组织脂质过氧化,钙离子超载以及炎症因子、凋亡等多种因素相互构成的一个负反馈级联网络。多年来国内外科学家试图找到有效的药物或干预来减轻脑缺血再灌注损伤,但是到目前为止能有效地应用于临床的仍然很少。目前单一的药物临床治疗效果并不是很乐观[2-4],国内外多提倡多种技术或药物联合应用,综合治疗实现脑保护。20世纪80年代中后期以来,各种动物及临床实验结果均证实了亚低温对缺血再灌注损伤后脑组织具有明显的保护作用。亚低温对脑的保护作用是临床上行之有效的重要方法之一[5]。本实验研究也证实脑缺血期实施亚低温(32±1)℃可以有效减少脑梗死体积,改善神经行为学。但亚低温治疗有诸如干扰凝血机制,发生心律失常等不良反应。有文献报道[6]人参皂苷Rb1在心脏等其他器官的缺血再灌注损伤中也有较强的保护作用。可以减少大鼠暂时性脑缺血梗死面积和改善神经功能缺失症状,具有明显的抗脑缺血损伤作用,其作用机制有清除自由基,抗谷氨酸的神经毒性作用有关,同时有抗心律失常改善凝血等作用。人参皂苷Rb1有抵抗亚低温的副作用的效果。本实验研究也发现G组与M组相比脑梗死体积明显减少,神经行为学评分明显减少,这与李方成等研究结果一致。中成药人参皂苷Rb140mg/kg与亚低温(33±1)℃联合作用的意义在于减少其并发症、提高疗效、对大鼠脑缺血缺氧发挥保护作用的机制各有侧重又互为补充。S100β蛋白是神经组织蛋白的一种,是More于1965年首次发现,S100β蛋白在神经系统内的分布十分广泛,高浓度存在于神经胶质细胞或Shcwnan细胞中,被认为是神经胶质细胞的标志蛋白[7]。本实验中亚低温组或人参皂苷Rb140mg/kg组均能减低血清中S 100β蛋白含量,两者联合作用更明显,表明联合治疗有增强效果。但人参皂苷Rb1联合亚低温治疗脑缺血的保护作用相关机制,还有待于进一步更深入实验研究。
[1]Feeney DM,Boyesona MG,Linn RT,et al.Responses to cortical injury:I.Methodology and local effects of contusions in the rat[J].Brain Research,1981,211(2):67-77.
[2]李永领,项洪武,朱烈烈,等.人参皂苷对重度颅脑外伤大鼠模型环氧合酶-2表达的影响[J].中国中医急症,2010,19(9):1556-1557.
[3]刘俊伟,张慧玲,金深辉,等.人参皂苷Rb1对脑创伤后SD大鼠脑水含量及血清S100β的影响[J].中国中医急症,2012,12(3):399-400.
[4]Zausinger S,Westermaier T,et al.(2003)."Neuroprotection in transient focal cerebral ischemia by combination drug therapy and mild hypothermia:comparison with customary therapeutic regimen."[J].Stroke,2008,34(6):1526-1532.
[5]梅志忠,李承晏.亚低温联合黄芪对大鼠局灶脑缺血再灌注损伤的神经保护作用[J].卒中与神经疾病,2001,8(5):275-277.
[6]贾继明,王宗权.人参皂苷Rb1的药理活性研究进展[J].中国中药杂志,2008,33(12):1371-1377.
[7]尹晟,华荣.中医药联合亚低温脑保护治疗的研究进展[J].中国急救医学,2007,27(10):943-945.
Experimental Study of Ginsenoside Rb1 Combined with Mild Hypothermia on Cerebral Ischemia-Reper-fusion Injury
LIU Junwei,ZHANG Huiling,LI Bin,et al.
Yangquan Coal Group General Hospital,Yangquan 045000,China
Objective:To observe the protective effect of ginsenoside Rb1 combined with mild hypothermia on cerebral ischemia reperfusion injury,and to explore the possible mechanism.Methods:40 SD rats(250~300 g)were randomly divided into sham group(n=8),model group(M group,n=8),ginsenoside Rb1 treatment group(G group,n=8),mild hypothermia group(H group,n=8),and mild hypothermia combined with ginsenoside Rb1 treatment group(HG group,n=8).All except sham group were made into MCAO models,followed by middle cerebral artery reperfusion 2 hours later according to Zea Longa method.24 h after reperfusion,the neurological deficit scores were recorded,the change of S100β in serum were detected,and the infarct volumes of rats in each group were assessed by TTC method.Results:Except for the sham group,the neurological function scores of rats in the remaining four groups were all deficient 24h after reperfusion.Compared with M group,neurological function of rats in G or H group significantly improved 24 h after reperfusion(P<0.05).The infarction rates of G and H group significantly reduced compared with M group(P<0.05),and that of HG group significantly improved(P<0.01).Compared with the model group,decline of S100β levels in serum of G or H group was significant(P<0.05),while that of HG group was the most obvious(P<0.01).Compared with G or H group,the serum S100β content in HG group significantly reduced 24h after reperfusion(P<0.01).Conclusion:Mild hypothermia(30±1)℃ and intraperitoneal injection of 40mg/kg ginsenosides Rb1 immediately after cerebral ischemia in rats have different degree of cerebral protection,and the joint application of these two measures can enhance the protective effect.
Mild hypothermia;Ginsenoside Rb1;Cerebral ischemia;Reperfusion injury;S100β
R285.5
A
1004-745X(2014)10-1793-03
10.3969/j.issn.1004-745X.2014.10.008
2014-05-28)
浙江省中医药管理局科研项目(2011ZB086);浙江省卫生厅科研项目(2010KYA134);温州市科技局科研项目(Y20080224)
△通信作者

