转Bt水稻土壤微生物多样性对O3浓度升高的响应
李春艳,刘 标,韩正敏,曾 青,李春华,朱建国(.环境保护部南京环境科学研究所,生物安全重点实验室,江苏 南京 2002;2.南京林业大学森林资源与环境学院,江苏 南京 20037;3.辽宁农业职业技术学院,辽宁 营口 5009;.中国科学院南京土壤研究所,土壤与可持续农业国家重点实验室,江苏 南京 20008)
转Bt水稻土壤微生物多样性对O3浓度升高的响应
李春艳1,2,3,刘 标2*,韩正敏1,曾 青4,李春华4,朱建国4(1.环境保护部南京环境科学研究所,生物安全重点实验室,江苏 南京 210042;2.南京林业大学森林资源与环境学院,江苏 南京 210037;3.辽宁农业职业技术学院,辽宁 营口 115009;4.中国科学院南京土壤研究所,土壤与可持续农业国家重点实验室,江苏 南京 210008)
利用中国农田开放式O3浓度升高(O3-FACE)平台,于2010年和2011年对O3浓度升高和田间自然条件下转Bt基因水稻Bt汕优63(Bt-SY63)及其常规水稻汕优63(SY63)根际土壤微生物群落功能多样性进行了研究.结果表明, O3浓度升高使Bt-SY63和SY63水稻土壤微生物总体活性有降低的趋势, O3浓度升高未使两基因型水稻土壤微生物的丰富度、优势度和均一度发生显著变化. O3浓度升高显著地改变了Bt-SY63土壤微生物碳源基质的利用方式,使其土壤微生物由对糖类及其衍生物具有较强的利用能力转向对代谢中产物和次生代谢物具有较强的利用能力,而对SY63土壤微生物碳源基质的利用没有显著影响.因此,从稻田土壤微生物群落对O3浓度升高的不同响应来看,Bt-SY63可能比SY63更敏感.
O3;O3-FACE;转Bt水稻;土壤微生物;功能多样性
近地层O3浓度的持续升高对植物的形态结构、生理生化、生长繁殖等都造成不同程度的损伤[1-3],关于O3浓度升高对农作物生物量和产量的影响,国内外学者更是进行了大量的研究[4-6].然而,目前关于O3浓度升高对土壤微生物影响的研究相对较少且集中于对微生物群落结构影响方面[7-8],对微生物群落功能方面影响的研究较少.近地层O3浓度升高对土壤生态系统的影响研究非常重要[9],不仅是因为土壤微生物群落作为土壤分解系统的主导者,在推动土壤物质转换、能量流动和生物地球化学循环中扮演着重要作用[10],其多样性变化还可以敏感地指示气候和土壤环境条件的变化,土壤微生物群落结构与功能的改变直接关系到土壤营养物质的分解与循环,进而影响植物的养分吸收[8,11].
此外,转Bt基因作物还存在着非预期性状变化[12-14],这种非预期变化可能导致地下生态系统的改变.转基因抗虫作物的外源基因及其表达产物还可通过根系分泌或作物残体等途径进入土壤[16-17],从而可能影响土壤微生物群落活性.迄今为止,关于O3浓度升高对转Bt基因水稻土壤根际微生物群落功能多样性的影响,国内外均未见报道.
本试验采用国际先进的、更接近自然的O3-FACE(free-air O3concentration enrichment,开放式空气O3浓度升高)技术,研究农田生态系统土壤微生物群落对O3浓度升高的响应及其在高O3浓度下的功能效应,以期充实转基因植物生态安全方面的理论基础.
1 材料与方法
1.1 试验地及O3-FACE系统
试验地位于江苏省江都市小纪镇良种场(119°42′0″E,32°35′5″N)的中国O3-FACE系统研究平台,该地耕作方式为水稻-冬小麦复种,是典型的稻麦复种农田生态系统.该地年均降水量980mm左右,潜在年蒸发量>1100mm,年平均温度14.9℃,年日照时间>2100h,年无霜期220d.试验用土取自育秧田表层(0~20cm)土壤.土壤类型为砂浆水稻土,理化性质:容重为1.2g/cm3,有机质含量、全氮、全磷、全钾分别为17.42,1.59,1.23, 14.02mg/kg, pH 6.8.
O3-FACE平台于2007年3月开始运行,试验平台设有3个O3处理圈(升高的O3浓度)和3个对照圈(环境O3浓度).O3处理圈设计为直径14m的正八面形,O3处理圈与对照圈之间间隔大于70m,以减少O3释放对对照圈的影响.通过围成正八角形的8根橡胶管带上直径0.5mm×0.9mm的小孔在作物冠层上方50~60cm向圈中心喷射O3气体,晴天每天09:00~18:00释放O3,电脑控制使O3处理圈内O3浓度始终保持在对照圈的1.5倍,控制误差为10%.对照田块没有安装管道,环境条件与自然状态完全一致.2010年O3处理圈布气时间为7月2日~10.8,2011年布气时间为6月27日~10月20日.试验期间O3处理圈和对照圈的O3浓度变化见图1.
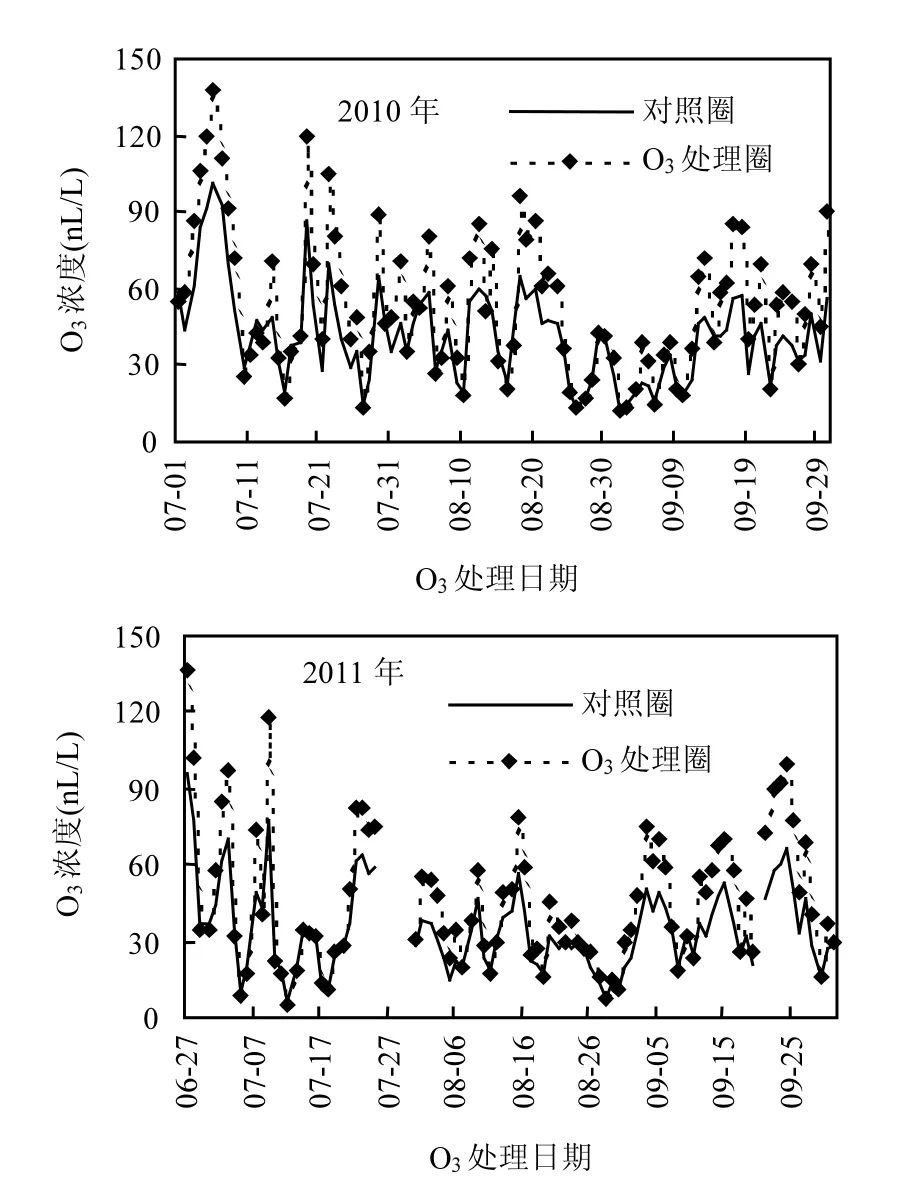
图1 2010年和2011年O3处理圈与对照圈O3浓度变化情况Fig.1 The O3concentrations in O3-FACE and ambient air in 2010 and 2011
1.2 试验材料及育苗
2010年及2011年开始盆栽种植转基因和非转基因水稻.供试水稻品种Bt汕优63(Bt-SY63)及其亲本常规稻汕优63(SY63)由华中农业大学提供.Bt-SY63中表达的是cry1Ab/Ac基因,用于控制二化螟等鳞翅目害虫.2010年水稻季于. 2010年6月8日开始浸种、催芽,6月13日育秧,6月23日移栽,分设在3个O3处理圈和3个对照圈,每品种每圈(每个处理)放置25盆,盆长23cm、宽18cm、高25cm,1m2内放置24盆,每盆装土6.3kg.盆半埋入土,每盆种植1穴,1穴2株,全生育期保持2~3cm水层,收获前一周左右停水.2011年水稻季于5月18日开始浸种、催芽,5月21日育秧,6月22日移栽,10月4日收获,其他试验设计同2010年.
肥料管理:整个生育期需N 15g/m2,P2O5和K2O各7g/m2,分别由尿素(46%N)、P2O5和K2O提供.移栽前施用基肥:40%的N,100%的P和K;分蘖早期和抽穗期分别施30%的N,其他田间管理如虫草害等同大田一致[18].
1.3 土壤样品采集
2010年7月25日(分蘖期),8月21日(抽穗期),9月19日(灌浆后期)和2011年7月27日(分蘖期),8月23日(抽穗期),9月23日(灌浆后期)采集土壤样品.每次每个处理(每品种每圈)按“S”形法抽取5盆水稻,用直径5cm的土钻破坏性采集0~15cm土层的根系周围土壤样品,装入无菌塑料袋里,尽快带回实验室,用于测定水溶性有机碳含量的土壤经自然风干后过20目筛(0.90mm孔径)备用,用于BIOLOG分析的土壤置于4℃保存,并在取样后 24h内完成.
1.4 土壤样品处理与分析
水溶性有机碳测定:称取相当于20g干土的上述过筛土样,加入灭菌蒸馏水40mL,置于22℃, 180r/min的摇床上振荡30min后取出,于7000r/min的高速离心机中离心15min,然后过0.45µm滤膜.滤液于耶拿公司TOC-总有机碳分析仪(Mutli N/C 3100)上测定.
BIOLOG分析:称取相当于5g烘干土重的新鲜土样,加入装有45mL灭菌的0.85%(W/V) NaC1溶液中,置于22℃,180r/min的摇床上振荡30min后取出,静止3min后吸取土壤悬液1mL加入装有9mL灭菌的0.85%NaCl溶液的试管中,震荡摇匀稀释成10-2的稀释液,以此类推得到10-3稀释液.用8通道加样器吸取10-3稀释液接种到Biolog ECO板中,每孔150μL,置于培养箱中25℃培养,每隔24h(直到168h)在Biolog Reader上读取各孔在590nm波长下的光吸收值(OD).Biolog ECO微平板和Biolog Reader购自美国BIOLOG公司(BIOLOG,Hayward,USA).
1.5 数据处理与统计分析
计算Shannon-Wiener(H)指数用于评估土壤微生物群落中物种的丰富度即群落所含物种的多寡.计算Simpson(D)指数用于评估土壤微生物群落中最常见物种的优势度.计算Mcintosh(U)指数用于评估土壤微生物群落中物种的均一度.基础数据采用SPSS软件(SPSS Inc., version 16.0)进行方差分析.培养72h的平均吸光值采用分期的one-way ANOVA方法进行数据分析,土壤水溶性有机碳、Shannon-Wiener(H)、Simpson(D)和Mcintosh(U)指数采用广义线性模型的重复测量程序(O3浓度作为因素,生长时期作为重复测量因子)进行方差分析.土壤微生物群落代谢特征采用CANOCO4.5进行主成分分析(PCA).
2 结果与讨论
2.1 土壤水溶性有机碳含量对O3浓度升高的响应
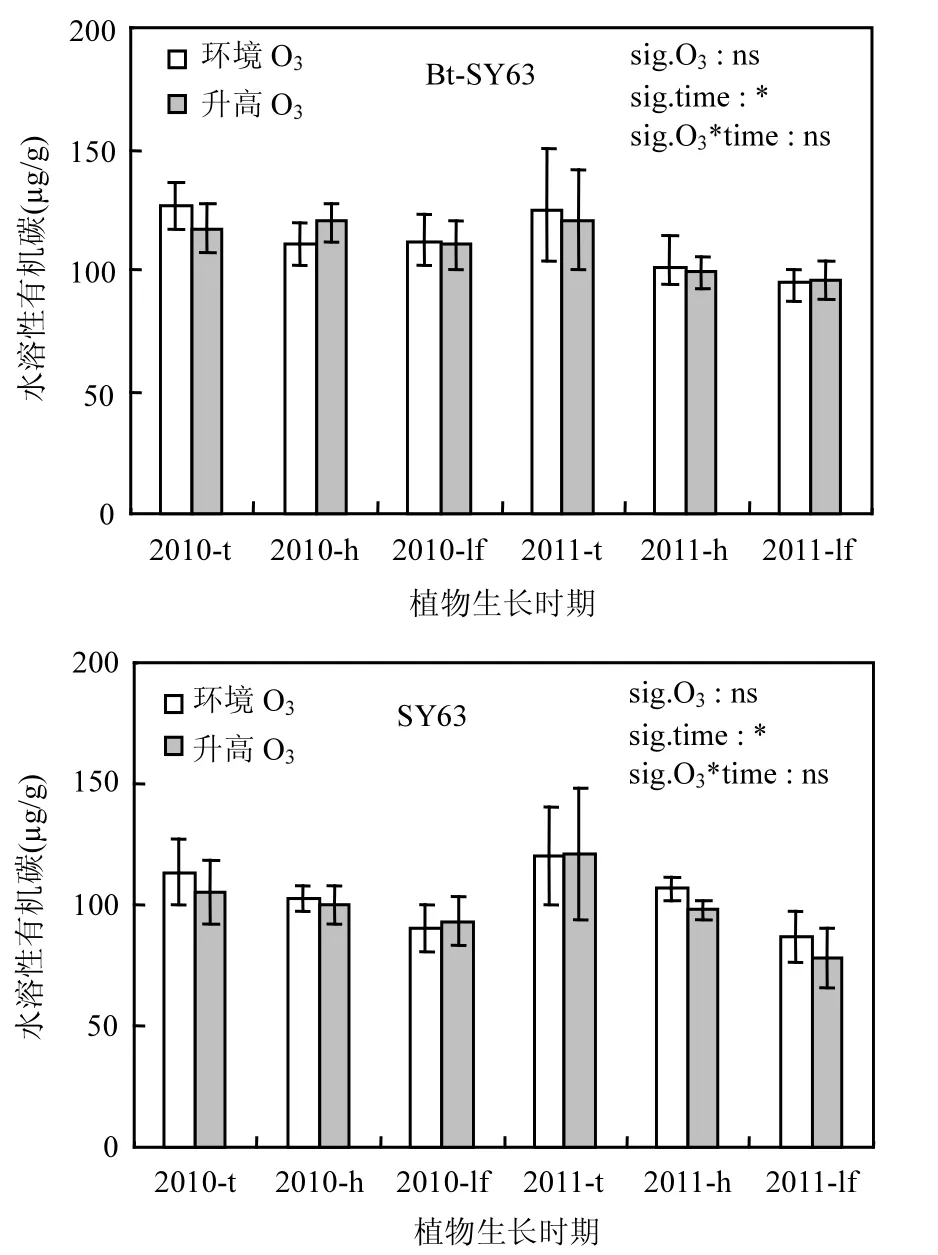
图2 2010和2011年不同采样时期环境O3浓度和升高O3浓度 水稻土壤水溶性有机碳含量变化Fig.2 Variation of water soluble organic C of rice soil under ambient and elevated O3conditions at different sampling times in 2010 and 2011
图2中的广义线性模型的重复测量方差表明,与环境O3浓度相比,O3浓度升高有降低土壤水溶性有机碳含量的趋势,但O3处理及O3处理与时间(生长时期)的交互作用对Bt-SY63和SY63两基因型水稻的土壤水溶性有机碳含量均没有显著影响(P>0.05).土壤水溶性有机碳含量存在着显著的时间效应,即随着生长期的延长,两基因性水稻土壤水溶性有机碳含量逐渐降低.
2.2 土壤微生物碳源代谢活性对O3浓度升高的响应
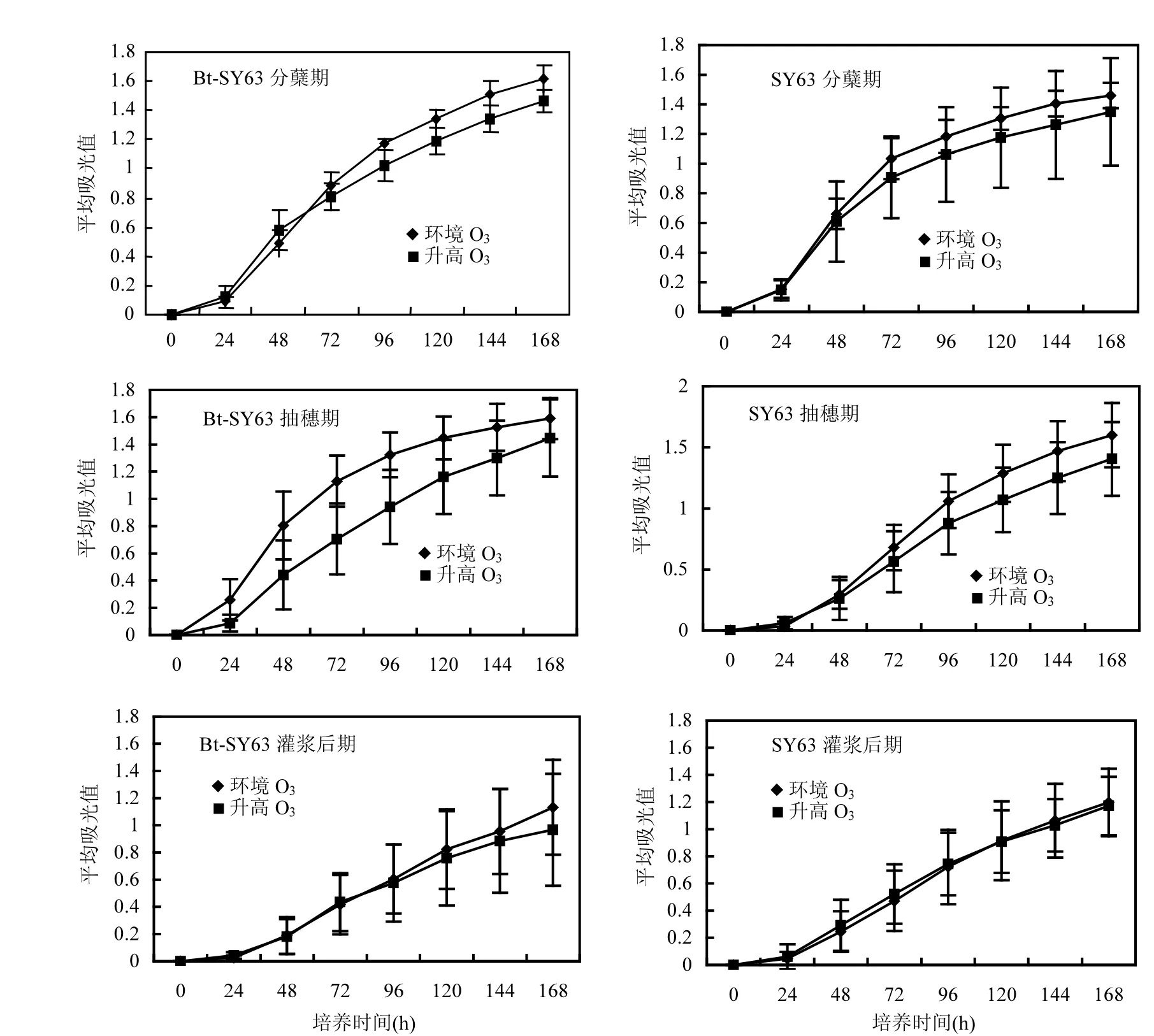
图3 2010年不同采样时期升高O3浓度和环境O3浓度条件下水稻土壤中平均吸光值的变化Fig.3 Variation of AWCD values with the incubation time of rice soil under ambient and elevated O3condition at different sampling times in 2010
平均吸光值(AWCD)是Biolog板上所有碳源基质被微生物利用后的整体反应的指标,反映了微生物群落的总体活性.图3和图4所示,对于Bt-SY63,2010年和2011年各生育期采样中O3浓度升高下,土壤微生物群落AWCD低于环境O3浓度下.2010年抽穗期除外,其他各生育期采样中O3浓度升高和环境O3浓度条件下土壤的AWCD差异均未达到显著性水平(表1).
而对于SY63,2010年分蘖期和抽穗期及2011年灌浆后期O3浓度升高下,土壤微生物群落AWCD低于环境O3浓度条件下,2011年分蘖期和抽穗期O3浓度升高下,土壤微生物群落AWCD高于环境O3浓度下,2010灌浆后期O3浓度升高下和环境O3浓度下土壤微生物群落AWCD随时间变化趋势几乎相同(图3和图4).但是两年各生育期采样中土壤的AWCD差异均未达到显著性水平(表1).

图4 2011年不同采样时期升高O3浓度和环境O3浓度条件下水稻土壤中平均吸光值的变化Fig.4 Variation of AWCD values with the incubation time of rice soil under ambient and elevated O3conditions at different sampling times in 2011
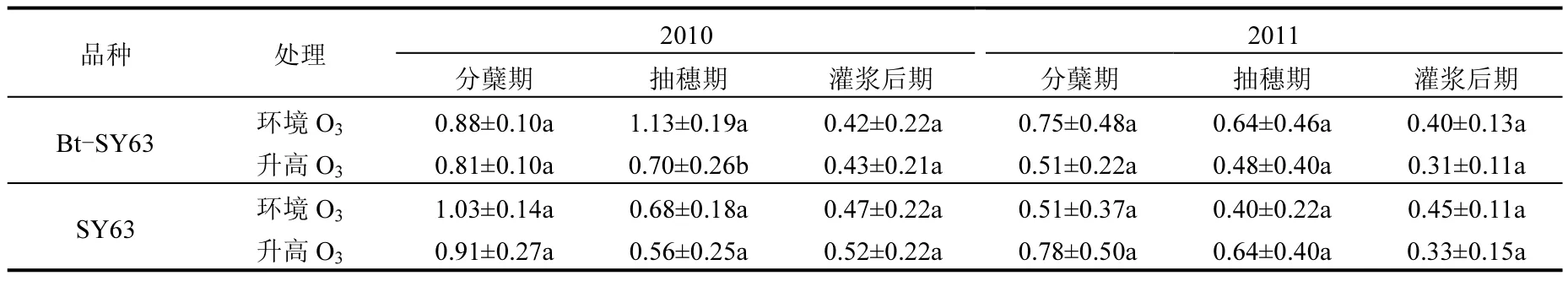
表1 2010和2011年各生育期升高O3浓度和环境O3浓度条件下水稻土壤中平均吸光值(培养72h测定值)Table 1 The average well color development (AWCD) of rice soil under ambient and elevated O3conditions at different growth stages during 2010-2011 (measured at 72h)
近地层O3对土壤生态系统的组分难以产生直接的影响,因为O3不能穿透入土壤[19].因此,O3可能通过影响植物生理过程和C分配而间接地改变土壤生态系统[20-21].本研究两年的数据表明,无论是对于转基因水稻Bt-SY63还是常规水稻SY63,近地层O3浓度升高下稻田土壤水溶性有机碳含量下降,从而影响了土壤微生物对部分碳源的利用能力,进而导致高O3浓度下土壤微生物群落AWCD最终低于环境O3浓度下土壤微生物群落AWCD值,这可能与O3浓度升高降低了两基因型水稻向根系的碳输入及根中的碳分配、减少根系分泌物,从而影响土壤微生物的活性有关[22-23].
2.3 土壤微生物群落代谢功能多样性对O3浓度升高的响应
选取72h的平均吸光值计算出Shannon-Wiener、Simpson以及McIntosh 3种土壤微生物群落代谢功能多样性指数,结果见表2.表中的方差表明,高浓度O3暴露没有导致Bt-SY63和SY63水稻土壤微生物群落的丰富度、优势度及种群分布均匀度的显著变化,但两基因型水稻的上述三种土壤微生物群落代谢功能多样性指数存在着年度和季节变化,这与Cotta等[24]的部分研究结果一致.
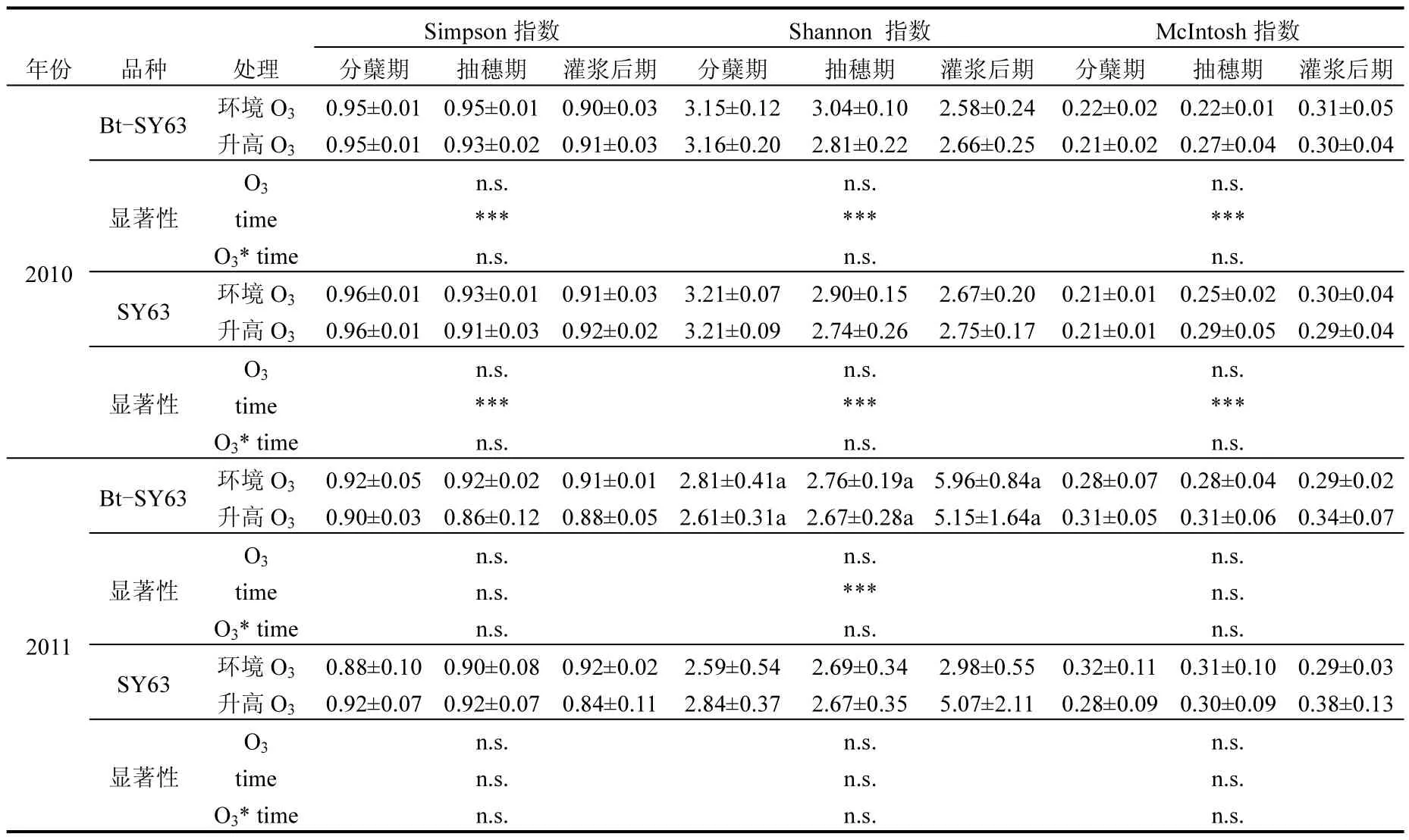
表2 2010年和2011年各生育期水稻根系土壤微生物代谢功能多样性指数Table 2 Functional diversity indices of rice soil microbial community at different growth stages during 2010-2011
2.4 土壤微生物群落碳源利用对O3浓度升高的响应
2.4.1 Bt-SY63水稻根系土壤微生物群落碳源利用对O3浓度升高的响应 通过对2010年和2011年各生育期转基因水稻Bt-SY63水稻根系土壤微生物群落碳源代谢72h时测定的AWCD值进行主成分分析(PCA)(图5),以此评价Bt-SY63两年不同处理中土壤微生物群落在碳源利用上的整体差异.
从图5看出,综合2010年和2011年两年6次采样情况,O3浓度升高和环境O3浓度下Bt-SY63稻田土壤样品在PC2轴上出现了明显的分异,环境O3浓度下土壤样品主要分布在PC2轴正方向,而O3浓度升高下土壤样品主要分布在PC2轴负方向,说明O3浓度升高对Bt-SY63稻田土壤微生物群落碳源基质利用的影响达到了显著性水平.此外,O3浓度升高下与环境O3浓度下的土壤样品分异距离随O3处理的时间逐渐增加.
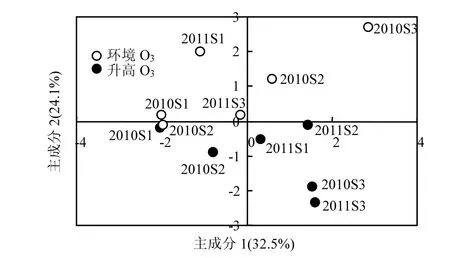
图5 2010~2011年不同处理的转基因水稻Bt-SY63土壤微生物群落碳源代谢的主成分分析Fig.5 Principal component analysis of carbon metabolism of soil microbial community in Bt-SY63 under ambient and elevated O3conditions at different growth stages during 2010-2011
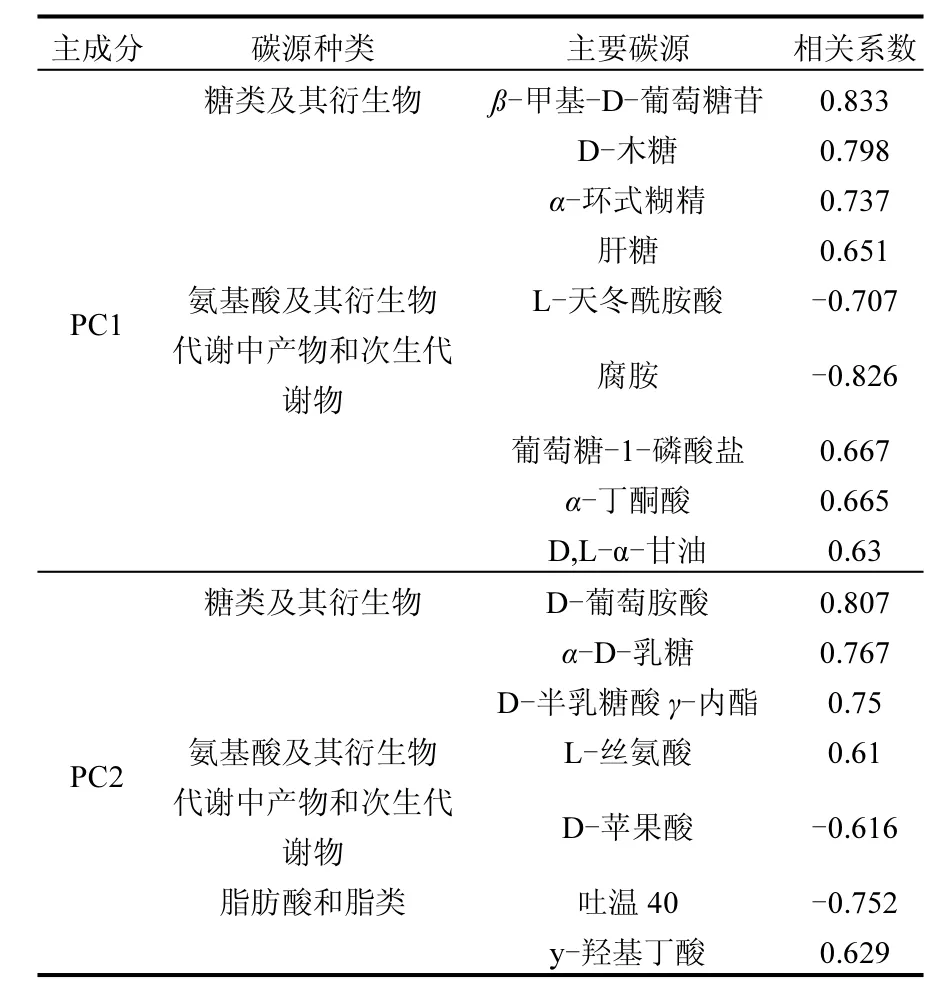
表3 2010年和2011年转基因水稻Bt-SY63土壤中与PC1和PC2显著相关的微生物主要利用碳源Table 3 Main carbon resources of soil microbial utilization related to PCA l and PCA 2 in Bt-SY63 during 2010-2011
通过比较O3浓度升高和环境O3浓度下Bt-SY63水稻土壤微生物群落对Biolog ECO平板中4类碳源的优先利用顺序,可以看出不同处理下Bt-SY63水稻土壤微生物群落碳源特异利用的情况.综合2010年和2011年两年6次采样,主成分1和主成分2中具有较高相关系数(︱r︱>0.6)的碳源见表3.
结合图5和表3可以看出, 环境O3浓度下Bt-SY63水稻土壤微生物群落对与主成分2正相关程度较高的碳源如糖类及其衍生物中的D-葡萄胺酸、α-D-乳糖、D-半乳糖酸γ-内酯,氨基酸及其衍生物中的L-丝氨酸,脂肪酸和脂类中的y-羟基丁酸等5种碳源具有相对高的利用能力,而O3浓度升高下Bt-SY63水稻土壤微生物群落对主成分2负相关程度较高的碳源如代谢中产物和次生代谢物中的D-苹果酸以及脂肪酸和脂类中的吐温40等2种碳源具有相对高的利用能力.
2.4.2 SY63水稻根系土壤微生物群落碳源利用对O3浓度升高的响应 对于常规水稻SY63,采用与转基因水稻Bt-SY63同样的方法对2010年和2011年各生育期水稻根系土壤微生物群落碳源代谢进行主成分分析(图6).
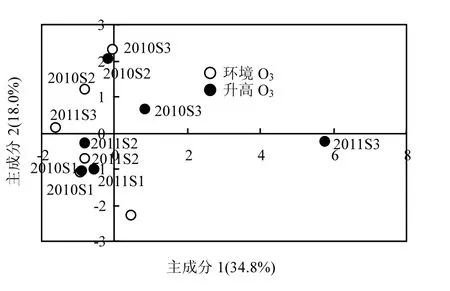
图6 2010~2011年不同处理的常规水稻SY63土壤微生物群落碳源代谢的主成分分析Fig.6 Principal component analysis of carbon metabolism of soil microbial community in SY63 under ambient and elevated O3conditions at different growth stages during 2010-2011
从图6中可看出,综合2010年和2011年两年6次采样情况,O3浓度升高和环境O3浓度下SY63稻田土壤样品无论是在PC1还是在轴PC2轴上都没有出现明显的分异,说明O3浓度升高对SY63稻田土壤微生物群落碳源基质的利用没有显著影响,碳源利用的种类没有偏好的选择.此外,O3浓度升高下与环境O3浓度下的土壤样品分异距离随O3处理的时间逐渐增加.
主成分分析可以在降维后的主元向量空间中,用点的位置直观地反映出不同O3处理中土壤微生物群落多样性变化.本研究的主成分分析表明O3浓度升高显著地影响了Bt-SY63稻田土壤微生物群落碳源基质的利用,碳源基质由糖类及其衍生物向代谢中产物和次生代谢物转变,这可能是由于受胁迫的植物根系分泌物的种类和数量均有改变的缘故,需要进一步研究[9].然而,O3浓度升高对SY63稻田土壤微生物群落碳源基质的利用没有显著影响,对碳源利用的种类也没有定向的选择.因此,从稻田土壤微生物群落对O3浓度升高的不同响应来看,Bt-SY63可能比SY63对高浓度O3更敏感,这一现象与可以从我们以前发现的“相对于O3胁迫对叶片超微结构造成的损伤而言,Bt-SY63比SY63对高浓度O3更敏感”[25]是一致的,即与SY63相比,Bt-SY63的生长发育更易受到O3胁迫的影响,导致Bt-SY63的根系分泌物的种类和数量更容易发生改变,从而间接影响了土壤微生物群落活性的变化.此外,主成分结果分析结合碳源利用谱结果分析发现,不论Bt-SY63还是SY63,同一年度不同生育期间和同一生育期不同年度间土壤微生物群落碳源利用种类的稳定性较差,土壤微生物群落的碳源利用种类存在着年度和季节变化,这可能也是Bt-SY63和SY63土壤微生物群落的丰富度、优势度及种群分布均匀度等三种多样性指数存在着年度和季节变化的原因之一.
土壤微生物群落对环境胁迫的响应通常先经环境扰动期,随时间推移可通过群落结构的改变或群落大小的改变亦或其他方面变化对环境胁迫产生适应性,来达到功能的逐渐恢复.Liu等[26]和Ruyters等[27]就曾发现氨氧化细菌是通过改变群落结构逐渐对重金属汞和锌污染产生了适应性,从而逐渐恢复了其硝化活性.本试验中观察到的O3浓度升高下与环境O3浓度下的两基因型水稻土壤样品主成分分析中分异距离随O3处理时间延长逐渐增加的现象,一方面说明了土壤微生物在群落碳源代谢功能上对O3浓度升高的响应与取样时土壤微生物相对于O3暴露所处的生理状态密切相关,即分蘖期取样,土壤微生物处于环境扰动状态,O3浓度升高下与环境O3浓度下其代谢方式尚无明显区分,分异距离小;随O3处理的时间延长,至灌浆后期,土壤微生物对O3暴露产生了适应性,与Ambient下相比,其代谢方式明显不同,分异距离也随之增加;另一方面也暗示土壤微生物群落对O3浓度升高的适应可能是通过改变了的群落结构来实现的.
BIOLOG技术虽常被用于研究土壤微生物群落功能,但是BIOLOG微平板只能表征土壤中生长快速或富营养微生物的活性,而不能反映土壤中生长缓慢或不可培养微生物活性,也不能对土壤真菌进行研究[28].因此, O3浓度升高对土壤微生物群落功能多样性影响的研究尚需进一步展开和长期跟踪研究.
3 结论
本文利用农田开放式O3浓度升高平台对2010年和2011年O3浓度升高和田间自然条件下转Bt基因水稻Bt-SY63及其常规水稻SY63根际土壤微生物群落功能多样性进行了研究,发现O3浓度升高使Bt-SY63和SY63水稻土壤微生物总体活性有降低的趋势,而未使两基因型水稻土壤微生物的丰富度、优势度和均一度发生显著变化.O3浓度升高使Bt-SY63土壤微生物碳源基质的利用方式由对糖类及其衍生物具有较强的利用能力转向对代谢中产物和次生代谢物具有较强的利用能力,而对SY63土壤微生物碳源基质的利用没有显著影响.因此,从稻田土壤微生物群落对O3浓度升高的不同响应来看,Bt-SY63可能比SY63更敏感.
[1] Kivimäenpää M, Sutinen S, Karlsson P E, et al. Cell structuralchanges in the needles of Norway spruce exposed to long-term ozone and drought [J]. Annal of Botany, 2003,92:779–793.
[2] Rai R, Agrawal M. Evaluation of physiological and biochemical responses of two rice (Oryza sativa L.) cultivars to ambient air pollution using open top chambers at a rural site in India [J]. Science of the Total Environment, 2008,407:679–691.
[3] Sarkar A, Agrawal S B. Elevated ozone and two modern wheat cultivars: an assessment of dose dependent sensitivity with respect to growth, reproductive and yield parameters [J]. Environmental and Experimental Botany, 2010a,69:328–337.
[4] Ashmore M R. Assessing the future global impacts of ozone on vegetation [J]. Plant Cell and Environment, 2005,28:949–964.
[5] Feng Z, Kobayashi K. Assessing the impacts of current and future concentrations of surface ozone on crop yield with meta-analysis [J]. Atmospheric Environment, 2009,43:1510–1519.
[6] Wang X K, Ning W M, Feng Z W, et al. Ground-level ozone in China: Distribution and effects on crop yields [J]. Environmental Pollution, 2007,147:394–400.
[7] Kanerva T, Palojärvi A, Rämö K, et al. Changes in soil microbial community structure under elevated tropospheric O3and CO2[J]. Soil Biology and Biochemistry, 2008,40:2502–2510.
[8] Fang R, Shi Y, Lu C Y, et al. Effects of elevated CO2and O3and N fertilization on amount of soil microbial biomass carbon in spring wheat growing season [J]. Procedia Environmental Sciences, 2011,8:34–39.
[9] Hofstra G., Ali A, Wukasch R T, et al. The rapid inhibition of root respiration after exposure of bean (Phaseolus vulgaris L.) plants to ozone [J]. Atmospheric Environment, 1981,15:483–487.
[10] Falkowski P G., Fenchel T, Delong E F. The microbial engines that drive Earth's biogeochemical cycles [J]. Science, 2008, 320(5879):1034–1039.
[11] Kasurinen A, Gonzales P K, Riikonen J, et al. Soil CO2efflux of two silver birch clones exposed to elevated CO2and O3during three growing seasons [J]. Global Change Biology, 2004,10: 1654–1665.
[12] Rischer H, Oksman-Caldentey K M. Unintended effects in genetically modified crops: revealed by metabolomics [J]? Trends in Biotechnology, 2006,24(3):102–104
[13] Wang H Y, Huang J Z, Ye Q F, et al. Modifed accumulation of selected heavy metals in Bt transgenic rice [J]. Journal of Environmental Sciences, 2009,211:607–1612.
[14] Zhou J, Ma Chenfei, Xu Honglin, et al. Metabolic profiling of transgenic rice with cryIAc and sck genes: An evaluation of unintended effects at metabolic level by using GC-FID and GC–MS [J]. Journal of Chromatography B, 2009,877:725–732.
[15] 朱丽霞,章家恩,刘文高,根系分泌物与根际微生物相互作用研究综述 [J]. 生态环境, 2003,12(1):102–105.
[16] Saxena D, Stewart C N, Illimar A, et al. Larvicidal Cry proteins from Bacillus thuringiensis are released in root exudates of transgenic B. thuringiensis corn, potato, and rice but not of B. thuringiensis canola, cotton, and tobacco [J]. Plant Physiology and Biochemistry, 2004,42:383–387.
[17] 姚艳玲,崔海瑞,卢美贞,等.转基因植物释放Bt毒素的土壤环境行为与生物学效应 [J]. 土壤学报, 2005,42(6):1024–1029.
[18] Shi G Y, Yang L X, Wang Y X, et al. Impact of elevated ozone concentration on yield of four Chinese rice cultivars under fully open-air field conditions [J]. Agriculture, Ecosystems and Environment, 2009,131(3/4):178-184.
[19] Blum U, Tingey D T. A study of the potential ways in which ozone could reduce root growth and nodulation of soybean [J]. Atmospheric Environment, 1977,11:737–739.
[20] Zak D R, Pregitzer K S, King J S, et al. Elevated atmospheric CO2, fine roots and the response of soil microorganisms: a review and hypothesis [J]. New Phytologist, 2000,147:201–222.
[21] Andersen C P. Source-sink balance and carbon allocation below ground in plants exposed to ozone [J]. New Phytologist, 2003,157: 213–228.
[22] McCrady J K, Andersen C P. The effect of ozone on belowground carbon allocation in wheat [J]. Environmental Pollution, 2000,107:465–472.
[23] Avery L M, Hill P W, Killham K, et al. Escherichia coli O157 survival following the surface and sub-surface application of contaminated organic waste to soil [J]. Soil Biology and Biochemistry, 2004,36:2102–2103.
[24] Cotta S R, Dias A C F, Marriel I E, et al. Temporal dynamics of microbial communities in the rhizosphere of two genetically modified (GM) maize hybrids in tropical agrosystems [J]. Antonie van Leeuwenhoek, 2013,103:589–601.
[25] Li C Y, Liu B, Li C H, et al. Leaf morphology and ultrastructure responses to elevated O3in transgenic Bt (cry1Ab/cry1Ac) rice and conventional rice under fully open-air field conditions [J]. PLoS ONE, 2013,8(12):e82199.
[26] Liu Y R, Zheng Y M, Shen ,J P, et al. Effects of mercury on the activity and community composition of soil ammonia oxidizers [J]. Environmental Science and Pollution Research, 2010,17(6): 1237-1244.
[27] Ruyters S, Mertens J, Teyen I, et al. Dynamics of the nitrous oxide reducing community during adaptation to Zn stress in soil [J]. Soil Biology and Biochemistry, 2010a,42(9):1581-1587.
[28] Li C G, Li X M. Wang J G. Effect of soybean continuous cropping on bulk and rhizosphere soil microbial community function [J]. Acta Ecologica Sinica, 2006,26(4):1144–1150.
Responses to elevated O3of soil microbial diversity from transgenic Bt rice.
LI Chun-yan1,2,3, LIU Biao2*, HAN Zheng-min1, ZENG Qing4, LI Chun-hua4, ZHU Jian-guo4(1.Key Biosafety Laboratory in Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210042, China;2.College of Forest Resources and Environment, Nanjing Forestry University, Nanjing 210037, China;3.Liaoning Agricultural College, Yingkou 115009, China;4.State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Sciences, Chinese Academy of Sciences, Nanjing 210008, China). China Environmental Science, 2014,34(11):2922~2930
Using a free-air concentration enrichment (FACE) system, field studies were conducted on functional diversity of soil microbial community from two rice lines, transgenic Bt Shanyou 63 (Bt-SY63) and its non-transgenic counterpart (SY63), in elevated O3(E-O3) versus ambient O3(A-O3) condition during 2010~2011. The results indicated that the AWCD (average well colour development) values of Bt-SY63 and SY63 tended to decrease as O3increased. No significant ozone effects (P > 0.05) were detected on Simpson, Shannon and McIntosh indices of functional diversity of the soil microbial communities in Bt-SY63 and SY63. Edaphon’s ability to utilize the substrates of some specific carbon resources was significantly affected (P < 0.05) by E-O3in Bt-SY63 from the original carbohydrates and their derivants to the metabolic mediates and secondary metabolites, whereas SY63 was not significantly affected (P < 0.05) by E-O3. The results suggested that Bt-SY63 might be more sensitive to E-O3than SY63 with respect to the different responses to E-O3in the soil microbial community.
elevated O3;O3-FACE;transgenic Bt rice;soil microbial;functional diversity
X172
A
1000-6923(2014)11-2922-09
李春艳(1973-),女,内蒙古通辽人,副教授,博士,主要从事生物安全及环境微生物研究.发表论文20余篇.
2014-02-26
转基因新品种培育重大科技专项(2014ZX08012-005);国家自然科学基金(31370544);南京林业大学优秀博士学位论文创新基金项目(2011YB009);江苏省普通高校研究生科研创新计划资助项目(CXZZ11_0504);中国科学院知识创新方向项目(KZCX2-EW-414).
* 责任作者, 研究员, 85287064@163.com

