水体冻结过程中卤乙酸前体物在水-冰体系中的分配研究
薛 爽,陈 静,铁 梅,惠秀娟,张丽娜,张 营 (辽宁大学环境学院,辽宁 沈阳 110036)
水体冻结过程中卤乙酸前体物在水-冰体系中的分配研究
薛 爽,陈 静,铁 梅*,惠秀娟,张丽娜,张 营 (辽宁大学环境学院,辽宁 沈阳 110036)
通过室内模拟试验,研究了水体冻结过程中,水体中溶解性有机物(DOM)和卤乙酸前体物在水-冰体系中的分配规律.按照DOM在XAD树脂上的吸附特性将其分为5个部分:疏水性有机酸(HPO-A),疏水性中性有机物(HPO-N),过渡亲水性有机酸(TPI-A),过渡亲水性中性有机物(TPI-N)和亲水性有机物(HPI).结果表明:在水体冻结过程中,5种DOM组分在水相中的DOC浓度均随冷冻时间的增长而增加,呈现冷冻浓缩效应.与溶解性有机碳(DOC)所表征的整体有机物相比,5种DOM组分中的卤乙酸(HAAs)前体物更倾向于停留在水相中浓缩.在5种DOM组分中,HPI是主要的HAAs前体物.5种DOM组分在未冻结水中的UV-254与HAAFP均表现出一定相关性,其中HPO-A, TPI-A和HPI的UV-254与HAAFP达到极显著水平.然而在融冰水中,这5种DOM组分的UV-254与HAAFP的相关性均不显著.
冻结;溶解性有机物;分级;紫外光谱;卤乙酸前体物
我国北方地区每年11月份江河水面开始结冻,约在11月下旬水面形成冰盖,由畅流期转为冰封期[1].冰封期河流由于受水流量小,冰层覆盖水体自净能力下降等影响,出现水质严重恶化的情况[2-3].在水体冻结过程中,污染物质不可避免地会进入冰层,从而对水体中污染物质的浓度和总量产生显著影响.在第二年冰层融化时会释放污染物质,对水质产生威胁.因此研究水体冻结过程中污染物质在水-冰体系中的分配规律对于准确掌握冰封期和融冰期河流中的污染物质动态,以及实施有效的水质控制具有重要的理论意义和实用价值.目前关于污染物质在水-冰体系中的环境行为虽然相对研究较少,但从不同方面仍有成果报道.Nomura等[4]考察了海冰融化时溶解性无机碳在冰中和冰下海水中的变化情况.黄继国等[5]研究了长春市南湖冰封期间,冰和水中营养盐、叶绿素a和藻类的浓度变化.李志军等[6]研究了硝基苯在水-冰两相间的迁移情况.然而,目前关于溶解性有机物(DOM)在水-冰体系中的迁移转化规律却基本处于空白.DOM是原水中色、嗅、味的主要来源,在很大程度上影响着水质的感官指标[7-8].在消毒过程中,DOM会和氯反应生成三卤甲烷(THMs)、卤乙酸(HAAs)、卤乙腈(HANs)等消毒副产物(DBPs)[9-11].在DBPs的总致癌风险中,HAAs的致癌风险占91.9%以上,构成DBPs的致癌风险首要因素[12].DOM的组成非常复杂,一直以来没有恰当的方法对DOM进行完全的逐一分析.近年发展起来的 XAD树脂吸附分级法为研究有机物不同组分的特性提供了一种有效手段[13].本研究以浑河河水为研究对象,考察了水体冻结过程中,DOM组分和HAAs前体物在水-冰体系中的分配规律.
1 材料与方法
1.1 试验水质分析
于2012年4月27日采集浑河河水,采样地点设置在东陵大桥.所采集水样的水质情况见表1.
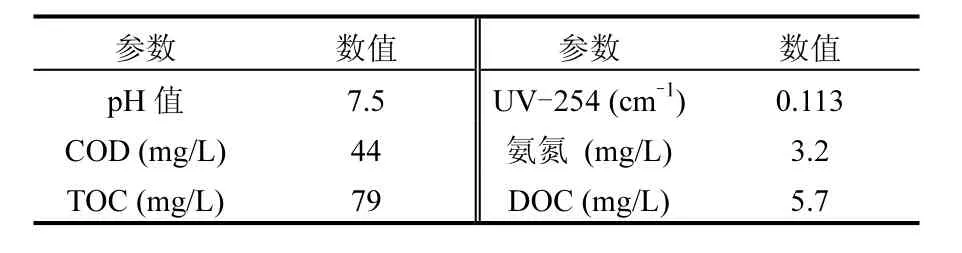
表1 浑河河水的水质情况Table 1 Water quality data for Hunhe River
1.2 水体冻结试验
河流的结冰过程是从水体表面开始,而河道两侧和河底的介质为土壤,可假定为绝热.因此,为了使水体冻结试验接近河流的实际结冰效果[14],采用冰柜作为冷却装置,并用聚苯乙烯泡沫塑料做成保温装置,保温装置内设6个圆柱形凹槽(高度:100cm,直径:5cm).将水样用0.45µm滤膜过滤后,装入6个圆柱形塑料瓶(高度:100cm,直径:5cm,底部设有取样口)中,每瓶装入水样1.8L.将塑料瓶放入保温装置的圆柱形凹槽中,进行水体冻结试验.塑料瓶四周和底部的接触介质为聚苯乙烯泡沫塑料,仅从顶部接受冷气,从而避免水样从四周和底部损失热量,以起到更好的保温效果.试验温度设为-25℃.试验过程中,定时(取样时间为36, 48, 60, 72, 84, 96h.在96h时,水样达到完全冻结状态)取出1个塑料瓶,将瓶中未冻结的水样从瓶底部的取样口倒出,然后使塑料瓶中的冰样在室温(约15℃)条件下自然融化,收集融化后的水样(融冰水样).测定未冻结水样和融冰水样的溶解性有机碳(DOC)浓度,UV-254和卤乙酸生成势(HAAFP).
1.3 DOM的分级分离
水样经过0.45µm滤膜过滤后,依次通过串联的XAD-8和XAD-4树脂柱,按其在不同树脂上的吸附特性将其分为疏水性有机酸(HPO-A),疏水性中性有机物(HPO-N),过渡亲水性有机酸(TPI-A),过渡亲水性中性有机物(TPI-N)和亲水性有机物(HPI)等5种组分[15].
1.4 HAAFP的测定
HAAFP是指在保证加氯量足够的条件下,与氯反应足够长的时间后,水样中所能产生的5种HAAs,包括一氯乙酸(MCAA),二氯乙酸(DCAA),三氯乙酸(TCAA),一溴乙酸(MBAA),二溴乙酸(DBAA))的最大量.具体测定步骤为:将水样用高纯水(Milli-Q water)稀释至DOC为1.0mg/L,并加磷酸缓冲液调节水样pH值为7.0±0.1;然后向水样中加入NaClO进行氯化, NaClO的投加量按公式[Cl2]=(3×[DOC])+(7.5× [NH4+])计算确定[16].加盖后将水样放入(20.0± 0.5)℃的生化培养箱中,在避光条件下,放置120h, 120h后用硫代硫酸钠终止反应,并马上进行HAAs的测定[17].
1.5 分析方法
DOC采用Shimadou TOC-5000型总有机碳分析仪测定.UV-254采用Cary 50型紫外-可见分光光度计测定.HAAs采用C7-3800型气象色谱仪测定.
2 结果与分析
2.1 DOM组分在水,冰两相中的DOC
在水体冻结过程中,未冻结水与融冰水中的DOC浓度随冷冻时间的变化如图1所示.未冻结前,HPO-A, HPO-N, TPI-A, TPI-N, HPI水样的DOC浓度分别为1.11, 1.08, 0.97, 1.17, 1.69mg/L.由图1(a)可知,在水体冻结过程中,未冻结水中5种DOM组分的DOC浓度都是随着冷冻时间的增加而增加的,呈现出冷冻浓缩效应.由图1(b)可知,在水体冻结过程中,融冰水中HPO-A, HPO-N, TPI-A, TPI-N, HPI的DOC浓度分别在0.49~1.07, 0.23~1.01, 0.38~0.95, 0.28~1.05, 0.24~1.63mg/L范围之内.冷冻时间为36h时,融冰水中HPO-A, HPO-N, TPI-A, TPI-N, HPI的DOC浓度分别为0.76, 0.42, 0.45, 0.43, 0.53mg/L;随着冷冻时间的延长,冰层厚度增加,当冷冻时间为36~60h时,这5种组分在融冰水中的DOC浓度下降;当冷冻时间为60~96h时,这5种组分在融冰水中的DOC浓度则开始升高.在水体冻结的初始阶段(0~36h), HPO-A, HPO-N, TPI-A, TPI-N, HPI在冰相中的DOC浓度较高,但随着冷冻时间的延长,冰层厚度增加,此时冷能通过冰层更平稳地传递[18],从而有利于水分子有规则地结晶,并将这5种DOM组分排斥到水相中,因此融冰水中DOC浓度降低.当继续延长冷冻时间时,未冻结水中DOC浓度增加.这是由于在冻结过程中,晶核形成速率与溶质浓度成正比,溶液中的潜在晶核随着溶液浓度的提高而随之增多[19],液体黏性增大,扩散系数减小,因此增加了二次成核概率,冰晶生长速度增快,致使固-液界面稳定性随之下降,冰晶的夹带量增多,因此在这种条件下未冻结水中的5种DOM组分就可能有部分被包裹进冰层中,形成“包夹”,从而导致融冰水中的DOC浓度升高.
由图1(b)还可以发现,在冷冻时间为84~96h时,HPO-A, HPO-N, TPI-A, TPI-N, HPI 的DOC浓度都有一个快速上升的过程.这5种组分在对应于冷冻时间96h的融冰水中的浓度分别是1.07, 1.01, 0.95, 1.05, 1.63mg/L,都分别接近于这5种组分未冻结前的DOC浓度.这是因为在冷冻时间96h时,这5种组分的水样达到完全冻结状态,此时水相中的DOM组分全部转入冰相中,所以融冰水中DOC浓度接近于未冻结前的浓度.同时,这5种组分在对应于冷冻时间96h的融冰水中的浓度都略低于未冻结前的浓度.Spencer等[20]发现地表水经过冷冻之后DOC浓度下降了约10%,他们认为DOC浓度的降低是由于冻融作用对DOM结构的改变所致.
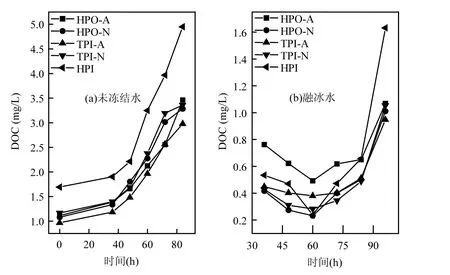
图1 未冻结水与融冰水中DOM组分的DOC随冷冻时间的变化Fig.1 DOC for DOM fractions in unfrozen liquid samples and melted ice samples as a function of freezing time
2.2 DOM组分在水,冰两相中的UV-254
UV-254常用来表征DOM中芳香族C=C的含量,因为含有取代基的苯环和多酚中的π→π*跃迁就发生在该处[21-22].
图2为DOM组分在未冻结水和融冰水中的UV-254随冷冻时间的变化情况.由图2(a)可知,未冻结水中5种DOM组分的UV-254值都随着冷冻时间的增加而增加.这就说明在水体冻结过程中,这5种DOM组分中的芳香性物质发生冷冻浓缩效应.许多研究者认为,单位浓度DOC在紫外254nm处的吸光度值SUVA可以反映有机物的芳香性[23],SUVA 由(UV-254/DOC)×100计算得出[24].未冻结前,HPO-A的SUVA值最高,为4.76L/(m·mg),其次是TPI-A和HPI,分别是2.37L/(m·mg)和1.61L/(m·mg).而HPO-N与TPI-N的SUVA值较低,分别为0.61L/(m·mg)和0.75L/(m·mg).说明在这5种DOM组分中, HPO-A的芳香性最高,而HPO-N与TPI-N的芳香性较低.由图2(a)还可以看出,在整个水体冻结过程中,随着冷冻时间的增加,HPO-A与TPI-A的变化幅度比较明显,而HPO-N, TPI-N, HPI的变化趋势比较平缓,这说明在水体冻结过程中,芳香性较强的物质更难于进入冰相,而是停留在水相中浓缩.Fellman等[25]通过对阿拉斯加东南部水体采样进行冷冻研究发现,冷冻不仅对DOM有浓缩效应,而且芳香性较大的DOM更容易沉淀析出.
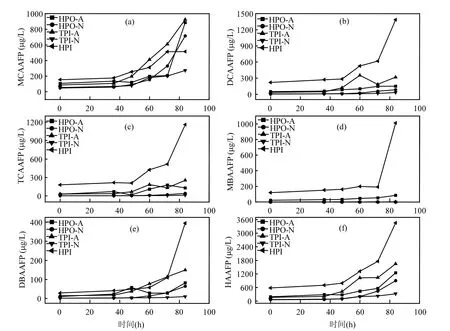
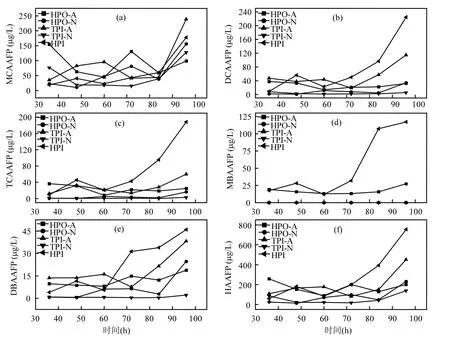
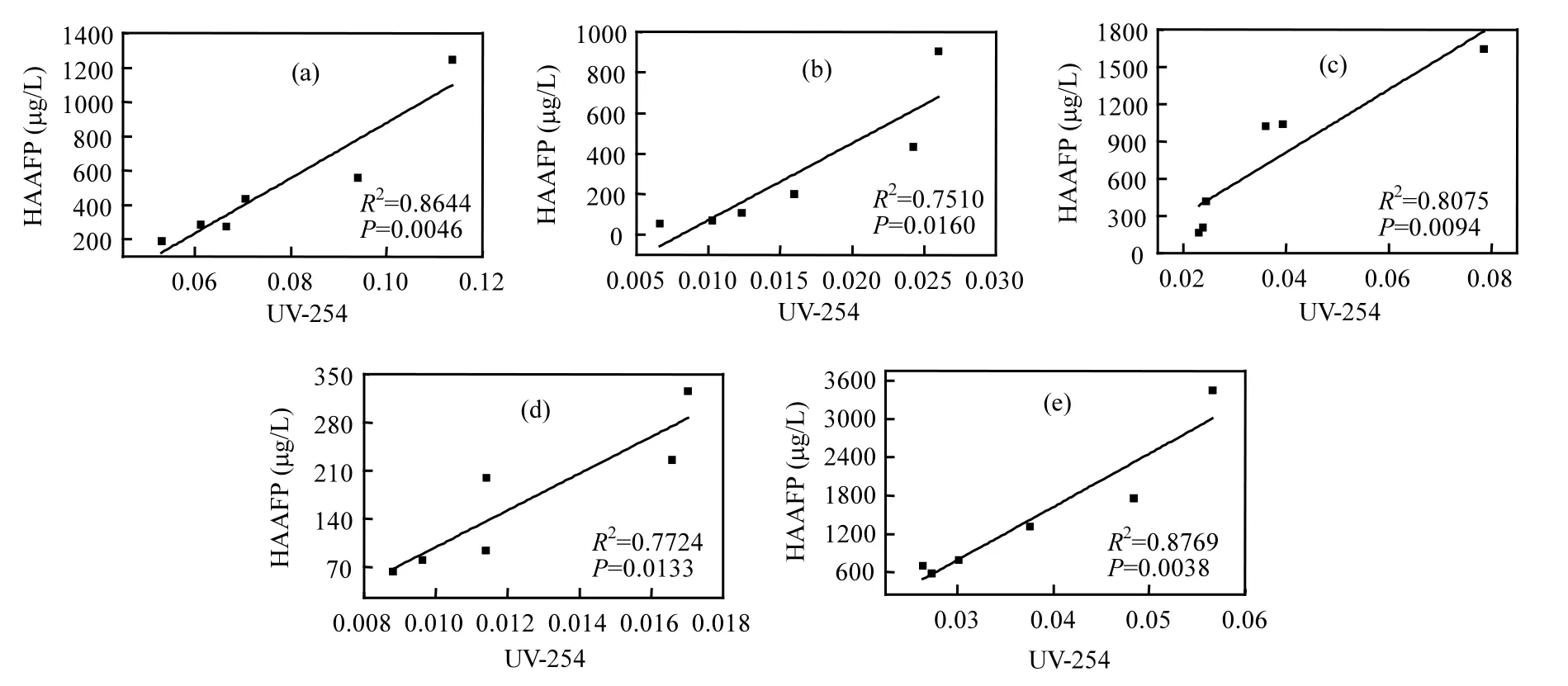
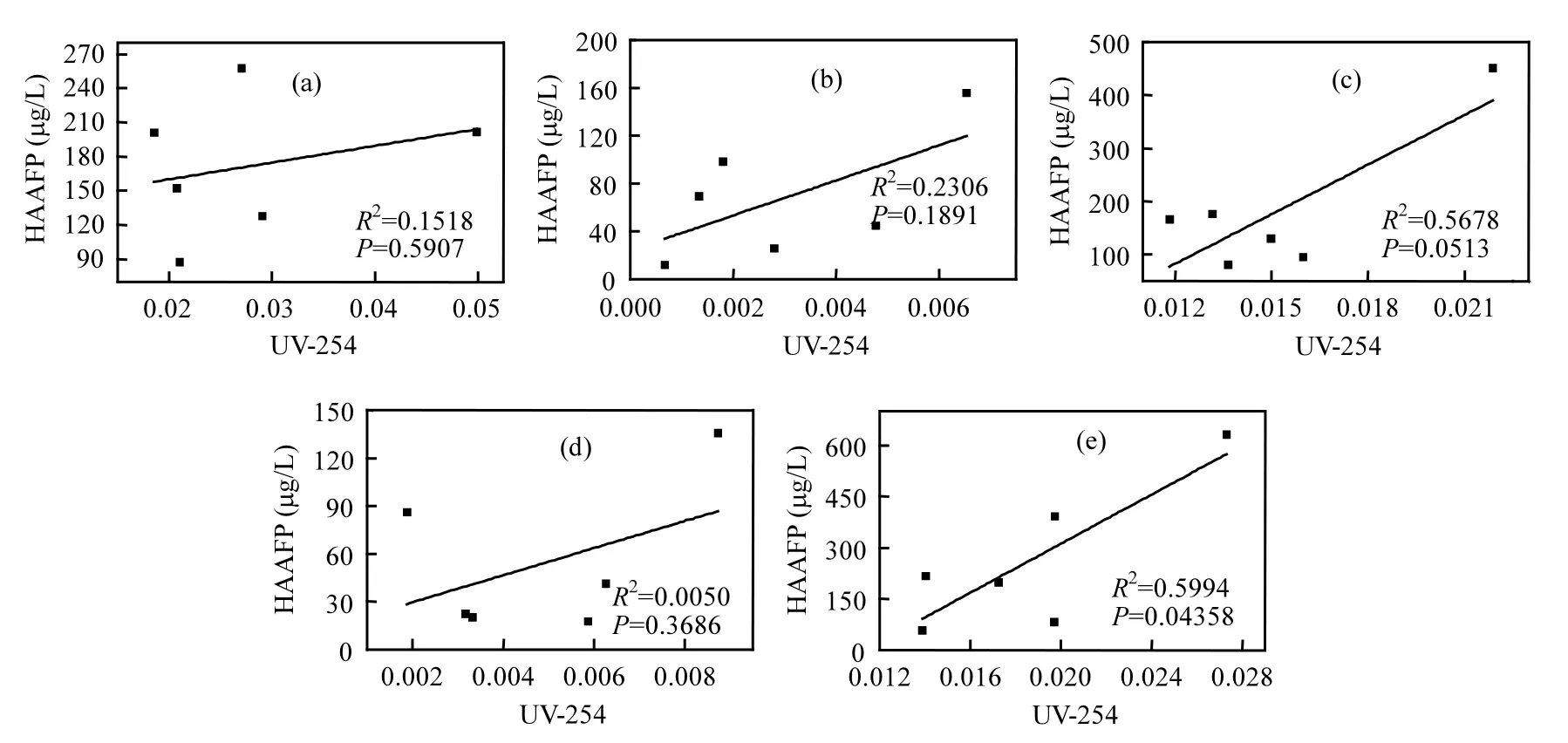
由图2(b)可以看出,5种DOM组分在融冰水中的UV-254的变化趋势未表现出一致性.本研究中DOM组分是根据其在XAD-8/XAD-4 树脂上的选择吸附性进行富集和分离的.HPO-A是吸附在XAD-8树脂上的疏水性酸性物质,主要是含有C5~C9的脂肪族羧酸,及1~2个环的芳香酸和酚类;HPO-N是吸附在XAD-8树脂上的疏水性中性物质,主要是>C9的脂肪酸和胺及>C3的芳香酸和胺;TPI-A是吸附在XAD-4树脂上的过渡亲水性酸性物质,其主要成分为多聚糖;TPI-N是吸附在XAD-4树脂上的过渡亲水性中性物质,几乎全是蛋白质类物质;HPI是既不吸附在XAD-8树脂上也不吸附在XAD-4 树脂上的亲水性物质,结构简单、分子量较小,主要包括 图2 未冻结水与融冰水中DOM组分的UV-254值随冷冻时间的变化Fig.2 UV-254 values for DOM fractions in unfrozen liquid samples and melted ice samples as a function of freezing time 2.3 DOM组分在水,冰两相中的HAAFP 水体中HAAs前体物的含量通常用HAAFP来表征.由图3可知,未冻结前,HPO-A,TPI-A和HPI的一氯乙酸生成势(MCAAFP),二氯乙酸生成势(DCAAFP),三氯乙酸生成势(TCAAFP),二溴乙酸生成势(DBAAFP)以及HAAFP均高于HPO-N和TPI-N,这说明在5种DOM组分中,中性组分对HAAs前体物的贡献较小.一溴乙酸生成势(MBAAFP)只在HPI和HPO-A水样中被检测到.如图3所示,5种DOM组分在未冻结水中的MCAAFP, DCAAFP, TCAAFP, MBAAFP, DBAAFP以及HAAFP均随着冷冻时间的增长而增加. HPO-A, HPO-N, TPI-A, TPI-N, HPI这5种DOM组分未冻结前的HAAFP分别为191.0, 56.2, 164.1, 63.2, 577.4µg/L.冷冻时间为84h时,这5种DOM组分在未冻结水中的HAAFP分别达到1248.5, 903.9, 1643.7, 326.0, 3452.8µg/L,分别是未冻结前HAAFP的6.5, 16.1, 10.0, 5.2和6.0倍.而5种组分的相应DOC浓缩倍数分别为3.1, 3.0, 3.1, 2.9和2.9.这说明与DOC所表征的整体有机物相比,5种组分中的HAAs前体物在水体冻结过程中更倾向于停留在水相中浓缩.在整个水体冻结过程中,HPI的HAAFP在5种组分中最高,说明在DOM组分中,HPI是主要的HAAs前体物. 图3 未冻结水中DOM组分的MCAAFP, DCAAFP, TCAAFP, MBAAFP, DBAAFP和HAAFP随冷冻时间的变化Fig.3 MCAAFP, DCAAFP, TCAAFP, MBAAFP, DBAAFP and HAAFP for DOM fractions in unfrozen liquid samples as a function of freezing time 由图4可知,DOM组分在融冰水中的MCAAFP, MBAAFP, DCAAFP, TCAAFP, DBAAFP以及HAAFP随冷冻时间的增长呈现出总体上升的趋势(HPO-N, TPI-A, TPI-N的融冰水中未检测出MBAAFP).这是由于冷冻浓缩效应[30-31],HAAs在水体冻结过程中,被水分子排斥,不易进入冰相,从而使得水相中HAAs前体物浓度增加,使得潜在晶核增多,增加二次成核的概率,导致冰晶的生长速度加快,生成树枝状冰晶,由于水-冰相界面处的浓度很大,部分HAAs前体物来不及“逃逸”,被包含在冰晶中[19,30].直到水体完全冻结(冷冻时间为96h), HAAs前体物全部进入冰相.然而在整个水体冻结过程中,DOM组分在融冰水中的MCAAFP, MBAAFP, DCAAFP, TCAAFP, DBAAFP以及HAAFP随冷冻时间的变化存在忽高忽低的变化,这可能是由于冻融效应和冻结时间的影响,使得这5种DOM组分在融冰水中的5种HAAs前体物的变化趋势较复杂,并且缺乏一致性. 图4 融冰水中DOM组分的MCAAFP, DCAAFP, TCAAFP, MBAAFP, DBAAFP和HAAFP随冷冻时间的变化Fig.4 MCAAFP, DCAAFP,TCAAFP, MBAAFP, DBAAFP and HAAFP for DOM fractions in melted ice samples as a function of freezing time 2.4 DOM组分的UV-254与HAAFP的相关性分析 由于UV-254与THMFP有较好的相关性,因此UV-254常被作为THMs前体物的替代参数[32].为确定UV-254能否作为水-冰体系中HAAs前体物的替代参数,本研究分别对5种DOM组分的未冻结水样和融冰水样进行UV-254与HAAFP的相关性分析(图5,图6). 由图5可知,在未冻结水中,HPO-A, HPON, TPI-A, TPI-N, HPI的UV-254与HAAFP的线性相关系数分别为0.86, 0.75, 0.81, 0.78, 0.88,即5种DOM组分的UV-254与HAAFP均有一定的相关性,且HPO-A, TPI-A和HPI的UV-254与HAAFP达到极显著的线性相关关系(P<0.01).由此可见,DOM组分中的芳香性有机物是主要的HAAs前体物.这与Chin等[33]的研究一致. 然而在融冰水中,这5种DOM组分的UV-254与HAAFP的相关性均不显著(图6).Spencer等[20]的研究表明冻融改变了DOM的结构和光谱学特性.本研究中的融冰水样均经过了冻结和融化过程,所有融冰水样的融化条件相同,但是冻结时间不同.由图2和图3可以看出,对于5种DOM组分来说,水样完全冻结后得到的融冰水样(冷冻时间为96h)中的UV-254和HAAFP均不同于未冻结前的水样,说明冻融改变了DOM组分的UV-254和HAAFP.并且冻结时间不同,对DOM组分的UV-254和HAAFP的改变程度不同,导致融冰水中5种DOM组分的UV-254与HAAFP的的线性相关不明显. 图5 未冻结水中HPO-A, HPO-N, TPI-A, TPI-N和HPI的HAAFP与UV-254的相关性Fig.5 Correlations between HAAFP and UV-254for HPO-A, HPO-N, TPI-A, TPI-N and HPI in unfrozen liquid samples 图6 融冰水中HPO-A, HPO-N, TPI-A, TPI-N和HPI的HAAFP与UV-254的相关性Fig.6 Correlations between HAAFP and UV-254for HPO-A, HPO-N, TPI-A, TPI-N and HPI in melted ice samples 3.1 在水体冻结过程中,5种DOM组分在水相中的DOC浓度均随冷冻时间的增长而增加,呈现冷冻浓缩效应.并且,与DOC所表征的整体有机物相比,5种DOM组分中的HAAs前体物更倾向于停留在水相中浓缩.在5种DOM组分中,HPI是主要的HAAs前体物. 3.2 5种DOM组分在未冻结水中的UV-254与 HAAFP均表现出一定的相关性,其中HPO-A, TPI-A和HPI的UV-254与HAAFP达到极显著的线性相关水平.然而在融冰水中,5种DOM组分的UV-254与HAAFP的相关性均不显著. [1] 王宪恩,董德明,赵文晋,等.冰封期河流中有机污染物削减模式[J]. 吉林大学学报(理学版), 2003,41(3):392-395. [2] 黄曼君,李明玉,任 刚,等.PFS-PDM复合混凝剂对微污染河水的强化混凝处理 [J]. 中国环境科学, 2011,31(3):384-389. [3] 郑秋红,伍永秋,张永光.冰封期河流中污染物损耗估算模型 [J].北京师范大学学报(自然科学版), 2006,42(6):615-617. [4] Nomura D, Takatsuka T, Ishikawa M, et al. Transport of chemical components in sea ice and under-ice water during melting in the seasonally ice-covered Saroma-ko Lagoon, Hokkaido, Japan [J]. Estuarine, Coastal and Shelf Science, 2009,81(2):201-209. [5] 黄继国,傅鑫廷,王雪松,等.湖水冰封期营养盐及浮游植物的分布特征 [J]. 环境科学学报, 2009,29(8):1678-1683. [6] 李志军,王 昕,李青山,等.不同条件下硝基苯在水-冰体系中的分配研究 [J]. 中国科学(E辑:技术科学), 2008,38(7):1131-1138. [7] 郭 瑾,马 军.天然有机物提取及表征技术近期发展动态 [J].现代化工, 2007,27(2):12-16. [8] 付 军,滕曼,肖 华.不同管材对氯胺消毒副产物生成与水质生物稳定性的影响 [J]. 中国环境科学, 2010,30(9):1189-1194. [9] Marhaba T F, Mangmeechai A, Chaiwatpongsakorn C, et al. Trihalomethanes formation potential of shrimp farm effluents [J]. Journal of Hazardous Materials, 2006,136(2):151-163. [10] 李伟光,安 东,崔福义,等.生物降解与吸附作用协同去除卤乙酸生成势 [J]. 中国环境科学, 2005,25(1):61-64. [11] 孟丽苹,董兆敏,胡建英.全国自来水厂卤乙酸浓度调查,风险评估与标准建议 [J]. 中国环境科学, 2012,32(4):721-726. [12] Uyak V, Ozdemir K, Toroz I. Multiple linear regression modeling of disinfection by-products formation in Istanbul drinking water reservoirs [J]. Science of the Total Environment, 2007,378(3):269-280. [13] Leenheer J A, Croué J P. Peer reviewed: characterizing aquatic dissolved organic matter [J]. Environmental Science and Technology, 2003,37(1):18A-26A. [14] 姜慧琴.乌梁素海营养盐在冰体中的空间分布及其在冻融过程中释放规律的试验研究 [D]. 呼和浩特:内蒙古农业大学, 2011. [15] Aiken G, McKnight D, Thorn K., et al. Isolation of hydrophilic organic acids from water using nonionic macroporous resins [J]. Organic Geochemistry, 1992,18(4):567-573. [16] Kwon B, Lee S, Cho J, et al. Biodegradability, DBP formation, and membrane fouling potential of natural organic matter: Characterization and controllability [J]. Environ. Sci. Technol., 2005,39(3):732-739. [17] USEPA. Method 552.3Determination of haloacetic acids and dalapon in drinking water by liquid-liquid microextraction derivatization, and gas chromatography with electron capture detection [S]. 2003. [18] 余海静.自然冷冻法在污水处理中的应用研究 [J]. 水处理技术, 2012,38(3):107-110. [19] Mizuike A. Enrichment techniques for inorganic trace analysis [M]. United States: Springer-Verlag Berlin and Heidelberg, New York, 1983. [20] Spencer R G, Bolton L, Baker A. Freeze/thaw and pH effects on freshwater dissolved organic matter fluorescence and absorbance properties from a number of UK locations [J]. Water Research, 2007,41(13):2941-2950. [21] Fuentes M, González-Gaitano G, García-Mina J M. The usefulness of UV–visible and fluorescence spectroscopies to study the chemical nature of humic substances from soils and composts [J]. Organic Geochemistry, 2006,37(12):1949-1959. [22] 宋亚丽,董秉直,高乃云.不同氧化剂降低膜污染效果的研究 [J].中国环境科学, 2009,29(1):11-16. [23] Edzwald J K, Tobiason J E. Enhanced coagulation: US requirements and a broader view [J]. Water Science and Technology, 1999,40(4):63-70. [24] Reckhow D A, Singer P C, Malcolm R L. Chlorination of humicmaterials: byproduct formation and chemical interpretations [J]. Environmental Science and Technology, 1990,24:1655-1664. [25] Fellman J B, D'Amore D V, Hood E. An evaluation of freezing as a preservation technique for analyzing dissolved organic C, N and P in surface water samples [J]. Science of the Total Environment, 2008,392(2/3):305-312. [26] Barber L B, Leenheer J A, Noyes T I, et al. Nature and transformation of dissolved organic matter in treatment wetlands [J]. Environ. Sci. Technol., 2001,35(24):4805-4816. [27] Chow A T, Guo F, Gao S, et al. Size and XAD fractionations of trihalomethane precursors from soils [J]. Chemosphere, 2006, 62(10):1636-1646. [28] 王立英,吴丰昌,张润宇.应用XAD系列树脂分离和富集天然水体中溶解有机质的研究进展 [J]. 地球与环境, 2006,34(1):90-96. [29] Chen J, Gu B, LeBoeuf E J, et al. Spectroscopic characterization of the structural and functional properties of natural organic matter fractions [J]. Chemosphere, 2002,48(1):59-68. [30] Gao W, Smith D, Sego D. Release of contaminants from melting spray ice of industrial wastewaters [J]. Journal of Cold Regions Engineering, 2004,18(1):35-51. [31] Daigger G T, Bailey E. Improving aerobic digestion by prethickening, staged operation, and aerobic-anoxic operation: Four full-scale demonstrations [J]. Wat. Environ. Res., 2000, 72(3):260-270. [32] Chellam S, Krasner S W. Disinfection byproduct relationships and speciation in chlorinated nanofiltered waters [J]. Environ. Sci. Technol., 2001,35(19):3988-3999. [33] Chin Y P, Aiken G., O'Loughlin E. Molecular weight, polydispersity, and spectroscopic properties of aquatic humic substances [J]. Environ. Sci. Technol., 1994, 28(11):1853-1858. Ratio of haloacetic acids precursor in water-ice system during the freezing processes of water. XUE Shuang, CHEN Jing, TIE Mei*, HUI Xiu-juan, ZHANG Li-na, ZHANG Ying (School of Environmental Science, Liaoning University, Shenyang 110036, China). China Environmental Scenice, 2014,34(11):2773~2780 It was studied the partition of dissolved organic matter (DOM) fractions and haloacetic acids (HAAs) precursors in water-ice system during the freezing processes of water by the indoor simulating tests. DOM was fractionated using XAD resins into five fractions: hydrophobic acid (HPO-A), hydrophobic neutral (HPO-N), transphilic acid (TPI-A), transphilic neutral (TPI-N) and hydrophilic fraction (HPI). The results showed that the freezing rate of water samples containing acid fractions wove higher than samples containing neutral fractions. DOC concentrations for five DOM fractions in liquid phase increased with freezing time, presenting the freeze-concentration effect, during the freezing processes of water. HAAs precursors were more liable to be concentrated in liquid phase, as compared with the bulk DOM represented by dissolved organic carbon (DOC). HPI, among the five DOM fractions, was the main HAAs precursors. There was significant correlation between UV-254 and HAAFP for five DOM fractions in unfrozen liquid samples. Moreover, for HPO-A, TPI-A and HPI achieved very significant linear correlation. However, there was no significant correlation between UV-254 and HAAFP for all five DOM fractions in melted ice samples. freeze;dissolved organic matter;fractionation;ultraviolet spectroscopy;haloacetic acids precursors X703,TU992 A 1000-6923(2014)11-2773-08 薛 爽(1977-),女,副教授,博士,河南洛阳人,主要研究方向为低温条件下污染物的地球化学行为.发表论文30余篇. 2013-12-31 国家自然科学基金(21107039);辽宁省教育厅项目(L2011002);辽宁省科学技术计划项目(2011230009) * 责任作者, 教授, ldxslw666@126.com.cn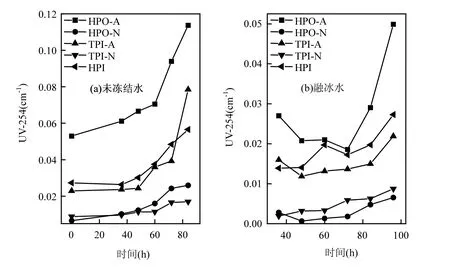
3 结论

