零价纳米铁吸附去除水中六价铬的研究
秦泽敏,董黎明,刘 平,周恋彤(.北京工商大学环境科学与工程系,北京 00048;2.神华准格尔能源有限责任公司,内蒙古 呼和浩特 00300;3.中国环境科学学会,北京 00082)
零价纳米铁吸附去除水中六价铬的研究
秦泽敏1,2,董黎明1*,刘 平3**,周恋彤1(1.北京工商大学环境科学与工程系,北京 100048;2.神华准格尔能源有限责任公司,内蒙古 呼和浩特 010300;3.中国环境科学学会,北京 100082)
利用液相还原法制备的零价纳米铁(nZVI)进行了去除水中Cr(Ⅵ)的实验研究.结果表明,nZVI对Cr的去除效果明显优于还原铁粉和粉末活性碳;pH值越小、初始Cr浓度越低、nZVI放置时间越短及投加量越大均有利于水中Cr(Ⅵ)的去除,最佳去除率近100%;反应动力学拟合结果表明,nZVI去除六价铬符合准二级动力学模型;反应后nZVI颗粒的扫描电镜及电子能谱结果显示Cr占12.02%(wt),结合对反应溶液中Cr(Ⅵ)和Cr(Ⅲ)分析,说明吸附、还原与共沉淀可能是nZVI去除水中六价铬的主要机理.
零价纳米铁;六价铬;去除;反应动力学
水体中铬离子主要以三价铬和六价铬的形式存在,六价铬离子尤以毒性高引起人们的关注,在水中主要以HCrO4-和Cr2O72-两种形式存在[1].目前国内外常见的铬废水处理方法有生物法、电解还原法、膜分离法、吸附法等[2].这些方法均存在一定局限性,生物法易受水中阴阳离子、功能菌还原性的影响;电解法反应耗电量大,污泥沉积严重;膜分离法投资大,运行维护费用高;吸附法对水量水质有较大的抗冲击能力,但受吸附容量限制.
零价纳米铁(nZVI)具有粒径小(50~200nm)、比表面积大(33.5m2/g)兼具还原性强等优点[1].将其应用于处理TNT[3]、五氯苯酚[4]、三氯甲烷[5]和阿特拉津[6]等有机物,均取得了 80%以上的去除率,同样对Cr(Ⅵ)、Pb(Ⅱ)、Cd等重金属元素去除也有较多报道[7-9],但其去除机理及影响因素研究相对较少.本研究通过液相还原法合成nZVI,探讨了nZVI去除Cr(Ⅵ)的主要影响因素,对其反应动力学及Cr(Ⅵ)去除机理进行了探讨.
1 材料与方法
1.1 材料
实验用硼氢化钠(NaBH4)、九水硝酸铁(Fe(NO3)3·9H2O)、还原铁粉(纯度>98%,天津化学试剂三厂)均为分析纯,活性炭粉末为山西新华化工厂生产.配置六价铬溶液所用为重铬酸钾标准品,实验用水为去离子水.
1.2 nZVI合成
配制 100mL,0.1mol/LFe(NO3)3·9H2O溶液.将100mL,0.4mol/L NaBH4溶液以5mL/min的速度滴入上述 Fe(NO3)3·9H2O溶液中,连续搅拌10min,保证反应产生的氢气全部逸散,离心去除上清液,离心速率为6000r/min,用去离子水清洗3次,最后将nZVI溶液浓缩至50mL,则nZVI溶液浓度约为10mg/mL.
1.3 测定方法
六价铬的测定采用二苯碳酰二肼分光光度法[10].取5mL待测液体,置于50mL比色管中,将液体稀释至标线,加入 1+1硫酸溶液 0.5mL,1+1磷酸溶液0.5mL,摇匀,加入2mL显色剂(0.2g二苯碳酰二肼溶于 50mL丙酮中,用水稀释到100mL制得),摇匀.5~10min后,在波长540nm处,测定吸光度.总铬采用原子吸收光谱法(AAS)测定.
1.4 实验方法
在碘量瓶中,放置 200mL Cr(Ⅵ)浓度为50mg/L的溶液,在其中添加 nZVI,投加量为150mg/L,在25℃,100r/min条件下缓慢水浴振荡,用注射器取样,通过 0.45µm滤膜后,测定 Cr(Ⅵ)浓度,溶液的pH值由1%NaOH、1%HCl调节.
1.5 SEM与EDS分析
用胶头滴管吸取反应前 nZVI溶液,滴加于样品台上,在烘箱内 45℃烘干,做为反应前 nZVI测试样品.将反应后溶液离心,离心速率为6000r/min,用胶头滴管吸取nZVI沉淀,滴加到样品台上,在烘箱内45℃烘干,做为反应后nZVI测试样品.将反应前后样品的表面进行喷金后放入样品仓中进行观察、拍摄照片并做分析.测试电压20keV,扫描时间为10s.
2 结果与讨论
2.1 实验条件对Cr6+去除率的影响
2.1.1 不同材料对Cr6+去除率的影响 在Cr(Ⅵ)溶液中分别投入150mg/L还原铁粉、nZVI和粉末活性炭,其去除结果见图 1.还原铁粉对 Cr6+的去除率只有 2%,说明还原铁粉对于六价铬去除非常有限,粉末活性炭对于六价铬的去除率在5%左右,比还原铁粉的去除率有所提升;nZVI对于六价铬的去除率达到了 80%以上,比还原铁粉与粉末活性炭明显具有更高的去除效率.
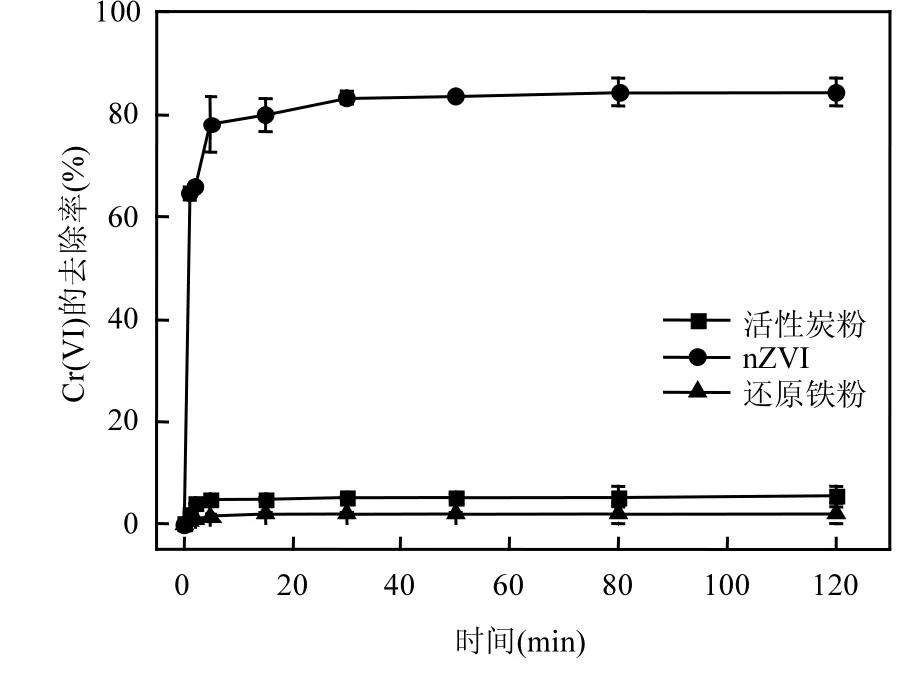
图1 还原铁粉、活性碳及nZVI对于Cr6+的去除Fig.1 Removal of Cr6+with iron powder , activated carbon and nZVI
2.1.2 pH值的影响 调节六价铬溶液pH到3、5、7、10,由图2可以看出,随着pH值的升高,nZVI对于六价铬的去除率下降.当 pH 3时,去除率可以达到80%,当pH 10时,去除率下降到59%.
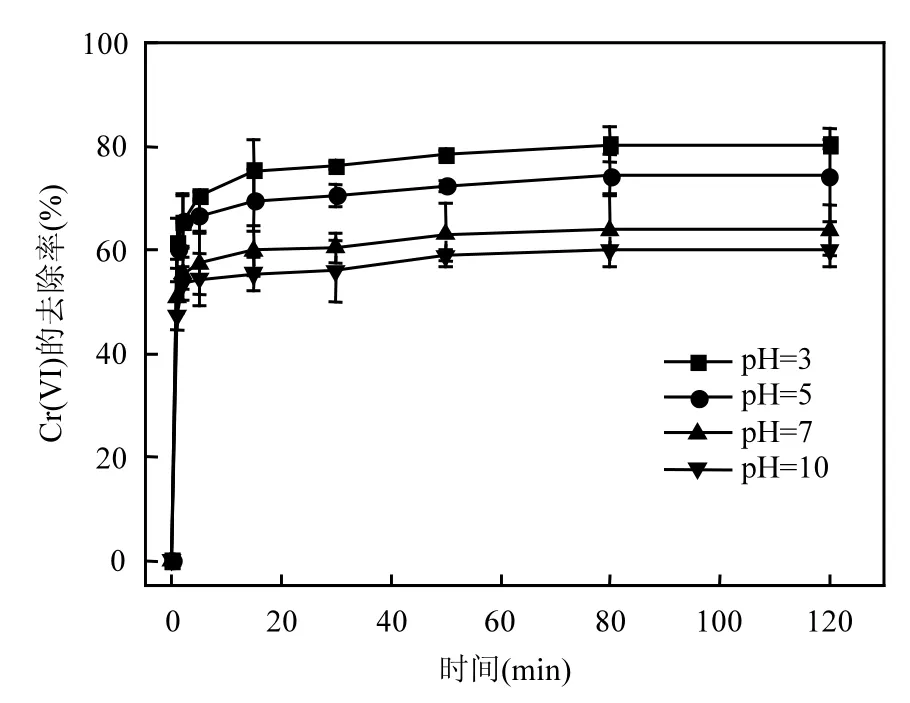
图2 pH值对于nZVI去除Cr6+的影响Fig.2 Effect of pH on the removal of Cr6+with nZVI
在酸性条件下,铁蚀物的快速产生,会提高六价铬的去除速率,在这个过程中会产生 OH-,OH-与水中 H+结合,会降低一部分反应产物浓度,导致反应速度加快[11].在碱性条件下,氢氧化物会增多,氢氧化物一方面会抑制铁蚀反应的进行,另一方面会对nZVI产生钝化现象,阻碍nZVI与六价铬的接触,从而影响铬铁共沉淀的形成,导致去除率的降低[12].
2.1.3 nZVI投加量的影响 选取 50,100,150, 250mg/LnZVI分别投加到 Cr(Ⅵ)溶液中.由图 3可知,溶液中剩余Cr(Ⅵ)浓度随着nZVI投加量的增加,呈现下降的趋势,当 nZVI投加量达到250m/L时,溶液中 Cr(Ⅵ)的去除率接近于100%.nZVI投加量的增加,会导致溶液中 nZVI活性点位的增加,从而有更多的吸附空间用于吸附溶液中的六价铬[13].但是随着 nZVI投加量的增加,单位质量 nZVI对于六价铬吸附量会降低.在nZVI投加量为250mg/L时,nZVI对于六价铬的去除能力为199.4mg Cr(Ⅵ )/g Fe0.在nZVI投加量为150mg/L时,nZVI对于六价铬的去除能力为268.1mg Cr(Ⅵ)/g Fe0.

图3 nZVI投加量对于Cr6+去除的影响Fig.3 Effect of nZVI dosage on the removal of Cr6+
2.1.4 初始 Cr6+浓度的影响 由图 4可知,在Cr(Ⅵ)溶液浓度为10,20mg/L时,去除率在99%以上,当Cr(Ⅵ)溶液浓度为 50mg/L时,去除率降低为80%,当Cr(Ⅵ)溶液浓度为100mg/L时,去除率只有50%.因此,随着Cr(Ⅵ)溶液浓度的上升,去除率呈现下降的趋势.有学者认为高浓度初始溶液会抑制nZVI活性[14].
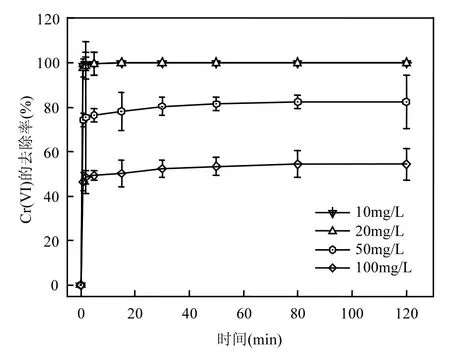
图4 初始Cr6+浓度对于nZVI去除Cr6+的影响Fig.4 Effect of initial Cr6+concentration on the removal of Cr6+with nZVI
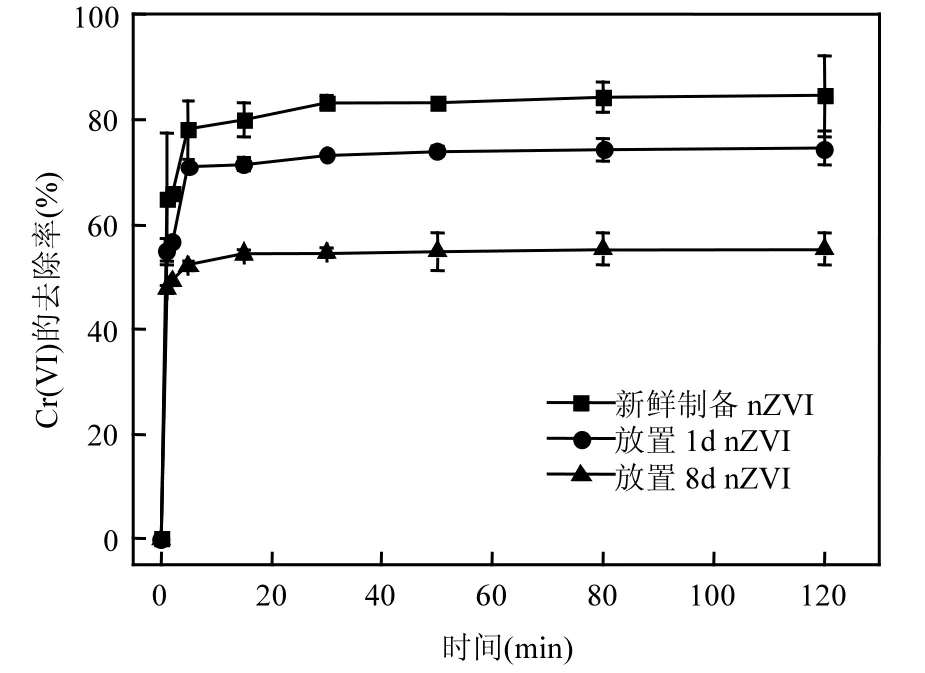
图5 放置时间对于nZVI去除Cr6+的影响Fig.5 Effect of storage period on the removal of Cr6+with nZVI
2.1.5 nZVI稳定性 在相同的反应条件下,将放置1d和8d的样品与新鲜制备的样品作对比,结果见图5.新鲜制备的nZVI样品的去除率可以达到82%,放置1d后,去除率下降到74%,放置8d,去除率降低到55%.nZVI颗粒去除率下降是因为随着放置时间的增加,nZVI颗粒表面接触更多空气中的氧气和水分,会在表面发生氧化以及电化学反应,形成铁的氧化物或羟基氧化物,氧化物会对 nZVI产生钝化现象,减慢反应过程的传质,从而降低对六价铬的去除效果[15].
2.2 吸附动力学
采用准一级速率模型以及准二级速率模型分别对稳定性数据进行拟合如表 1所示.由稳定性结果可以看出,在最初 15min之内,nZVI对于六价铬的去除率上升很快,之后去除率缓慢上升.为使吸附过程充分平衡,取平衡时间为 80min,实验值Qe即为80min时 nZVI平衡吸附量(mg/g).拟合结果见表1.
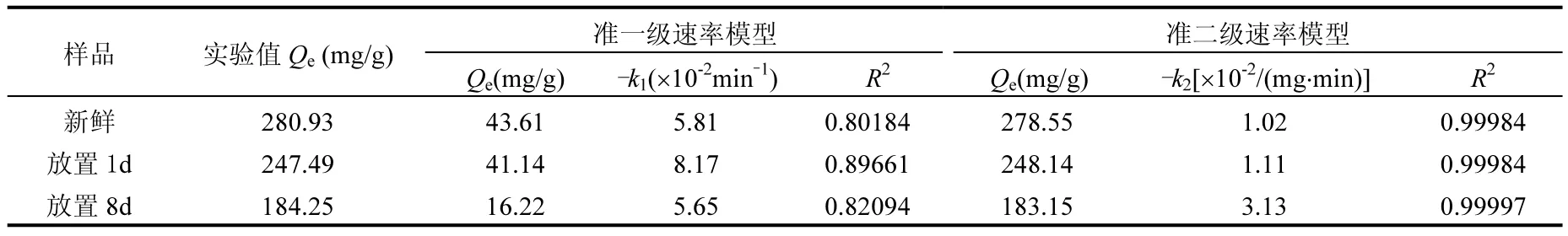
表1 nZVI去除Cr6+的准一级速率模型和准二级速率模型数据拟合Table 1 The fitting data of the Cr6+removal by nZVI with pseudo first-order model and pseudo second-order model
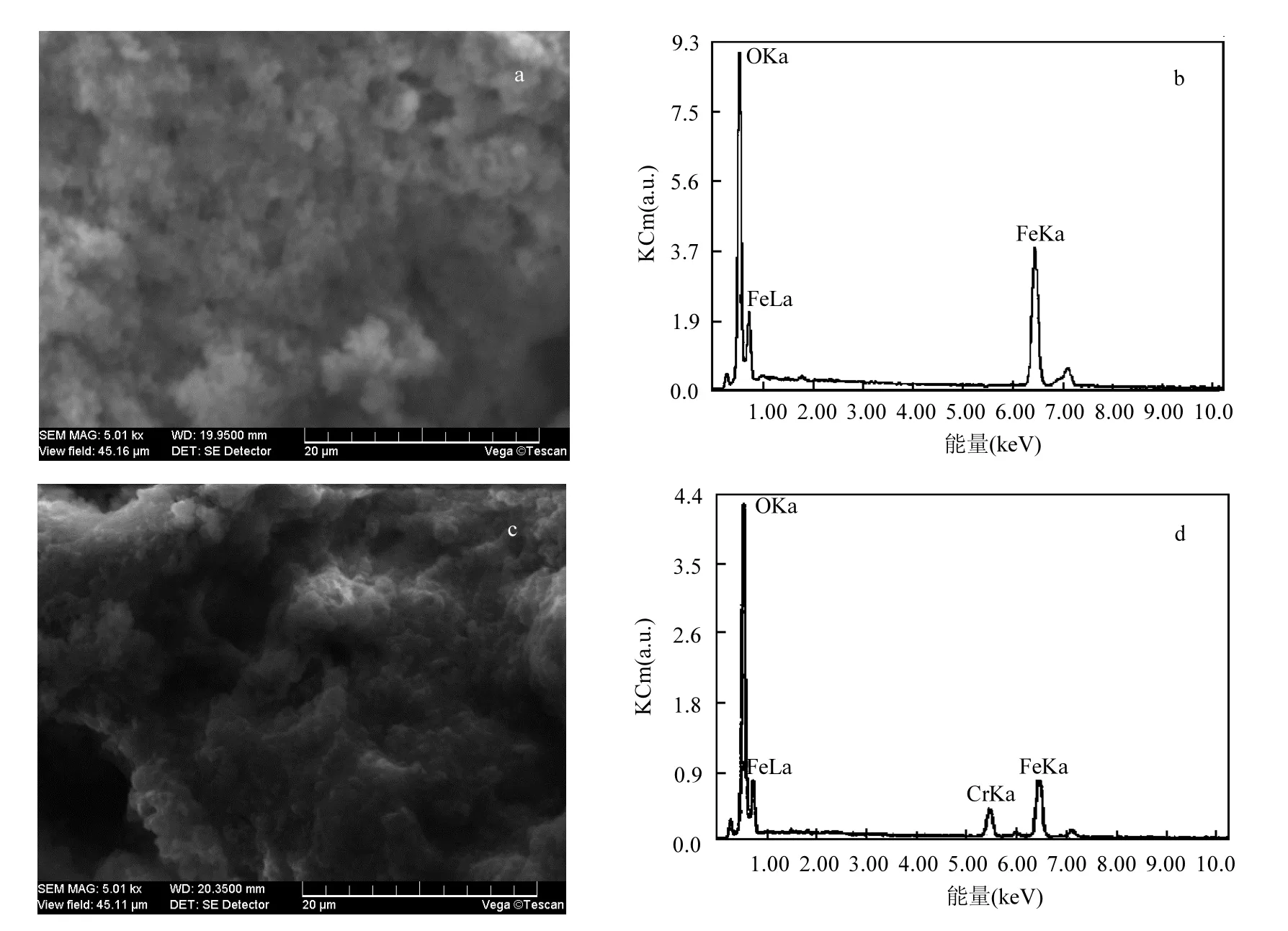
图6 nZVI去除Cr反应前后nZVI的SEM和EDS分析Fig.6 The SEM images and EDS results of pre- and post- reaction of Cr6+with nZVI
由表 1可以看出,准二级速率模型相关系数R2高于准一级速率相关系数R2,说明nZVI对于六价铬的吸附更符合准二级速率模型.由准二级速率模型速率参数可以看出,反应速率k2依次为放置 8d>放置 1d>新鲜制备,虽然去除率为新鲜制备nZVI最高,放置1d后其次,放置8d后最差,但其速率参数却与此排序相反,这可能是由于放置8d后,nZVI吸附量降低,相对新鲜制备的nZVI,可以更快达到吸附平衡.由准二级动力学方程拟合Qe值与实验值Qe相差不大.
2.3 SEM及EDS分析
对nZVI投加量150mg/L,投加到50mg/LCr(Ⅵ)溶液中,反应前后的nZVI进行SEM及EDS分析.从图6可以看出,反应前nZVI要比反应后疏松,颗粒感更强.可能是由于反应后,nZVI表面吸附铬离子,粒径更小的铬离子填充了nZVI之间的空隙,导致反应后的nZVI更加密实.
谱图表明,反应前nZVI包含Fe及O,O可能是在制样过程中,nZVI表面氧化造成,Fe在2个位置出现了峰,这可能与Fe氧化后的不同形态与价态有关.反应后在nZVI的表面出现了Cr峰,是由于在反应完成后,nZVI表面吸附Cr导致.

表2 nZVI去除Cr6+反应前后nZVI颗粒的EDS分析(%)Table 2 EDS analysis of nZVI particle of pre- and postreaction of Cr6+with nZVI (%)
对比反应前后 nZVI表面各元素百分含量(表 2),O元素在反应后呈现了上升的趋势,可能是由于在反应过程中,nZVI表面被溶液中的溶解氧氧化.在反应完成后,nZVI的表面检测到了Cr,其含量达到了12.02%.由于nZVI在反应中氧化,以及吸附溶液中Cr离子,致使nZVI表面Fe百分含量在反应后下降.
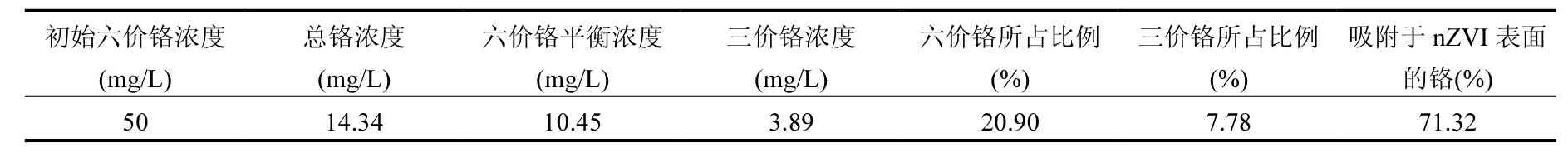
表3 反应后溶液中铬形态分析Table 3 The analysis of Cr species in the post-reaction solution of Cr6+with nZVI
2.4 去除机理
nZVI投加量150mg/L,投加到50mg/LCr(Ⅵ)溶液中,反应后的溶液总铬进行测定,结果见表3.溶液中总铬浓度为 14.34mg/L,六价铬浓度为10.45mg/L,差减法计算溶液中三价铬浓度为3.89mg/L,所以溶液中六价铬以及三价铬所占溶液初始浓度 50mg/L为 20.9%和 7.78%,剩余71.32%吸附于 nZVI表面.对稳定性结果进行动力学拟合,发现很好的符合准二级动力学方程,对nZVI去除六价铬的机理[13,16]可以进行如下判断.
(1) nZVI去除Cr6+第1步为吸附,一部分六价铬吸附于 nZVI的活性点位上,被还原为三价铬,另外一部分吸附于 nZVI的非活性点位,依旧以六价铬的形式存在.

(2) nZVI与水中氢离子发生反应,产生亚铁离子,结合第1步反应产生的亚铁离子,与水中的六价铬发生反应,产生三价铬离子与三价铁离子.
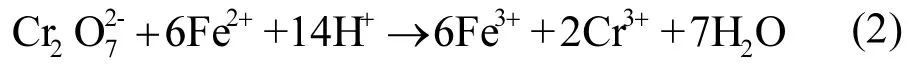
(3) 三价铬离子与三价铁离子形成共沉淀,附着于nZVI表面.
研究结果表明,nZVI对于水中重金属去除有广泛的应用前景,但在如何提高其反应稳定性、降低成本,以及实际应用中可能导致的生态毒性方面还需进一步深入研究.
3 结论
3.1 nZVI对水中Cr6+的去除明显优于还原铁粉及粉末活性炭;pH值越小、初始Cr浓度越低、nZVI放置时间越短及投加量越大均有利于水中Cr(Ⅵ)的去除,最佳去除率近100%;
3.2 反应动力学拟合结果表明nZVI去除Cr(Ⅵ)符合准二级动力学模型;反应后 nZVI颗粒的扫描电镜及电子能谱结果显示 Cr占 12.02%(wt),结合对反应溶液中 Cr(Ⅵ)和 Cr(Ⅲ)分析,吸附、还原与共沉淀可能是nZVI去除水中六价铬的主要机理.
[1] Fu Fenglian, Ma Jun, Xie Liping, et al. Chromium removal using resin supported nanoscale zero-valent iron [J]. Journal of Environmental Management, 2013,128:822-827.
[2] Qiu Xiuqi, Fang Zhanqiang, Yan Xiaomin, et al. Emergency remediation of simulated chromium (VI) polluted river by nanoscale zero-valent iron: Laboratory study and numerical simulation [J]. Chemical Engineering Journal, 2012,193–194: 358–365.
[3] Zhang Xin, Lin Yuman, Shan Xiaoquan, et al. Degradation of 2,4,6-trinitrotoluene (TNT) from explosive wastewater using nanoscale zero-valent iron [J]. Chemical Engineering Journal, 2010,158:566–570.
[4] Li Yimin, Zhang Yun, Li Jianfa, et al. Enhanced removal of pentachlorophenol by a novel composite: Nanoscale zerovalent iron immobilized on organobentonite [J]. Environmental Pollution, 2011,159:3744-3749.
[5] 颜 爱,卞 琼,刘明华.改性纤维素负载零价铁去除三氯甲烷的研究 [J]. 中国环境科学, 2014,34(1):105-110.
[6] Zhang Yun, Li Yimin, Zheng Xuming. Removal of atrazine by nanoscale zero valent iron supported on organobentonite [J]. Science of the Total Environment, 2011,409:625–630.
[7] 冯婧微,梁成华,王 黎,等.零价纳米铁对水中 Cr(VI)的吸附动力学研究 [J]. 科技导报, 2011,29(24):37-41.
[8] Seol AK, Seralathan K, Kui-Jae Lee, et al. Removal of Pb (II) from aqueous solution by a zeolite–nanoscale zero-valent iron composite [J]. Chemical Engineering Journal, 2013,217:54–60.
[9] Hardiljeet K, Boparai, Meera J, et al. Kinetics and thermodynamics of cadmium ion removal by adsorption onto nano zero valent iron particles [J]. Journal of Hazardous Materials, 2011,186:458–465.
[10] GB/T 7467-87 水质—六价铬的测定—二苯碳酰二肼分光光度法 [S].
[11] Dinesh M, Charles U, Pittman Jr. Activated carbons and low cost adsorbents for remediation of tri- and hexavalent chromium from water [J]. Journal of Hazardous Materials, 2006,132(2):762-811.
[12] Naman C, Zhang Zhen, Zhang Jinghui, et al. Removal of Cr(VI) from simulative contaminated groundwater by iron metal [J]. Process Safety and Environmental Protection, 2009,87:395- 400.
[13] Fang Zhanqiang, Qiu Xiuqi, Huang Ruixiong, et al. Removal of chromium in electroplating wastewater by nanoscale zero-valent metal with synergistic effect of reduction and immobilization [J]. Desalination, 2011,280:224-231.
[14] Wu Limei, Liao Libing, Lv Guocheng, et al. Micro-electrolysis of Cr (VI) in the nanoscale zero-valent iron loaded activated carbon [J]. Journal of Hazardous Materials, 2013,254–255:277–283.
[15] Wu Pingxiao, Li Shuzhen, Ju Liting, et al. Mechanism of the reduction of hexavalent chromium by organo-montmorillonite supported iron nanoparticles [J]. Journal of Hazardous Materials, 2012,219-220:283-285.
[16] Liu Tingyi, Zhao Lin, Sun Desheng, et al. Entrapment of nanoscale zero-valent iron in chitosan beads forhexavalent chromium removal from wastewater [J]. Journal of Hazardous Materials, 2010,184:724–730.
Removal Cr6+from water using nanoscale zero-valent iron.
QIN Ze-min1,2, DONG Li-ming1*, LIU Ping3**, ZHOU
Lian-tong(1.Department of Environmental Science and Engineering, Beijing Technology and Business University, Beijing 100048, China;2.Shenhua Zhungeer Energy Company Limited, Hohhot 010300, China;3.Chinese Society for Environmental Sciences, Beijing 100082, China). China Environmental Science, 2014,34(12):3106~3111
The removal of Cr6+from water using nanoscale zero-valent iron (nZVI) prepared with the liquid phase reduction method was investigated. Results showed that removal rate of Cr6+observed from nZVI was much higher than those from iron powder and activated carbon. Lower pH and initial Cr6+concentration, more fresh nZVI and dosage were favorable of removal of Cr6+in water, and the best removal rate was nearly 100%. The fitting results of reaction dynamics indicated that Cr6+removal by nZVI was well consonant with pseudo second-order model. Cr element with 12.02% (wt) concentration was detected on the post-reaction nZVI particle surface by SEM and EDS. The analysis of Cr6+and Cr3+concentration in reaction solution of adsorption, suggested that reduction and co-precipitation should be the mainl mechanism of the Cr6+removal from water using nZVI.
nanoscale zero-valent iron (nZVI);Cr6+;removal;reaction dynamics
X703
A
1000-6923(2014)12-3106-06
秦泽敏(1990-),男,内蒙古呼和浩特人,硕士,主要从事重金属及水污染控制研究.
2014-04-03
北京市教育委员会科技计划面上项目(KM201310011005);北京市学科建设-重点学科-环境工程项目(PXM2014_014213_ 000037);北京市自然科学基金(8112012)
* 责任作者, 董黎明, 副教授, donglm@btbu.edu.cn
** 责任作者, 刘平, 高级工程师, liup3000@163.com

