硫乙醇酸盐流体培养基成分、历史起源及应用研究进展
王似锦,高 春
(北京市药品检验所,北京 100035)
Brewer于1940年发明了硫乙醇酸盐流体培养基(Fluid Thioglycollate Medium),在此后的20余年中,该培养基的配方逐渐被固定下来。自20世纪50年代起,国内外药典陆续将其收录,用于药品的无菌检查。研究人员发现,硫乙醇酸盐流体培养基存在一定的局限性,20世纪60年代,陆续有报道表明该培养基并不能使所有的梭状芽孢杆菌生长,并提出应同时使用TSA培养基作为补充,随后这一建议被国外药典采纳。但该培养基之所以能够沿用至今,是因为其具有不可替代的巨大优势,硫乙醇酸盐流体培养基能在普通有氧环境下提供厌氧条件,使需氧菌和厌氧菌均能够生长良好,并易于观察结果,这提供了一般实验室难以达到的厌氧培养条件。现就其成分、历史起源、应用进展综述如下。
1 成分分析
硫乙醇酸盐流体培养基收载于2010年版《中国药典》无菌检查附录项[1]下,用于药品的无菌检查。该培养基的配方见表1。
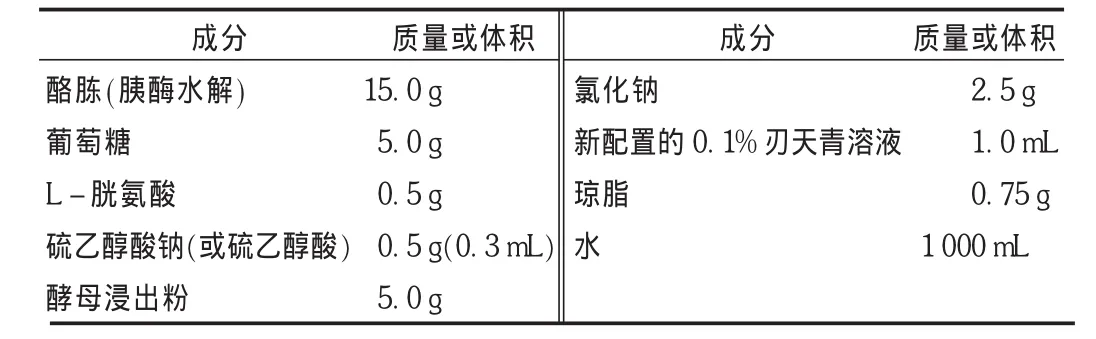
表1 硫乙醇酸盐流体培养基的配方
1)碳源和氮源
酪胨(胰酶水解)和 L - 胱氨酸〔HOOC(NH2)CHCH2〕S2[2]:酪胨是由酪蛋白经过胰酶水解后,将大分子的酪蛋白分解为目示、胨、肽及多种氨基酸。由于原材料是从奶中提取的酪蛋白,质量稳定,氨基酸种类多,优于一般的胨,与L-胱氨酸构成细菌成长所需的氮源。
葡萄糖[2]:提供微生物生长所需的碳源。自然界中大多数微生物都能利用葡萄糖,由于细菌代谢过程中分解代谢葡萄糖产酸,培养及加热灭菌时葡萄糖被破坏会产生有毒物质,因此应注意其用量及加热次数。
酵母浸出粉[2]:酵母浸出粉是由氨基酸类、肽类、水溶性维生素及酵母多糖、酵母核酸组成的一种混合物,还含有丰富的B族维生素和各种氨基酸。核苷酸类、有机酸类、矿物质类及维生素类的水溶性物质。不仅能补充氮源,还能提供微生物生长的各种维生素及氨基酸。
2)无机盐类
氯化钠、酪胨、酵母浸出粉中含有的 PO43-,NH4+,Mg2+,Ca2+,SO42-、Fe3+,Cu2+等无机离子,构成细菌细胞的组织物质,具有影响酶活性及调节渗透压的作用[2]。
3)厌氧(还原)环境的形成与保持
硫乙醇酸钠〔HSCH2COONa〕或硫乙醇酸〔HSCH2COOH〕:在培养基中的主要作用有两方面,一是与 L-胱氨酸、葡萄糖有降低氧化还原电位的作用,使深部氧化还原电位较低。Reed等[3]的报道表明,硫乙醇酸钠的存在使培养基的上部电位约为+0.2~+0.1 V,下部电位约为 +0.1~0 V,管底部约为 -0.3~ -0.2 V,因而维持培养基下层的厌氧条件,有利于厌氧菌的生长。二是具有钝化砷和汞类药物及防腐剂的抑菌作用[4]。当汞盐等物质存在时,它与培养基中的SH基结合,抑制了细菌的生长。当培养基中有硫乙醇酸盐时,培养基内SH基增多,消除汞盐等抑菌现象,有利于细菌的生长。
琼脂[4]:在培养基中加入少量琼脂,可减少液面流动,降低氧的吸收,维持培养基底部的还原电位,有利于厌氧菌的生长。但应选用透明度好的琼脂,以免影响判断结果。
4)氧化还原指示剂
刃天青(resazurin)或亚甲蓝(methylene blue)[2]为氧化还原指示剂,新鲜制备的培养基,温度较高,培养基管的上部与氧接触,刃天青呈蓝色,而中下部培养基呈无氧状态,刃天青还原为无色,当培养基放置后,培养基与空气接触,有溶氧,刃天青被氧化,变为粉红色。当培养基量氧化层的高度超过1/5时,可在水浴中煮沸至粉红色消失,为防止培养基成分分解,煮沸时间不宜过长,不得超过20 min,并只能加热1次[1]。
2 历史起源与发展
早在1898年,Trenkmann[5]就报道在碱性硫化物的培养基中厌氧菌可在有氧环境中生长。1926年,Quastel等[6]发现,在有氧环境生孢羧菌能在一些含巯基(-SH)的化合物(如半胱氨酸,硫乙醇酸,谷胱甘肽)存在的胰酪蛋白消化肉汤中生长。
1938年,Carolyhn等[7]研究了在生物制品污染物的检验中,培养基中琼脂的浓度对细菌生长的影响。其研究表明,在生物制品的无菌检查中,含有低浓度琼脂(0.06% ~0.25%)的培养基在检验过程中表现出更大的优势。
1940年,Brewer[8]总结了前人在培养基中使用还原剂和琼脂的优势,发明了1种能在有氧条件下培养厌氧菌和需氧菌的澄清的液体培养基,该培养基含0.05%的琼脂,无论含与不含硫乙醇酸钠(sodium thioglycollate),均能使厌氧菌生长。这就是硫乙醇酸盐流体培养基的前身。
1940年,Marshall等[9]报道了在Brewer的硫乙醇酸盐培养基中有汞防腐剂存在的情况下,厌氧菌能生长良好。
1941年,Linden[10]对其进行了改进,增加了蛋白胨的量,加入了酵母浸出物(yeast extract)代替牛肉浸出物(meat broth),后人将其改进的培养基命名为 Brewer-Linden培养基(Brewer-Linden medium)。
1942年,Reed等[2]通过在硫乙醇酸盐流体培养基中培养厌氧菌,来研究培养基中各组分对氧化还原电势的影响。结果表明,最佳电势是-0.2 V,葡萄糖对培养基中的氧化还原电势影响不大,硫乙醇酸盐、半胱氨酸对保证培养基的氧化还原电势发挥了重要作用,微量的琼脂增加了其还原环境的稳定性。
1943年,Nungester等[11]和 Portwood[12]证明了硫乙醇酸盐对含汞防腐剂的中和作用。
1945年,Pittman[13]总结了 Brewer和Linden关于硫乙醇酸盐流体培养基的配方,对其中的主要配方进行了逐一研究。其研究表明,与甲基蓝相比,刃天青是一个良好的氧化还原指示剂,浓度在百万分之一既能充分发挥其氧化还原的指示功能,又对细菌的生长没有影响。与酸化水解酪蛋白(acid hydrolyzate of casein)相比,胰酶消化酪蛋白(pancreatic digest of casein)有更好的促生长特性。水溶性的酵母浸出物也有促生长作用。酵母浸出物和胰酶消化酪蛋白的最佳浓度为0.5%和1.5%。在细菌生长初期,磷酸二氢钾有延缓生长的作用。氯化钠的浓度为0.25%,培养基的pH为7.1,为细菌最合适的生长条件。在培养基中添加 L-半胱氨酸能使鸣疽梭状芽胞杆菌生长,他的建议被USP(1955)采纳,并一直沿用至今。在他1946年的报道中,硫乙醇酸盐流体培养基各成分与现今包括《中国药典》在内的世界上大多数国家的药典处方基本一致。
1959年,Zdenka[14]比较了前人用于生物制品无菌检查的5种培养基,其中包括USPXV中规定的硫乙醇酸盐流体培养基、USPXV中规定的肝肉汤培养基、Linden改进Brewer的硫乙醇酸盐流体培养基,Clausen的改良次硫酸盐培养基,Bonnel的次硫酸盐培养基。结果表明,USPXV中规定的硫乙醇酸盐流体培养基和Clausen的改良次硫酸盐培养基得到了最好的结果。
3 硫乙醇酸盐流体培养基的局限性
虽然大量的研究和报道证明,该培养基可同时培养需氧菌和厌氧菌。但20世纪60年代,有研究报道表明该培养基对一些梭状芽孢杆菌有抑制作用。
1968年,Mossel等[15]报道,硫乙醇酸盐对来自8个菌属14株梭状芽孢杆菌的孢子有不同程度的抑制作用。
1970年,Hibbert等[16]研究了含硫乙醇酸钠浓度为 0~0.05%的培养基对4株梭状芽孢杆菌回收率的影响。结果表明,0.01%浓度的硫乙醇酸钠对梭状芽孢杆菌有一定抑制作用,抑制作用还受到培养基中其它成分的影响,比如葡萄糖的存在就可以显著地降低其抑制作用。
1968年,Doyle等[17]的研究表明,一些暴露于环氧乙烷气体的枯草芽胞杆菌黑色变种芽胞在硫乙醇酸盐培养基中不能生长,此外,TSA(大豆酪蛋白琼脂)培养基能够得到更高的回收率。该研究最后提出在使用硫乙醇酸盐流体培养基的同时,可同时使用TSA培养基作为补充。
4 国内研究现状
4.1 中国药典收载情况
1977年版《中国药典》[18]无菌检查项下,将硫乙醇酸盐流体培养基作为选择性培养基列入,并注明用于汞砷类化合物的无菌检查。1985年版《中国药典》[19],硫乙醇酸盐流体培养基收载于无菌检查项下,培养基的名称为“需氧、厌气菌培养基”。在此后的各版《中国药典(一部、二部、三部)》及《中国生物制品规程》,均收载硫乙醇酸盐流体培养基用于无菌检查。
4.2 在药品控制菌检查中的应用
硫乙醇酸盐流体培养基具有中和汞砷等防腐剂的作用,因此一些报道将其用于药品的控制菌检查,以消除药品的抑菌作用。腾宝霞等[20]就报道了该培养基用于药品的大肠杆菌的检查,与胆盐乳糖培养基相比,硫乙醇酸盐流体培养基可用于抑菌作用较强的样品的大肠杆菌检查。杜芸[21]报道了硫乙醇酸盐流体培养基在外用药品金黄色葡萄球菌检查中的应用,其研究结果表明,硫乙醇酸盐流体培养基有消除部分外用药品对金黄色葡萄球菌的抑制作用,其阳性生长率比营养肉汤培养基高出19个百分点。
4.3 作为氧化还原指示剂的应用
郭惠文等[22]报道,用硫乙醇酸盐流体培养基作为厌氧罐厌氧状态的指示剂,并采用厌氧罐进行了生孢梭菌菌悬液的培养计数。
代淑艳等[23]研究了刃天青在硫乙醇酸盐流体培养基中的氧化还原指示剂的作用,其研究用厌氧菌生孢梭状芽孢杆菌、需氧菌短芽孢杆菌及乙型溶血性链球菌进行灵敏度检查。结果表明,不同刃天青含量与未加刃天青、煮沸驱氧与未驱氧的硫乙醇酸盐流体培养基的灵敏度无明显差异。
4.4 灵敏度检查
高尚先等[24]报道,中国药品生物制品检定所等5家科研单位对硫乙醇酸盐流体培养基进行了灵敏度检查的验证试验。结果表明,当接种生孢梭菌、乙型溶血性链球菌、短芽孢杆菌的平皿CFU计数在10~100 cfu/mL时,接种个质控菌的硫乙醇酸盐流体培养基均呈现生长,表明该灵敏度检查方法准确性、可操作性和重复性良好,易于推广和实施。
4.5 配置和使用注意事项
2010年版《中国药典》附录无菌检查项下规定[1],在分装至适宜容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的1/2。在供试品接种前,培养基氧化层的高度不得超过培养基深度的1/5。否则,须经100℃水域加热至粉红色消失(不超过20 min)迅速冷却,只限加热1次,并防止被污染。该培养基不宜放置过长时间,以防止培养基氧化层深度增加,从而使培养基底层失去厌氧环境。使用前,应按照《中国药典》的要求进行灵敏度试验,只有通过灵敏度试验的培养基才能够用于无菌检查。
5 结语
约100年前,世界范围内的微生物学家在寻找一个能够同时培养需氧菌和厌氧菌的,并能在有氧环境中使用的培养基。经过约40年的努力,Brewer于1940年发明了硫乙醇酸盐流体培养基。在此后的20余年中,经过大量研究,该培养基的配方逐渐被固定下来。自20世纪50年代起,国内外药典陆续将其收录,用于药品的无菌检查。
在使用过程中,研究人员发现硫乙醇酸盐流体培养基存在一定的局限性,20世纪60年代,陆续有报道表明该培养基并不能使所有的梭状芽孢杆菌生长,并提出应同时使用TSA培养基作为补充,随后这一建议被国外药典采纳。但该培养基之所以能够沿用至今,是因为其具有不可替代的巨大优势:硫乙醇酸盐流体培养基能够在普通有氧环境下提供厌氧条件,使需氧菌和厌氧菌均能够生长良好,并易于观察结果,这提供了一般实验室难以达到的厌氧培养条件。
综上所述,该培养基的使用,能够确保药品无菌检查在基层实验室中的顺利进行,并仍将在药品检验过程中发挥其不可替代的重要作用。
参考文献:
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:附录80-附录86.
[2]陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1995:54 -70.
[3]Reed GB,Orr JH.Cultivation of anaerobes and oxidation-reduction potentials[J].Journal of bacteriology,1943,45(4):309 - 320.
[4]中华人民共和国卫生部药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,1993:1 171 - 1 177.
[5]Trenkmann.Das wachsthum der anaeroben bakterien[J].Zentralblatt fur Bakterologie(International journal of medical microbiology),1898,23:1 038-1 043.
[6]Quastel JH,Stephenson M.Experiments on “strict” anaerobes[J].Biochemical Journal,1926,20:1 125 - 1 137.
[7]Falk CR,Bucca H,Simmons MP.A comparative study of the use of varying concentrations of agar in the medium used to detect contaminants in biological products[J].Journal of bacteriology,1939,37:121 - 131.
[8]Brewer JH.Clear liquid medium for the “aerobic” cultivation of anaerobes[J].Journalofthe Americanmedicalassociation,1940,115:598 - 600.
[9]Marshall MS,Ginnish JB,Luxen MP.Test for the sterility of biologic products[J].Proceedings of The Society for Experimental Biology and Medicine,1940,43:672.
[10]Linden BA.Fluid thioglycollate medium for the sterility test[Z].National Institute of Health bulletin,1941:1 110.
[11]Nungester WJ,Hood MN,Warren MK.Use of thioglycollate media for testing disinfectants[J].Proceedings of The Society for Experimental Biology and Medicine,1943,52:287.
[12]Portwood L.Observations of the failure of sterility test media to support the growth of laboratory contaminants[J].Journal of bacteriology,1944,48:255-256.
[13]Pittman M.A study of fluid thioglycollate medium for the sterility test[J].Journal of Bacteriology,1946,51:19 - 32.
[14]Jezkovaz Z.A comparative study of sterility test media in the transfusion service[J].Applied microbiology,1960,8(5):274 - 277.
[15]Mossel DAA,Beerens H.Studies on the inhibitory properties of sodium thioglycollate on the germination of wet spores of clostridia[J].The Journal of Hygiene,1968,66:269 - 272.
[16]Hibbert H,Rand Spencer R.An investigation of the inhibitory properties of sodium thioglycollate in media for the recovery of clostridial spores[J].The Journal of Hygiene,1970,68:131 - 135.
[17]Doyle JE,Mehrhof WH,Robert RE.Limitations of thioglycollate broth as a sterility test medium for materials exposed to gaseous ethylene oxide[J].Applied microbiology,1968,11:1 742 - 1 744.
[18]中华人民共和国卫生部药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,1977:附录55-附录58.
[19]中华人民共和国卫生部药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,1985:附录58-附录60.
[20]滕宝霞,王 锐.硫乙醇酸盐-L-胱氨酸培养基在口服制剂控制菌检验中的应用[J].西北药学杂志,1997,12(2):75.
[21]杜 芸.硫乙醇酸盐培养基在外用药品金黄色葡萄球菌检查中的应用[J].中国药业,2003,12(10):31.
[22]郭惠文,李兴琴,徐秋霞,等.厌氧罐法检查硫乙醇酸盐流体培养基灵敏度[J].河北医药,2004,26(10):827 -828.
[23]代淑艳,王殿钧,解 华,等.硫乙醇酸盐培养基中的刃天青的作用分析[J].中国生物制品学杂志,2005,18(5):426 -428.
[24]高尚先,孙彬裕,康国华,等.对《硫乙醇酸盐流体培养基灵敏度检查(草案)》的验证试验[J].药物分析杂志,2005,25(7):849 -851.

