胱抑素C与老年2型糖尿病患者认知功能障碍的相关性探讨
章晓燕,钟 远,苗 雅,燕 虹,沈 静,胡艳云,包玉倩,刘 芳*,贾伟平
(上海交通大学附属第六人民医院:1老年病科;2内分泌代谢科,上海市糖尿病临床医学中心,上海市糖尿病研究所,上海市重中之重代谢病临床医学中心,上海 200233)
糖尿病已成为危害我国国民健康的重大疾病。最新流行病学调查显示,我国≥18岁的成人中,根据国际最新标准(HbA1c≥6.5%)诊断的糖尿病患病率为11.6%,亚组分析表明,60~69岁老年人群糖尿病患病率为22.5%,>70岁的人群患病率高达23.5%[1]。糖尿病危害主要在于慢性并发症,可累及全身各器官和系统,如视网膜、肾脏、神经、心血管等。近年来,糖尿病对中枢神经系统的影响越来越受到关注。糖尿病是阿尔茨海默病(Alzheimer’s disease,AD)的独立危险因素,可加速AD的进展[2]。甚至有学者认为,AD可能是另外一种形式的糖尿病,建议把AD称作“3型糖尿病”[3]。
胱抑素C(cystatin C,Cys C)属于半胱氨酸蛋白酶抑制剂家族,是一种比血肌酐更理想的反映肾小球滤过率的标志物。新近研究表明,Cys C是一个独立于肾功能外的预示心血管事件的因子,包括冠心病、下肢动脉病变等[4],并且与神经系统变性性疾病有关[5]。本研究在老年糖尿病患者中,比较认知功能正常组(normal cognition,NC)、轻度认知功能障碍组(mild cognitive impairment,MCI)及AD组血清Cys C水平的差异,旨在探讨Cys C与糖尿病认知功能障碍的关系,为防治糖尿病认知功能障碍提供新的简易预测血清指标和临床线索。
1 对象与方法
1.1 研究对象
选取2011年12月至2013年12月在上海交通大学附属第六人民医院老年病科住院的>65岁老年2型糖尿病患者352例,其中NC组146例、MCI组112例,AD组94例。所有患者参照1999年世界卫生组织(World Health Organization,WHO)糖尿病诊断标准确诊为2型糖尿病[6]。
1.2 诊断标准
所有神经心理学量表测定由上海交通大学附属第六人民医院老年病科经过专业培训的同一名专职医师完成,包括简易智能状态检查量表(Mini-Mental State Examination,MMSE)、蒙特利尔认知评估量表(北京版)(Montreal Cognitive Assessment,MoCA)、阿尔茨海默病评定量表−认知分量表( Alzheimer’s Disease Assessment Scale-Cognitive Subscale,ADAS-cog)、临床痴呆量表(Clinical Dementia Rating,CDR)、老年抑郁量表(Geriatric Depression Scale,GDS)、日常生活能力量表(Activities of Daily Life,ADL)和Hachinski缺血指数评分(Hachinski Ischemic Scale,HIS)。MMSE和MoCA量表作为患者的筛查量表,受教育时间≤12年者,以MMSE作为筛查工具;>12年者,以MoCA作为筛查工具。
AD组符合2011年美国国立老年研究所(National Institute of Aging,NIA)和阿尔茨海默病联合会(Alzheimer’s Association,AA)提出的AD所致痴呆标准[7],MMSE<24分(或MoCA<19分),CDR≥1级,GDS≥4级,ADL≥17分,ADAS-cog≥18分,HIS≤4分;MCI组符合2011年NIA-AA提出的AD所致MCI的核心临床诊断标准[8],24分≤MMSE<27分(或19分≤MoCA<26分),CDR=0.5级,GDS为2~3级,ADL≤16分,11分≤ADAS-cog≤17分,HIS≤4分;NC组认知、记忆、生活和社会功能均正常,MMSE≥27分(或MoCA≥26分),ADAS-cog≤10分,CDR=0级,GDS为1级,ADL=14分,HIS≤4分。
排除标准:(1)任何引起痴呆的其他神经系统疾病,如帕金森病、癫痫、脑外伤、肿瘤、感染等;(2)符合美国精神病学会《精神障碍诊断和统计手册》第四修订版(Diagnostic and Statistical Manual of Mental Disorders Fourth Revised Edition,DSM-Ⅳ)诊断标准的其他精神疾病;(3)头颅CT,MRI及血液方面等检查明确的非阿尔茨海默病痴呆;(4)既往年内有乙醇依赖史、药物滥用或依赖史;(5)任何显著的系统性疾病或不稳定医学情况;(6)筛选前2周内使用过影响脑功能的药物;(7)严重肝肾功能不全患者。
1.3 实验室检查
所有患者测定空腹血糖(fasting plasma glucose,FPG)、餐后2h血糖(2-hour postprandial blood glucose,2hPBG)、糖化血红蛋白(glycosylated hemoglobin A1c,HbA1c)、总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、肝肾功能等。血糖测定采用葡萄糖氧化酶法,HbA1c测定采用高压液相法(VariantⅡ糖化血红蛋白分析仪,美国Bio-Rad公司)。血脂、肝肾功能等生化指标测定采用酶法(日立7600全自动生化分析仪,日本日立公司)。Cys C采用乳胶增强免疫投射比浊法测定(日立7600全自动生化分析仪,日本日立公司),试剂盒由日本Bliolinks公司提供。
1.4 统计学处理
采用SPSS21.0统计软件进行统计分析。正态分布定量资料以±s表示,非正态分布计量资料采用中位数(四分位间距)表示。两组间比较采用t检验,多组间比较采用单因素方差分析。计数资料的比较采用χ2检验。相关分析采用Spearman相关分析。糖尿病认知功能障碍的独立影响因素采用logistic回归分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 研究对象临床特征比较
3组间研究对象的临床特征比较如表1所示。NC组、MCI组和AD组3组间年龄、糖尿病病程、2hPBG、HbA1c、MMSE分数、MoCA分数差异具有统计学意义(均P<0.05)。3组间性别构成比、教育程度、FPG、TC、TG、HDL-C、LDL-C、丙氨酸转氨酶(alanine aminotransferase,ALT)、血清肌酐(creatinine,Cr)差异无统计学意义(均P>0.05)。与NC组比较,MCI组及AD组年龄、糖尿病病程、HbA1c显著升高,MMSE分数、MoCA分数显著降低(均P<0.05)。另外,AD组2hPBG水平高于NC组(均P<0.05)。AD组与MCI组比较,AD组年龄、糖尿病病程、2hPBG、HbA1c显著高于NC组,MMSE分数、MoCA分数低于NC组(均P<0.05)。
2.2 3组间血清Cys C水平比较
3组间血清Cys C水平比较,差异具有统计学意义(P<0.05)。MCI组血清Cys C水平显著高于NC组[1.5(1.3~1.7)vs1.4(1.2~1.7),P=0.01];AD组血清Cys C水平显著高于NC组[1.6(1.4~1.9)vs1.4(1.2~1.7),P<0.001]。AD组血清Cys C水平显著高于MCI组(P=0.007)。
2.3 相关性分析
Spearman相关性分析表明,血清Cys C水平与年龄、糖尿病病程、TG、Cr、HbA1c呈正相关(r=0.352,0.199,0.177,0.616,0.368;均P<0.05),与MMSE分数、MoCA分数、HDL-C呈负相关(r=-0.186,-0.237,-0.185;均P<0.05)。校正年龄、糖尿病病程、教育程度后,血清Cys C仍与Cr呈正相关(r=0.769,P<0.05),与MMSE分数、MoCA分数、HDL-C呈负相关(r=-0.138,-0.144,-0.134;均P<0.05)。
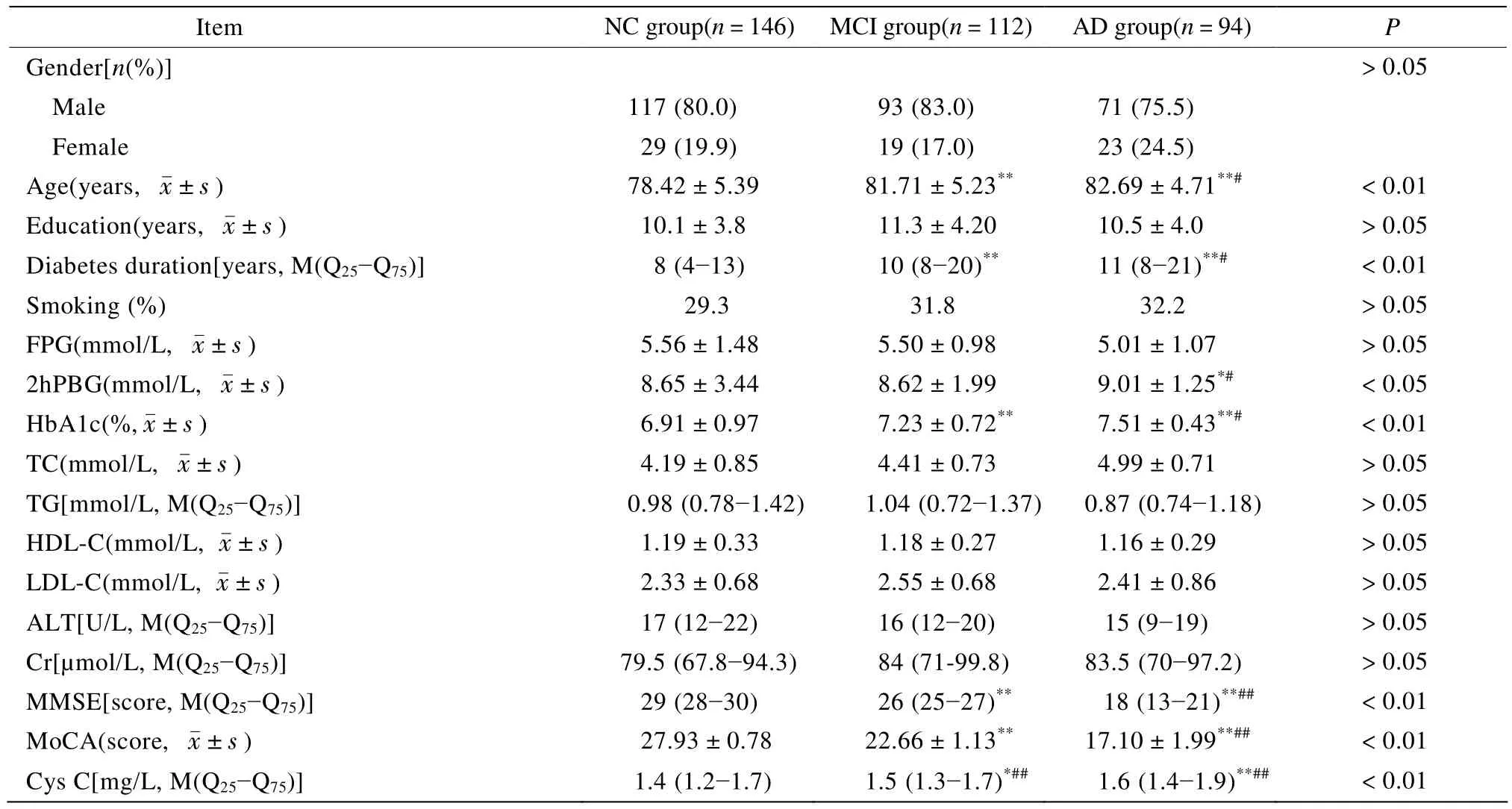
表1 认知功能正常组、轻度认知功能障碍组、阿尔茨海默病组3组间临床资料比较Table 1 Comparison of clinical data between NC, MCI and AD groups
2.4 影响糖尿病认知功能障碍的多因素分析
将MCI组与AD组合并,统称为糖尿病认知障碍组,以是否有认知障碍为因变量,代入年龄、糖尿病病程、教育程度、HbA1c、血脂异常和Cys C进入logistic回归分析。结果显示Cys C(P=0.011,OR=2.120)、年龄(P=0.021,OR=3.401)、病程(P=0.033,OR=3.102)、HbA1c(P=0.010,OR=2.691)是糖尿病认知障碍的独立危险因素(表2)。

表2 糖尿病认知功能障碍危险因素logistic回归分析Table 2 Independent factors for type 2 diabetic cognitive impairment by logistic regression analysis
3 讨 论
本研究在老年糖尿病不同认知状态人群中比较,发现血清Cys C水平存在显著差异,糖尿病MCI及AD者血清Cys C水平均较NC者升高,且随着认知功能障碍程度的加重,血清Cys C水平进行性升高。血清Cys C水平与认知评定量表MMSE及MoCA分数均呈显著负相关,且校正年龄、糖尿病病程、教育程度后,这种负相关仍存在。logistic回归分析表明,血清Cys C水平是糖尿病认知功能障碍的独立危险因素。
糖尿病患者认知能力下降,在老年人中是一个不容忽视的医学和社会问题。糖尿病患者患AD的风险是非糖尿病患者的2倍[9]。近年来有基础研究发现,AD患者与脑认知功能相关的区域,如海马、内嗅区、杏仁核、额颞皮质神经元自行合成的胰岛素、胰岛素样生长因子及其受体和受体后信号转导蛋白的表达均明显下降,其实质是脑内胰岛素抵抗[3]。MCI是AD的早期阶段,是一种不稳定的临床状态,MCI向AD的年转化率为10%~15%,远高于普通人群的1%~2%。本研究入选患者排除了血管性痴呆,主要探讨的是糖尿病合并AD以及MCI。在糖尿病患者群中,已知的认知功能障碍高危因素包括吸烟、高龄、教育水平、血糖控制不佳和高血脂等。在本研究中我们也发现,3组间年龄、糖尿病病程、2hPBG、HbA1c差异具有统计学意义,并且随着糖尿病认知障碍程度的加重,上述指标呈现上升趋势。考虑到血清Cys C是一种反映肾小球滤过率的标志物,肾功能不全时Cys C水平会升高,本研究入组时即排除严重肝肾功能不全,且3组患者间血Cr水平、ALT无差异,因此可排除肝肾功能不全对结果的影响。
近年来,研究发现Cys C参与血管壁重构、血管新生和炎症等病理生理过程,Cys C对早期肾病、心血管病变及周围血管病变的预测价值受到越来越多的关注[10,11]。由于Cys C参与了糖尿病大血管和微血管并发症的诸多病理生理过程,它的作用机制涉及抑制酶和抗炎等方面,在糖尿病领域特别是糖尿病的并发症方面有广泛的用途[12,13]。糖尿病认知功能障碍又称为糖尿病性脑病,也是糖尿病慢性并发症之一。基础研究表明,Cys C可以通过阻止脑部β样淀粉蛋白的聚集防止认知损害的发生,并且与神经元的再生与神经变性、细胞凋亡及氧化应激等有关[14]。但是许多临床研究报道,Cys C高水平与认知损害有关[15]。在本研究中也看到,Cys C高水平与糖尿病患者认知功能障碍有关,并且是糖尿病患者认知障碍的独立危险因素。本研究中,AD组较MCI组血清Cys C水平进一步升高,因此Cys C可能还参与了糖尿病认知功能障碍的进展,其水平随着认知障碍程度的增加而升高。我们推测,Cys C可能仅仅是一种血清学标志,对老年糖尿病患者的认知功能异常具有提示作用,但由于尚不清楚其是否参与AD等的发病,故可能不能成为药物干预的靶点,这需要更多的基础及临床研究证实。
评估认知功能的神经心理学量表有许多,本研究采用国内外公认的评估总体认知功能的MMSE。同时考虑到教育程度对认知的影响,本研究对于高知人群采用了MoCA筛查MCI。MoCA在MMSE的项目设置和评分标准基础上进行了改良,因此更利于筛查老年MCI患者[16]。由于本研究是单中心、小样本、横断面研究,并且缺乏对不同Cys C水平患者认知功能评价的随访结果,因此具有一定的局限性。尚有待进一步对该组人群进行长期随访,以明确Cys C对糖尿病认知功能障碍确切的预测价值。
综上所述,除了作为反映肾功能的指标,血清Cys C水平是老年糖尿病患者发生认知功能障碍的独立危险因素。由于其检测操作简便、价格低廉,对糖尿病患者是否有认知功能障碍具有重要的提示价值。对于高血清Cys C水平的老年糖尿病患者,应尽早筛查认知功能,从而及时干预或延缓认知功能减退的发生。
【参考文献】
[1]Xu Y, Wang L, He J,et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA, 2013, 310(9):948−959.
[2]Profenno LA, Porsteinsson AP, Faraone SV.Meta-analysis of Alzheimer’s disease risk with obesity,diabetes, and related disorders[J]. Biol Psychiatry, 2010,67(6):505−512.
[3]De la Monte SM, Wands JR. Alzheimer’s disease is type 3 diabetes—evidence reviewed[J]. J Diabetes Sci Technol,2008, 2(6):1101−1113.
[4]Shlipak MG, Katz R, Sarnak MJ,et al. Cystatin C and prognosis for cardiovascular and kidney outcomes in elderly persons without chronic kidney disease[J]. Ann Intern Med, 2006, 145(4):237−246.
[5]Turk V, Stoka V, Turk D. Cystatins:biochemical and structural properties, and medical relevance[J]. Front Biosci, 2008, 13:5406−5420.
[6]American Diabetes Association. Standards of medical care in diabetes—2014[J]. Diabetes Care, 2014, 37(Suppl 1):S14−S80.
[7]McKhann GM, Knopman DS, Chertkow H,et al. The diagnosis of dementia due to Alzheimer’s disease:recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease[J]. Alzheimers Demen,2011, 7(3):263−269.
[8]Albert MS, DeKosky ST, Dickson D,et al. The diagnosis of mild cognitive impairment due to Alzheimer’s disease:recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease[J]. Alzheimers Dement,2011, 7(3):270−279.
[9]Ott A, Stolk RP, van Harskamp F,et al. Diabetes mellitus and the risk of dementia:the Rotterdam study[J].Neurology, 1999, 53(9):1937−1942.
[10]Deo R, Shlipak MG, Ix JH,et al. Association of cystatin C with ischemia in patients with coronary heart disease[J].Clin Cardiol, 2009, 32(11):E18−E22.
[11]O’Hare AM, Newman AB, Katz R,et al. Cystatin C and incident peripheral arterial disease events in the elderly:results from the Cardiovascular Health Study[J]. Arch Intern Med, 2005, 165(22):2666−2670.
[12]He R, Shen J, Zhao J,et al. High cystatin C levels predict severe retinopathy in type 2 diabetes patients[J]. Eur J Epidemiol, 2013, 28(9):775−778.
[13]Liu F, Shen J, Zhao J,et al. Cystatin C:a strong marker for lower limb ischemia in Chinese type 2 diabetic patients[J]? PLoS One, 2013, 8(7):e66907.
[14]Levy E. Cystatin C:a potential target for Alzheimer’s treatment[J]. Expert Rev Neurother, 2008, 8(5):687−689.
[15]Sundelöf J, Arnlöv J, Ingelsson E,et al. Serum cystatin C and the risk of Alzheimer’s disease in elderly men[J].Neurology, 2008, 71(14):1072−1079.
[16]Nasreddine ZS, Phillips NA, Bédirian V,et al. The Montreal Cognitive Assessment, MoCA:a brief screening tool for mild cognitive impairment[J]. J Am Geriatr Soc,2005, 53(4):695−699.

