基于AFLP分子标记的不同类型野生桂花种群遗传结构分析
徐沂春,胡绍庆,赵宏波
(1.浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江临安 311300;2.浙江理工大学建筑工程学院,浙江杭州 310018;3.浙江农林大学风景园林与建筑学院,浙江临安 311300)
基于AFLP分子标记的不同类型野生桂花种群遗传结构分析
徐沂春1,胡绍庆2,赵宏波3
(1.浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江临安 311300;2.浙江理工大学建筑工程学院,浙江杭州 310018;3.浙江农林大学风景园林与建筑学院,浙江临安 311300)
桂花Osmanthus fragrans具有极高的经济价值和观赏价值。研究野生桂花种群的遗传多样性有利于为新品种的选育以及野生桂花资源的保护提供重要的依据。利用扩增片段长度多态性(AFLP)技术对江西全南(衰退型)和福建长汀(稳定型)这2个桂花自然种群96个个体进行了遗传多样性评估。7对引物组合共检测到330个清晰位点,其中多态位点276个,占83.64%。在物种水平,桂花的Shannon多态性信息指数(I)为0.428 3,Nei’s基因多样性(He)为0.285 6,表明桂花具有丰富的遗传多样性;在种群水平,福建长汀种群的多态性指数均高于江西全南种群,表明包含不同世代、具有较好自然更新能力的长汀种群携带更丰富的遗传信息;分子方差分析(AMOVA)表明:桂花的遗传变异主要存在于种群内(71%),种群间的遗传变异只占29%;2个种群间存在一定的遗传分化(Gst=0.161 6),种群间基因流较小(Nm=2.594 9)。图2表4参23
植物学;桂花;野生种群;扩增片段长度多态性(AFLP);遗传多样性;遗传结构
桂花Osmanthus fragrans属木犀科Oleaceae木犀属Osmanthus,是中国十大传统名花之一,具有非常高的经济价值和观赏价值。目前,桂花在中国南岭以北至秦岭以南的广大亚热带地区均有大量应用,其栽培面积和栽植数量是中国园林苗木中最大的种类之一。随着2004年中国取得了桂花国际登录权,进一步拓展了桂花生产和销售的国际和国内市场,这就要求我们必须进行桂花种质的改良和创新,培育花大、芳香、色艳、抗性强的桂花新品种。野生桂花具丰富的性状变异和遗传变异,是栽培桂花的重要育种资源,然而野生资源开发过度,破坏严重,适生生境散失,分布范围急剧缩小,种群规模和数量锐减;而现存的野生桂花种群仅在湖南[1-3]、福建[4]、浙江[3,5]、江西[6]等地被零星发现。目前,野生桂花资源的研究主要集中在野生资源的调查[3,6]、种群动态[1,4]、繁育系统[2,5]等方面,而遗传多样性等方面的研究报道较少。江西全南和福建长汀的2个桂花自然种群保存较好,隔离分布,具有代表性。本研究利用扩增片段长度多态性(amplified fragment length polymorphism,AFLP)分子标记技术对2个不同类型(衰退型和稳定型)野生桂花种群遗传多样性进行分析,从而明确这2个种群的遗传结构,为桂花野生资源的科学保护和有效利用提供理论依据。
1 材料与方法
1.1 材料
研究对象为江西全南和福建长汀的2个桂花自然种群。前者位于江西省赣州市全南县,地理位置24.728°N,114.427°E,海拔约为342 m,为南岭北端,属中亚热带季风型气候,年平均气温为18.8℃;此处为一风水林,面积较小,仅有23株成龄桂花组成,地径大小为8~45 cm;林下无种子幼苗和天然压条形成的小苗,无自然更新能力,属于衰退型种群。后者位于福建省龙岩市长汀县,地理位置25.543°N,116.533°E,海拔约479 m,为武夷山脉南段,属中亚热带海洋性季风气候,年均气温18.7℃;此处为一孤岛,主要由石灰岩构成,面积较大,以灌木型和小乔木型桂花组成;灌木型桂花主要位于较低海拔区且土层较薄,小乔木型桂花处于地势较平坦处且土层相对较厚;林下存在较多天然更新幼苗,属于稳定型种群。江西全南共有23份样本,全部采集,所有材料地径均大于8 cm;福建长汀共采集73份样本,采集的材料地径均大于3 cm,相互间隔大于2m。将采集的新鲜叶片放入硅胶干燥后带回实验室,置于-20℃冰箱中备用。
1.2 方法
1.2.1 DNA提取和AFLP分析本实验采用改进的十六烷基三甲基溴化铵(CTAB)法提取桂花基因组DNA,并用NanoDrop微量分光光度计(ND-1000)和8.0 g·L-1琼脂糖凝胶电泳(六一电泳仪)检测总DNA的浓度与纯度,于-70℃保存备用。采用EcoR I和Mse I双酶切组合以及从生工生物工程(上海)股份有限公司合成的64对引物中筛选出的7对引物组合进行AFLP分析。基本步骤如下:①酶切:300 ng DNA模板,50 nkat Eco R I,50 nkat Mse I,1×NEB缓冲液4,3μg牛血清白蛋白(BSA),补足双蒸水至30μL。37℃恒温4 h,反应结束后75℃水浴15 min使酶失活。②连接:66.7 nkat T4 DNA ligast,1× T4 DNA缓冲液,20 pmol E1-E2接头,20 pmol M1-M2接头,酶切产物10μL,补足双蒸水至20μL。16℃恒温10 h以上。③预扩增:1μL连接产物,16.7 nkat Taq,1×缓冲液,4 nmol三磷酸碱基脱氧核苷酸(dNTP),6 pmol EcoRⅠ预扩增引物,6 pmol MseⅠ预扩增引物,补足双蒸水至20μL。反应条件为94℃,5 min;94℃,30 s,56℃,1 min,72℃,1 min,共25个循环;72℃10 min。预扩增产物稀释30倍,作为选择性扩增模板。④选择性扩增:预扩增释稀产物4μL,16.7 nkat Taq,1×缓冲液,4 nmol dNTP,6 pmol EcoRⅠ选择性引物,6 pmol MseⅠ选择性引物,补足双蒸水至20μL。反应条件为:94℃,5min;94℃,30 s,65℃,30 s,72℃,1min,共13循环(每循环降0.7℃);94℃,30 s,56℃,30 s,72℃,1 min,共25循环;72℃,7 min。扩增在Bio-RAD S1000TM Thermal Cycler PCR仪中进行。选择性扩增产物用60.0 g·L-1变性聚丙烯酰胺凝胶电泳检测(Sequi-GenGT核酸测序电泳系统)。60W恒功率预电泳30 min;6μL选择性扩增产物与1μL上样缓冲液[体积分数为98%甲酰胺,10 mmol·L-1乙二胺四乙酸(EDTA),质量分数为0.25%二甲苯青FF,质量分数为0.25%溴酚蓝]混合,94℃变性5min,结束后迅速置于冰上直到点样;加样7μL·泳道-1,70W恒功率电泳,至二甲苯青FF至玻璃板2/3处,结束电泳;弱碱法银染显影,用Canon D60拍照保存图像。
1.2.2 数据统计与分析记录长度在500 bp以下清晰、稳定的扩增带,用“1-0”系统记录谱带,有条带的记为1,无条带的记为0,构成表型数据矩阵。AFLP分子标记为显性标记,因此假设分析的各位点都处于Hardy-Weinberg平衡。应用Popgen version 1.32软件[7]分别为多态条带百分率(PPB),观测等位基因数(Na)和有效等位基因数(Ne),Nei,s基因多样性指数(He),Shannon多态性信息指数(I),物种的基因多样性(Ht),种群内的基因多样性(Hs)和种群间的遗传分化系数(Gst),基因流[Nm=0.5(1-Gst)/Gst]等遗传多样性参数。用GenAlex 6.5软件[8]进行分子方差分析(AMOVA)进行,计算物种的遗传变异以及遗传分化系数(PhiPT)以揭示群体遗传分量;用NTSYS-pc 2.10e软件[9]对个体进行非加权配对算术平均法(UPGMA)聚类分析,估测群体遗传结构。
2 结果与分析
2.1 AFLP选择性扩增结果
从64对引物组合中筛选出了7对扩增产物稳定、重复性好、多态性高且分辨能力强的引物组合,对2个种群96份样品基因组DNA进行AFLP分析。结果表明:7对引物共获得了330条清晰的条带,其中276条为多态性条带;每对引物组合扩增条带数为29~59条;每对引物的多态性条带百分率为70.73%~100.00%(图1和表1)。

图1 引物组合E-AGG/M-CTA部分材料扩增图Figure 1 Profile of some samples amplification by primer E-AGG/M-CTA

表1 7对AFLP选择性扩增引物组合及其扩增结果Table 1 Amplification resultsof different AFLP primer combinations
此外,除引物组合E-ACC/M-CAT外其他引物组合都扩增出一定数量的特异性条带(表2),福建长汀种群扩增的特异性条带数明显多于江西全南种群。
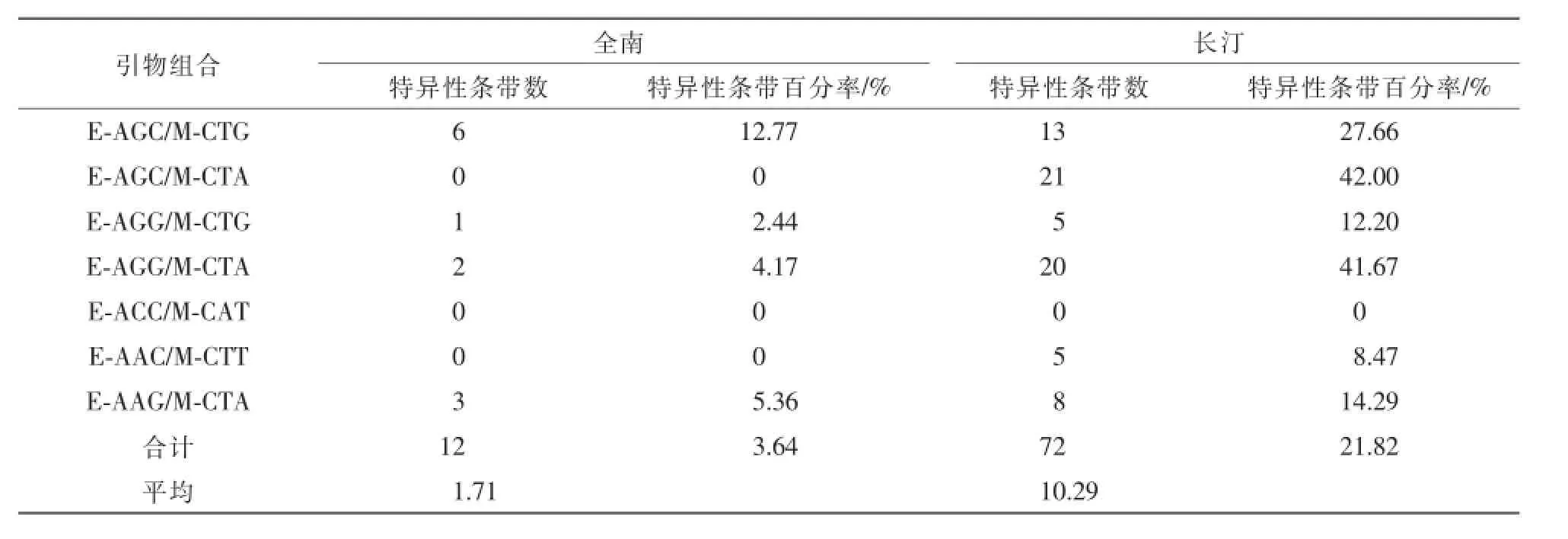
表2 特异性条带扩增Table 2 Amplification of private bands
2.2 遗传多样性
多态位点百分率(PPL)、Shannon多态性信息指数(I)、Nei,s基因多样性(He)都是广泛运用的衡量物种遗传多样性的指标。从表3可以看出,在物种水平,桂花的多态位点百分率(PPL)为83.64%,Shannon多态性信息指数(I)为0.428 3,Nei,s基因多样性(He)为0.285 6;在种群水平,江西全南种群和福建长汀种群的多态位点百分率(PPL)分别为48.48%和79.09%,平均为63.79%,Shannon多态性信息指数(I)分别为0.263 1和0.414 8,平均为0.339 0,Nei,s基因多样性(He)多态性指数分别为0.177 8和0.277 6,平均为0.2277。江西全南和福建长汀的观测等位基因数和有效等位基因数分别为1.4848和1.7909,1.309 0和1.471 4。

表3 桂花种群的遗传多样性Table 3 Genetic diversity index of Osmanthus fragrans in populations
2.3 遗传结构和遗传分化
分子方差分析(AMOVA)(表4)表明:江西全南种群和福建长汀种群间的差异达极显著(P<0.001),种群内的遗传变异百分率为71%,种群间的变异百分率为29%,遗传变异主要来源于种群内部。这与Nei,s基因多样性(Gst=0.161 6)的结果一致。根据遗传分化系数,江西全南种群和福建长汀种群间的基因流(Nm)为2.594 9。

表4 96个桂花个体的分子方差分析(AMOVA)Table 4 Analysisofmolecular variation(AMOVA)for 96 individualsof Osmanthus fragrans
2.4 遗传一致度和聚类分析
Nei,s遗传一致度(0.888 2)和遗传距离(0.118 5)结果表明江西全南种群和福建长汀种群间相似程度较高。2个种群不同个体间的UPGMA聚类分析表明,2个种群的不同个体均先聚为一类(图2),表明地理隔离使得2个种群间有一定的遗传分化。
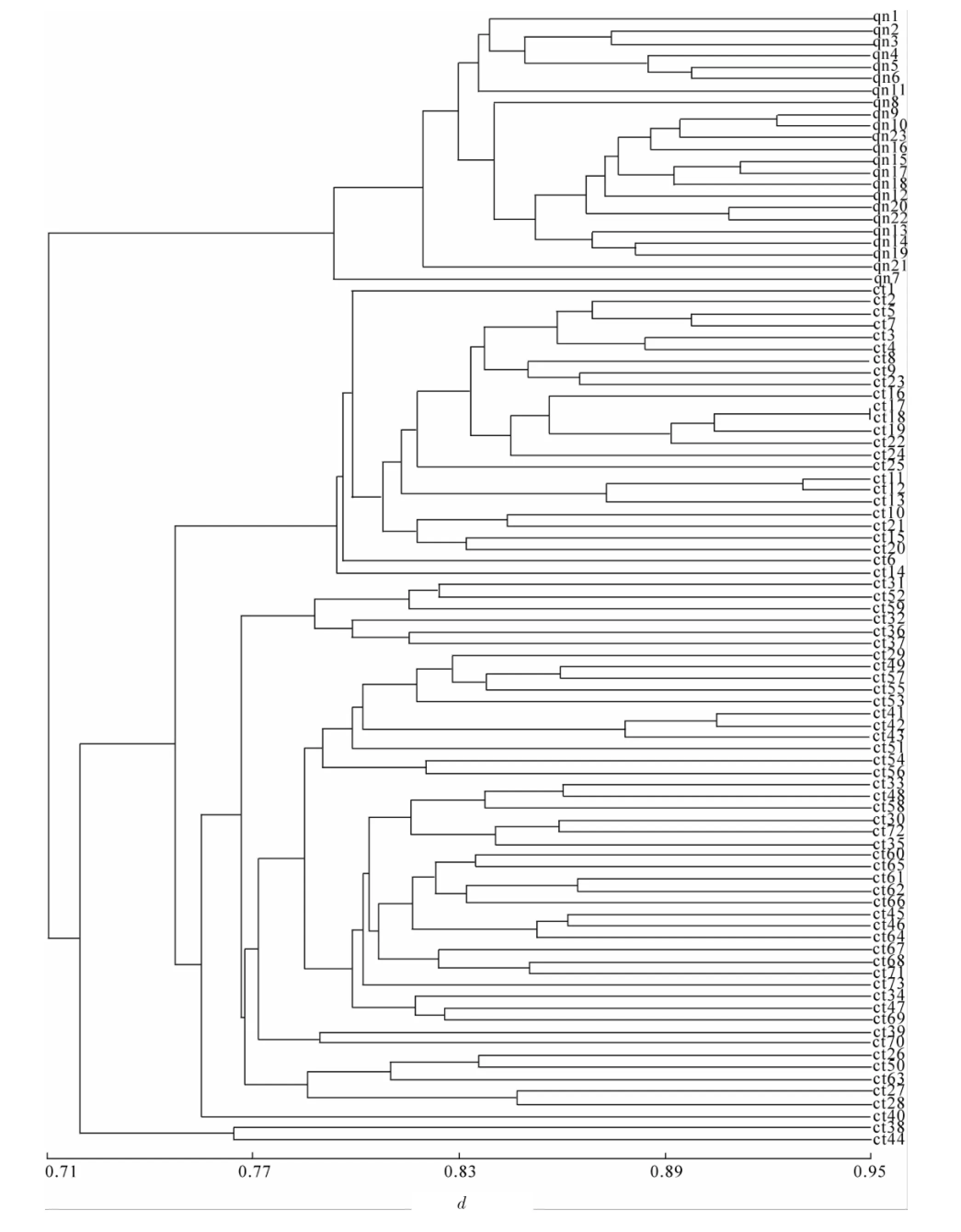
图2 江西全南(qn)和福建长汀(ct)桂花2个种群96个个体的UPGMA聚类图Figure 2 UPGMA dendrogram of 96 individuals of Osmanthus fragrans from Quannan(qn)and Changting(ct)
3 讨论
物种的遗传多样性水平与其繁育系统、种群结构和地理分布格局等密切相关。从Nei,s遗传多样性指数和Shannon信息指数来看,桂花的相关遗传参数(He=0.285 6)均高于通过随机扩增多态性DNA标记(RAPD),AFLP和简单重复间序列(ISSR)等3种显性标记统计的多种植物的遗传多样性平均水平(He= 0.22或0.23)[10],且高于25种广布植物的平均水平(He=0.220 0)[10],但低于珙桐Davidia involucrata(He= 0.333 6或0.342 9)[11-12],南方红豆杉Taxus chinensis var.mairei(He=0.419 2)[13]和光皮桦Betula luminifera(He=0.361 6)[14],表明在种水平具有较高的遗传多样性。
植物种群的遗传结构不仅取决于自身的遗传基础、交配系统等,还受到遗传漂变、基因流和自然选择等因素影响[15-17]。桂花遗传变异主要存在于种群内部,种群间的遗传分化系数(Gst)为0.161 6,低于基于AFLP标记的12个物种的平均水平(Gst=0.210 0)[10],也低于9个广布物种的平均水平(Gst=0.330 0)[10],而高于光皮桦(Gst=0.065 0)[14]及南方红豆杉(Gst=0.121 1)[13]。这表明桂花不同种群间遗传分化不显著,种群间存在一定的基因流,保证种群间遗传信息的交换,从而维持物种水平较高的遗传多样性。
福建长汀种群的遗传多样性程度明显高于江西全南种群,这与种群结构等有着密切的关系。福建长汀种群(稳定型)中存在世代更新现象,有利于种群内不同世代间遗传信息的传递以及遗传变异的产生、维持甚至增加;而缺少世代更新能力的江西全南种群(衰退型)只能维持原有的遗传多样性水平,甚至由于人为破坏造成种群结构和规模的变化,从而导致遗传多样性的下降。此外,不同的种群面积大小表现出不同的遗传差异[18],往往面积较小种群的遗传多样性程度比面积较大的种群低,而与样本的数量没有明显的关系[19-22]。本研究结果同样也支持这一观点。
[1]王贤荣,袁发银,陈昕,等.湖南浏阳桂花峡桂花次生林的物种数量特征[J].南京林业大学学报:自然科学版,2004,28(增刊):41-44.
WANG Xianrong,YUAN Fayin,CHEN Xin,et al.Quantitative characteristics of species in wild community ofOsmanthus fragransin Guihuaxia,Liuyang,Hunan[J].JNanjing For Univ Nat Sci Ed,2004,28(supp):41-44.
[2]汪德娥,王宗海.庐山山南桂花结实习性及野生群落研究[J].林业科技通讯,1997(10):18-21.
WANG De,e,WANG Zonghai.Study on breeding and wild population ofOsmanthus fragransin south slopes of Lushan[J].For Sci Technol,1997(10):18-21.
[3]雷瑞虎,喻勋林,王莉青.中国野生桂花群落研究现状[J].安徽农业科学,2008,36(6):2337,2354.
LEIRuihu,YU Xunlin,WANG Liqing.Research on the introduction of Osmanthus fragrans community in China [J].JAnhui Agric Sci,2008,36(6):2337,2354.
[4]董建文,范小明,吴东来,等.福建长汀石峰寨景区桂花次生林群落物种数量特征[J].植物资源与环境学报,2002,11(4):40-44.
DONG Jianwen,FAN Xiaoming,WU Donglai,et al.Quantitative characteristics of species in secondary forest community ofOsmanthus fragransin Shifengzhai of Changting County,Fujian Province[J].JPlant Resour Environ,2002,11(4):40-44.
[5]郝日明,赵宏波,王金虎,等.野生桂花繁育系统的观察和研究[J].植物资源与环境学报,2011,20(1):17 -24.
HAO Riming,ZHAO Hongbo,WANG Jinhu,et al.Observation and study on breeding system of wild Osmanthus fragrans[J].JPlant Resour Environ,2011,20(1):17-24.
[6]段一凡,谭志明,刘远标,等.江西全南古桂和野生桂花资源调查[J].植物资源与环境学报,2012,21(2):118-120.
DUAN Yifan,TAN Zhiming,LIU Yuanbiao,et al.Resources investigation of ancient tree and wild tree of Osmanthus fragrans in Quannan County of Jiangxi Province[J].JPlant Resour Environ,2012,21(2):118-120.
[7]YEH F C,YANG R C,BOYLE T B J,et al.PopGene32,Microsoft W indows-Based Freeware for Population Genetic Analysis Version1.32[CP/OL].Alberta:Molecular Biology and Biotechnology Centre,University of Alberta,2000.
[8]PEAKALL R,SMOUSE PE.GenAlEx 6.5:genetic analysis in Excel.Population genetic software for teaching and research-an update[J].Bioinformatics,2012,28(19):2537-2539.
[9]ROHLF F J.NTSYS-pc.Numerical Taxonomy and Multi-variate Analysis System,Version2.1[CP/OL].Setauket,New York:Exeter Software,2000.
[10]NYBOM H.Comparison of different nuclear DNA markers for estimating intraspecific genetic diversity in plants[J].Mol Ecol,2004,13(5):1143-1155.
[11]宋丛文,包满珠.天然珙桐群体的RAPD标记遗传多样性研究[J].林业科学,2004,24(4):75-79.
SONG Congwen,BAO Manzhu.Study on genetic diversity of RAPD mark for naturalDavidia involucratapopulation [J].Sci Silv Sin,2004,24(4):75-79.
[12]李雪萍,李在留,贺春玲,等.珙桐遗传多样性的AFLP分析[J].园艺学报,2012,39(5):992-998.
LI Xueping,LI Zailiu,HE Chunling,et al.Genetic diversity of the endangered Davidia involucrata by AFLP analysis[J].Acta Hortic Sin,2012,39(5):992-998.
[13]张蕊,周志国,金国庆,等.南方红豆杉种源遗传多样性和遗传分化[J].林业科学,2009,45(1):50-56.
ZHANG Rui,ZHOU Zhiguo,JIN Guoqing,et al.Genetic diversity and genetic differentiation ofTaxuswallichianavar.mairei provenances[J].Sci Silv Sin,2009,45(1):50-56.
[14]张俊红,黄华宏,童再康,等.光皮桦6个南方天然群体的遗传多样性[J].生物多样性,2010,18(3):233 -240.
ZHANG Junhong,HUANG Huahong,TONG Zaikang,et al.Genetic diversity in six natural populations ofBetula luminifera from southern China[J].Biodiversity Sci,2010,18(3):233-240.
[15]HAMRICK JL,GODTM JW.Conservation genetics of endemic plant species[G]//AVISE JC,HAMRICK JL.Conservation Genetics:Case Histories from Nature.New York:Chapman and Hall,1996:281-304.
[16]ISHIHAMA F,UENO S,TSUMURA Y,et al.Gene flow and inbreeding depression inferred from fine-scale genetic structure in an endangered heterostylous perennial,Primula sieboldi[J].Mol Ecol,2005,14(4):983-990.
[17]BARTISH I V,JEPPSSON N,NYBOM H.Population genetic structure in the dioecious pioneer plant species Hippophae rhamnoides investigated by random amplified polymorphic DNA(RAPD)markers[J].Mol Ecol,1999,8(5):791-802.
[18]NYBOM H,BARTISH I V.Effects of life history traits and sampling strategies on genetic diversity estimates obtained with RAPDmarkers in plants[J].Evol Syst,2000,3(2):93-114.
[19]严茂粉,李向华,王克晶.北京地区野生大豆种群SSR标记的遗传多样性评价[J].植物生态学报,2008,32(4):938-950.
YAN Maofen,LIXianghua,WANG Kejing.Evaluation of genetic diversity by SSR markers for natural populations ofwild soyban(Glycine soja)growing in the region of Beijing,China[J].JPlant Ecol,2008,32(4):938-950.
[20]吴会芳,李作洲,黄宏文.湖北野生天麻的遗传分化及栽培天麻种质评价[J].生物多样性,2006,14(4):315-326.
WU Huifang,LI Zuozhou,HUANG Hongwen.Genetic differentiation among natural populations of Gastrodia elata(Orchidaceae)in Hubei and germplasm assessment of the cultivated populations[J].Biodiversity Sci,2006,14(4):315-326.
[21]陈良华,胡庭兴,张帆,等.用AFLP技术分析四川核桃资源的遗传多样性[J].植物生态学报,2008,32(6):1362-1372.
CHEN Lianghua,HU Tingxing,ZHANG Fan,et al.Genetic diversity of four Juglans populations revealed by AFLP in Sichuan Province,China[J].JPlant Ecol,2008,32(6):1362-1372.
[22]李楠,柳新红,李因刚,等.白花树天然群体的遗传多样性[J].林业科学,2012,48(11):49-56.
LINan,LIU Xinhong,LIYingang,et al.Genetic diversity in natural populations ofStyrax tonkinensis[J].Sci Silv Sin,2012,48(11):49-56.
[23]陈小勇.生境片断化对植物种群遗传结构的影响及植物遗传多样性保护[J].生态学报,2000,20(5):885-892.
CHEN Xiaoyong.Effects of habitat fragmentation on genetic structure of plant populations and implications for the biodiversity conservation[J].Acta Ecol Sin,2000,20(5):885-892.
Genetic structure of different natural Osmanthus fragrans populations based on AFLPmethod
XU Yichun1,HU Shaoqing2,ZHAO Hongbo3
(1.The Nurturing Station for the State Key Laboratory of Subtropical Silvicuture,Zhejiang A&F University,Lin,an 311300,Zhejiang,China;2.College of Civil Engineering and Architecture,Zhejiang Sci-Tech University,Hangzhou 310018,Zhejiang,China;3.School of Landscape Architecture,Zhejiang A&F University,311300 Lin,an,Zhejiang,China)
Osmanthus fragransis being concerned in recent years due to its high economic value and ornamental value.It can provide significant evidences for breeding of new cultivars and protecting of natural populationswith studying on the genetic diversity of natural populations ofO.fragrans.The genetic diversity of 96O. fragransindividuals of two natural populations from Quannan County of Jiangxi Province and Changting County of Fujian Province was estimated using amplified fragment length polymorphism(AFLP)method.A total number of 330 reproducible bands were amplified using seven AFLP primer combinations,and 276 bands were polymorphic with a proportion of 83.64%.At the species level,Shannon,s information index(I)was 0.428 3,the Nei,s genetic diversity(He)was 0.285 6,which indicated the genetic diversity of O.fragrans was rich;at the population level,Shannon,s information index and Nei,s genetic diversity of Fujian population was higher 1.5 than Jiangxipopulation,that showed Fujian population ownedmuch rich genetic resource.Moreover,AMOVA indicated themost total genetic variation waswithin populationswith a proportion of 71%and the lesswasamong the populations with a proportion of 29%.Meanwhile,a certain extent level of genetic differentiation(Gst=0.161 6)was detected among the populations and genetic flow was 2.594 9.[Ch,2 fig.4 tab.23 ref.]
botany;Osmanthus fragrans;AFLP;genetic diversity;genetic structure
Q948;S685.13
A
2095-0756(2014)02-0217-07
2013-09-01;
2013-10-29
国家自然科学基金资助项目(31101571);浙江省自然科学基金资助项目(Y3100332);浙江省农业重大科技专项重点项目(2012C12909-9);浙江农林大学青年创新团队项目(2010RC01)
徐沂春,从事观赏植物遗传育种研究。E-mail:x1356784541@163.com。通信作者:赵宏波,副教授,博士,从事观赏植物遗传育种和植物繁殖生态等研究。E-mail:zhaohb@zafu.edu.cn

