神经胶质细胞营养缺乏条件下引发细胞损伤效应分子机制研究
王海龙,王豪,裴思竹,孟晓佳,阎沁,邓玉林,马宏
(北京理工大学生命学院,北京 100081)
由于老年人口的不断增加和生活水平的提高,脑血管病的发病率仍在不断上升。并且随着社会的发展,脑力工作者不断增多,脑血管病对年轻人口的威胁也越来越大。统计资料表明:我国脑部疾病的发病率占人口的12.6%,其中脑血管疾病患者有3500万,每年新增260万。脑血管病的症状多见头晕、头痛、健忘、失眠、嗜睡、打哈欠、视物模糊等。治疗方法可分为直接改善脑心供血和能量代谢的对症治疗,以及阻止动脉硬化进程和消除狭窄闭塞血管的病因治疗[1]。毋庸赘言,脑血管病严重威胁了人们的健康,而对其致病的机理了解甚少。
Autophagy 是凋亡之外的程序性细胞死亡方式,在进化过程中高度保守,从酵母、果蝇到脊椎动物和人都可以找到参与autophagy 的同源基因。相对于主要降解短半衰期蛋白质的泛素-蛋白酶体系统,细胞的自噬被认为是参与绝大多数长半衰期蛋白质降解的主要途径[2,3]。当环境中的营养物质缺乏时,细胞通过自噬作用对胞内大分子物质进行降解,提供维持细胞存活所需的最低能量[4];某些毒素和病原体可通过自噬途径被包裹、降解清除[5,6];变性的胞浆成分,如因错误折叠而形成的凝聚蛋白或受损的细胞器也可通过自噬得到清除,从而使细胞免于受到进一步损伤[7]。因此,在某些疾病的早期阶段,激活自噬起到了阻止疾病进展的作用。
然而,另有报道称自噬还可参与Ⅱ型程序性细胞死亡,即非凋亡形式的程序性细胞死亡。在自噬形式的程序性细胞死亡中,中间丝与微丝重新分布,但并不降解,激动蛋白仍然保持聚合状态,因此细胞骨架系统保持完好;与之相反,在凋亡形式的程序性细胞死亡中,很早就出现激动蛋白的解聚和中间丝的降解,细胞骨架系统遭到破坏[8]。TRAIL(tumor necrosis factor-related apoptosis-inducing ligand)是肿瘤坏死因子(TNF)超家族的一个新成员,能够通过经典的诱导细胞凋亡的通路特异地诱导多种肿瘤细胞凋亡而对大多数正常细胞没有毒性[9,10]。本项研究假设在脑供血不足的情况下,负责供应营养的星形神经胶质细胞处于饥饿状态,从而诱发细胞自噬,而大量细胞自噬对TRAIL蛋白具有增进分泌的调控作用,最终TRAIL蛋白对脑细胞的坏死发挥了重要的调控作用。
1 材料与方法
1.1 材料
人神经胶质瘤细胞、U251,U87细胞均为本课题组购自中国协和医科大学细胞中心的细胞株;MEM(Hyclone),胎牛血清(fetal calf serum,FBS)(Hyclone);TRIZOL(Invitrogen),乙醇、异丙醇、氯仿(分析纯),逆转录酶(Promega公司),抗LC3B、Caspase3抗体(Cell Signal),辣根过氧化酶(HRP)标记抗鼠的二抗、HRP标记抗兔的二抗、HRP标记抗羊二抗分别购自中山生物技术公司,TRAIL ELISA分析试剂盒(R&D)。可见-紫外分光光度计(Shimaozu,UV-2550),超声细胞破碎仪(Cole-Pormer,CP100),倒置荧光显微镜(Olympus AO)。
1.2 MDC染色法
单丹(磺)酰戊二胺(MDC)染色法,是自噬发生过程中分析分子水平机制的一种特异的检测自噬体方法。具体操作为取饥饿不同时间点的U251细胞,加入终浓度0.05 mM MDC溶液, 37°C孵育10分钟。PBS清洗三次后迅速用荧光显微镜分析,激发波长380/420 nm,阳性信号为蓝绿色。
1.3 逆转录PCR
按照说明书进行R N A常规提取操作,测定R N A浓度,取等量R N A进行逆转录,反应结果通过琼脂糖凝胶电泳进行检测,相关基因的引物序列为:DR5(Forward): 5’-ATGGAACAACGGGGACAGAA-3’,DR5(Reverse):5’- CAGGAGATGCAATCTCTACCG-3’;T N F S F 1 0 F (T R A I L, F o r w a r d):5′-TCCTGGGAATCATCAAGGAG-3′,TNFSF10F (TRAIL,Reverse):5′-ACTAAAAAGGCCCCGAAAAA-3′;BECN1(Forward):,5′-GTCCTCCCCGTATCATACCATTC-3′,BECN1(Reverse):5′-ACGATGGTAAAGGGAGGGAAGT-3′;mTOR(Forward):, 5′-CGCTGTCATCCCTTTATCG-3′,mTOR(Reverse):5′-ATGCTCAAACACCTCCACC-3′;ULK3(Forward):, 5′- AAGGAGCAGGTCAAGATGAG-3′, U L K 3(R e v e r s e):5′-G T G C A A G A G C TA C G A A C A G A -3′;G A P D H(Forward):5’- CCTGCTTCACCACCTTCTTG -3’;GAPDH(Reverse): 5’- CCATCACCATCTTCCAGGAG-3’。PCR反应条件为:94℃,5 min;94℃ 40 s,52-60℃30 s,72℃ 30 s;72℃,10 min.
1.4 蛋白印记
培养72h的细胞常规方法离心收集后,加入细胞裂解液提取细胞总蛋白。蛋白定量后进行SDS-PAGE电泳进行分离和转膜,蛋白质印迹法检测凋亡相关Caspase蛋白和自噬相关蛋白LC3B的表达情况,抗体浓度按试剂说明操作。
1.5 统计学分析
本研究中所有实验数据采用 SPSS 12.0 统计学软件进行分析,数据以mean±sd表示,不同处理组间比较采用单因素方差分析。*P﹤0.05,代表具有显著性差异,每个实验独立重复三次,每次重复样本数n≥3。
2 结果
2.1 饥饿条件诱导胶质细胞自噬
自噬体形成依赖的第二个泛素样结合系统(Atg8)是位于自噬囊泡膜上,可与MDC特异结合,通过荧光染色,在荧光显微镜下可见阳性显色。通过MDC染色,荧光显微镜下可以看到U251细胞的自噬在饥饿的情况下增强(图1A)。通过自噬标志性蛋白LC3B的进一步westewn blot分析也可见U251细胞在饥饿的不同时间的自噬发生情况,即短时间的饥饿即有自噬发生(如4h),随着饥饿时间的延长(4h~12h),自噬均维持在一个较高的水平(图1B)。当向培养基中加入血清,恢复正常营养条件后,可以看到自噬水平可以被回调至一个基础水平(图1B)。
用Quantity one软件对LC3B蛋白的两种亚型进行灰度分析,可以看出在饥饿条件下的12h之内,LC3B-Ⅱ型对LC3B-Ⅰ型的灰度比值一直大于2,说明了自噬发生的较显著。而当营养恢复后4h到12h之内,LC3-Ⅱ型对LC3-Ⅰ型的灰度比值接近于1,回归到一般水平。综上实验结果显示,在饥饿模型下,星形神经胶质细胞U251的自噬现象非常显著,同时凋亡标志性蛋白存在较明显的水解活性。
2.2 饥饿引发凋亡相关TRAIL蛋白的分泌性表达
我们选取了两种人神经胶质瘤细胞,通过同样条件的饥饿处理,对其培养上清进行了TRAIL蛋白的酶联免疫分析,结果显示U251细胞在饥饿条件下TRAIL蛋白的分泌量短时间内(24h)提升显著,随着饥饿时间的进一步延长TRAIL的表达恢复至基础水平;相反另一种P53野生型的U87细胞在饥饿条件下的TRAIL蛋白分泌量一直保持在较高水平(图2A)。
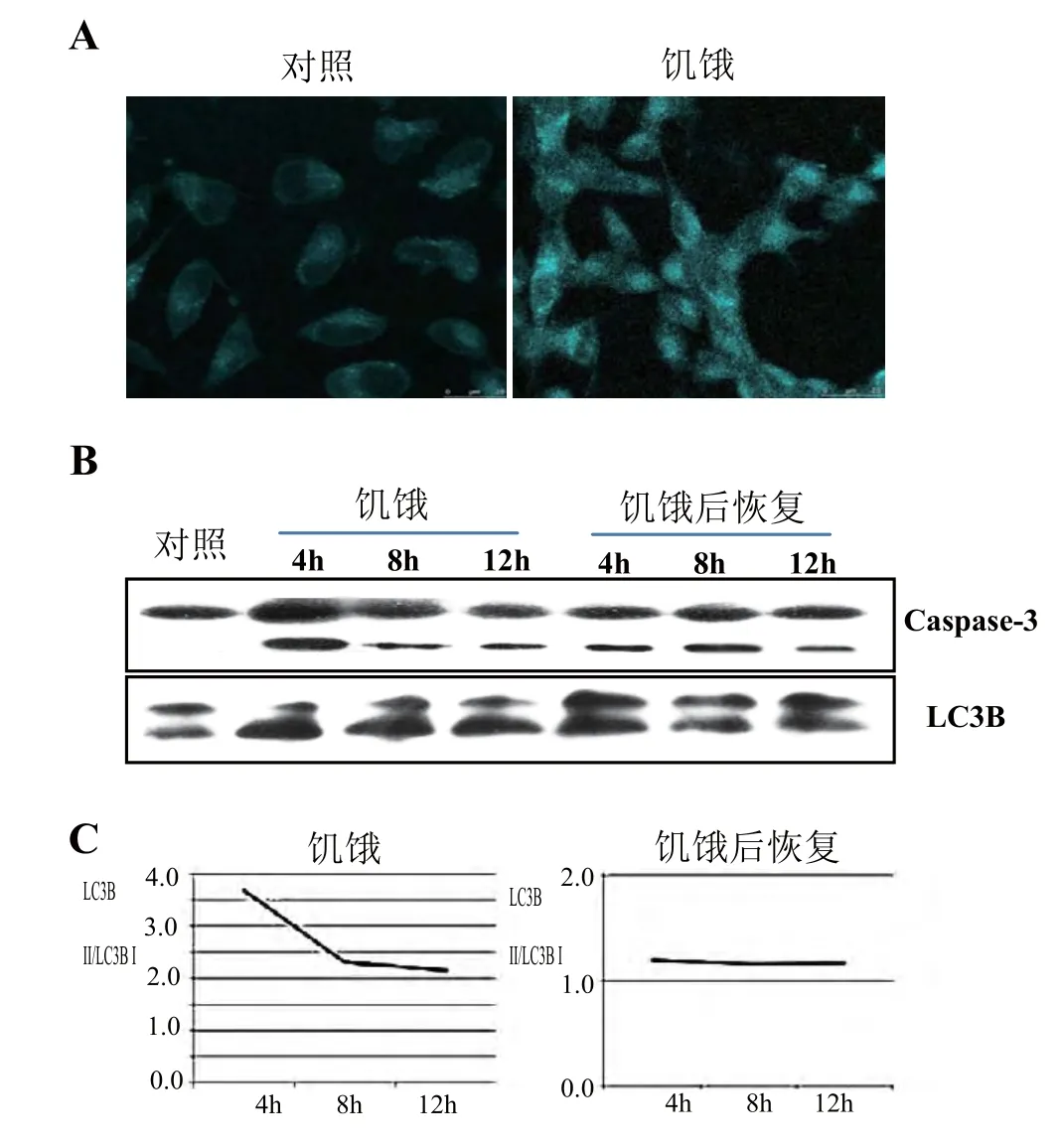
图1饥饿条件下细胞自噬和凋亡水平的分析
同时,我们对饥饿的U251细胞内与自噬和凋亡相关的信号分子的转录水平进行了研究,结果显示TRAIL基因在转录水平上得以上调,甚至在血清恢复12h后,TRAIL的表达水平依然在提高(图2B)。这与TRAIL蛋白的分泌表达效应相一致。因TRAIL是死亡诱导配体,故同时我们又检测了其细胞表面受体DR5的表达情况,结果显示饥饿的条件压力下,细胞仅有TRAIL的表达发生变化。
mTOR 信号通路可影响基因转录及蛋白质合成,在细胞生长增殖过程中起重要作用。在缺血饥饿状态下,自噬的发生主要由mTOR 通路调控,即 mTOR 信号通路失活,从而激活自噬信号通路,因此短期缺血可加强新生鼠脑神经细胞自噬和凋亡。激酶复合物ULK(UNC51-like)通过与mTOR的相互作用而将外界环境信号转化为细胞自噬特异性信号,从而激活细胞自噬通路。另有文献报道自噬在缺血期和再灌注期可能发挥不同作用,缺血初期主要起保护作用,而再灌注期自噬则引起细胞的损伤导致过量死亡[11]。为验证TRAIL的表达可能与饥饿或饥饿恢复期引发的自噬相关,我们同时检测了自噬相关信号通路分子mTOR和ULK3的变化。结果证明在饥饿处理早期mTOR的表达水平不降反升,而当恢复血清供给后,mTOR和ULK3的表达明显受到抑制,此时TRAIL的表达保持在较高的水平上。以上结果说明在饥饿和饥饿后恢复期均可诱导细胞发生自噬,而且自噬发生过程中,有某种因素可能在转录水平上调控了TRAIL蛋白表达,从而导致TRAIL的分泌水平增高。

图2自噬和凋亡相关信号分子在饥饿和饥饿后恢复期内的表达变化

图3饥饿细胞TRAIL抗体封闭后光学显微镜下的细胞生长情况
2.3 TRAIL抗体可阻断饥饿诱导的胶质细胞的损伤
既然从上述结果可推测到饥饿处理或饥饿后恢复均有可能导致细胞发生自噬,而且长时间饥饿条件应激下细胞会出现损伤,该损伤过程中我们又观察到高水平的TRAIL蛋白的转录和分泌表达,提示该种相关性可能参与了饥饿诱导的细胞损伤用。因此我们用无血清培养基(MEM)替换人神经胶质瘤U251细胞培养液,进行培养72h后,向实验组中加入TRAIL蛋白的抗体(0.5ng/mL)进行封闭,从光镜下可见与对照组相比,封闭TRAIL的实验组中,U251细胞的细胞密度和细胞生长状态明显高于对照组,该结果间接证明了TRAIL蛋白在饥饿条件引发的细胞死亡中的重要作用。
3 讨论
前期的实验结果很好地符合了实验预想,即在饥饿条件下,人脑神经胶质瘤细胞U251和U87细胞会发生自噬,这个过程中TRAIL蛋白的分泌量得到了提升,并且证明TRAIL蛋白在细胞死亡的过程中发挥了重要的作用。目前的问题有两个,一是自噬与TRAIL蛋白的分泌究竟有没有直接联系,以及在饥饿条件下细胞是如何调控TRAIL蛋白的分泌的;二是饥饿模型对于脑缺血环境是否具有完全模拟意义。前一个问题有待更多的基础研究,后一个问题是本项实验的后续工作内容,即动物模型。我们拟定对老鼠进行一侧颈动脉结扎的方法,来造成其半脑脑供血不足的情况,然后分别测定两个半脑内,脑细胞损伤情况以及TRAIL蛋白的分泌状况等信息,通过对比来更进一步地印证我们的实验猜想,并完善对这个过程中的机理的认识。
有文献研究表明在缺血状态下,氧和营养物质供给下降,内生ATP 水平也下降,激活 AMPK,同时抑制 mTOR,引起自噬增强。而在再灌注期,AMPK 激活和抑制mTOR不再起主导作用,而 Beclin1 的表达明显上调,同时胞内出现Ca2+浓度升高、氧化应激、内质网应激等,这些导致再灌注期的自噬增强[12],而这种增强有可能导致细胞进一步损伤。目前该损伤效应的分子机制还不是很清楚,本文从凋亡相关诱导配体TRAIL蛋白的角度给出了初步的解释,并可能为饥饿条件下细胞凋亡和自噬相互作用的研究提供新的思路。
致谢
本课题是在国家自然基金项目(31200636,11079054)的资助下完成的。
[1] Muller N G, Knight R T. The functional neuroanatomy of working memory: contributions of human brain lesion studies. Neuroscience,2006,139(1): 51-58.
[2] Mortimore G E, Poso A R. Intracellular protein catabolism and its control during nutrient deprivation and supply. Annu Rev Nutr,1987,7: 539-564.
[3] Klionsky D J, Emr S D. Autophagy as a regulated pathway of cellular degradation. Science, 2000,290:1717-1721.
[4] Kim J S, Klionsky D J. Autophagy, cytoplasm-to-vacuole targeting pathway, and pexophagy in yeast and mammalian cells. Annu Rev Biochem, 2000, 69: 303-342.
[5] Walker D H, Popov V L, Crocquet V P A,et al.Cytokine-induced,nitric oxide-dependent, intracellular antirickettsial activity of mouse endothelial cells. Lab Invest, 1997,76:129-138.
[6] Talloczy Z, Jiang W, Virgin H W,et al.Regulation of starvation and virus-induced autophagy by the eIF2alpha kinase signalling pathway. Proc Natl Acad Sci USA, 2002,99:190-195.
[7] Webb J L, Ravikumar B, Atkins J,et al.Alpha-synuclein is degraded by both autophagy and the proteasome. J Biol Chem, 2003,278:25009-25013.
[8] Bursch W, Hochegger K, Torok L,et al.Autophagic and apoptotic types of programmed cell death exihibit different fates of cytoskeletal fi laments. J Cell Sci, 2000, 113:1189-1198.
[9] Pitti R M, Marsters S A, Ruppert S,et al.Induction of apoptosis by Apo-2 ligand, a new member of the tumor necrosis factor cytokine family. J. Biol. Chem., 1996, 271 (22): 12687-12690.
[10] Song J J, Lee Y J. Differential cleavage of Mst1 by caspase-7/-3 is responsible for TRAIL-induced activation of the MAPK superfamily. Cell Signal, 2008, 20 (5): 892-906.
[11] 李欣志, 刘建勋. 缺血/再灌注过程中心肌细胞自噬研究进展. 中国药理学通报, 2008, 24: 704-707.
[12] 陈洪菊, 屈艺, 母得志. mTOR信号通路的生物学功能. Chemistry of life, 2010, 30(4):555-560.

