荧光标记DNA分子量内标的设计与制备
杨翩,王邦义,叶健,梁景青,赵兴春
(1. 山西医科大学法医学院,山西 太原,030001;2. 公安部物证鉴定中心,北京,100038)
人类遗传标记的检测和分析是法医学个体识别鉴定和亲子鉴定的理论基础。DNA遗传标记由于具有种属特异性及不随年龄、营养状况或环境变化而改变等特点[1],逐渐取代血清学检测技术成为20世纪80年代以来主要的遗传标记技术。1997年荧光STR检验方法被推出,随着激光激发多色荧光检测仪器的普及,STR荧光复合扩增毛细管电泳自动检测方法被法医DNA实验室普遍采用[2],该方法检测快速、灵敏度高,易于标准化和建立数据库,已成为主流的检测技术。荧光法检测中每个样本需加入DNA分子量内标,并与同时电泳的等位基因分型标准物进行自动比对,方能得出分型结果。DNA分子量内标是一系列已知片段大小且连续排列的荧光标记DNA片段,用于建立片段大小与片段到达检测窗时间的直线回归方程[3]。本文旨在设计并制备出一套国产化自主化的分子量内标,以降低实验及检案成本。
1 材料与方法
1.1 材料
PCR试剂(2×MasterMix)由公安部物证鉴定中心提供;PCR引物由上海生工生物工程有限公司合成;pMD18-T Vector购自TaKaRa公司。
1.2 方法
1.2.1模板的制备pMD18-T Vector连接D12S391的等位基因16割胶回收的DNA片段(Insert),经克隆后提取重组质粒,用核酸蛋白定量仪Nanodrop 1000( Thermo)测得质粒浓度C(ng/μl)后,在10μl酶切体系(质粒1μl、SalⅠ1μl、EcoRⅠ1μl、10×Buffer1μl,ddH2O 6μl)中37℃双酶切1h,95℃变性10min.根据质粒浓度将10μl酶切产物用TE稀释至1ng/μl,取1μl 1ng/μl酶切产物补TE至1ml成B液,取1μl B液补TE至1ml成E液,E液即为PCR扩增模板。
1.2.2引物的设计及测试用primer5.0软件分析pMD18-T Vector质粒的全序列,在其1963bp处至2284bp处,ATGC含量均一,无特殊二级结构。选取该500bp左右区域,在上游(5')设计一条固定引物,在下游设计合成目的片段的一系列下游引物。将设计出的上下游引物两两组合,对模板进行PCR扩增,挑选出能扩增出目的片段的上下游引物组合。
1.2.3PCR扩增及其产物检测10μlPCR扩增体系,内含2× MasterMix(公安部物证鉴定中心)5μl, 2.5μmol/L上下游引物各2μl,模板1μl. 扩增在9700 型基因扩增仪(Applied Biosystems公司)上进行,热循环参数为: 95℃ 11min; 94℃ 30s,59℃ 2min, 72℃ 1min,29个循环;60℃60min,4℃保存备用。
取1μl扩增产物加9μl的TE稀释10倍,再取1μl稀释后的PCR扩增产物与20μl去离子甲酰胺和内标混合物混匀后,95℃ 5min变性,-20℃ 5min,用ABI 3130XL 型遗传分析仪(Applied Biosystems 公司)进行电泳检测,ABI 3130XL Data Collection Software 3.1收集数据,GeneMapper IDV3.3软件自动分析数据。
1.2.4DNA分子量内标的制备取65bp、105bp、149bp、200bp、241bp、269bp、311bp、345bp、400bp、450bp、500bp等11个片段PCR产物各1μl,混匀后经ABI 3100XL遗传分析仪检测,根据峰高适当调整不同片段加样量,使各峰峰高达到均衡。
2 结果
2.1 引物筛选

图165bp-500bp11个片段的PCR扩增结果Figure 1 PCR amplification results of 11 fragments range from 65bp to 500bp
用上述引物设计方法共设计出了1条荧光标记的上游引物,24条普通下游引物。用上述10μl扩增体系对各对引物进行测试,最终挑选出11对合适的引物组合,结果见表1。
2.2 PCR扩增结果
PCR扩增产物电泳显示,65bp-500bp的DNA片段均已扩增出(图1),且片段大小与预期结果一致。
2.3 DNA分子量内标结果
将65bp-500bp的11个片段的扩增产物混合调平,调平加样量见表2,调平结果见图2,可见出峰位置正确,无明显杂峰,可用于毛细管电泳检测。
3 讨论
自从20世纪80年代DNA分析技术面世后,DNA测序仪或遗传分析仪得到了广泛应用。这类仪器分析DNA分子量时需要一个分子量标准来对样品进行计算,即分子量内标,又叫分子量内对照(Internal Lane Standard)[4,5]。与传统DNA分子量标准物(Marker)[6~8]相比,分子量内标属内对照,其携带有荧光标记并与待测样品在同一毛细管中检测,因此校对结果更加准确。另外,分子量内标所用的电泳介质是
毛细管电泳胶,分辨率可达1个bp,比琼脂糖凝胶分辨率(几十个bp)提高了几十倍,因此其精确度也更高[9]。
本实验选用pMD18-T载体为模板,与高阳等[10]选用pUC18质粒为模板相比,其优点在于:1. pMD18-T载体由pUC18载体改建而成,在pUC18载体的多克隆位点处的Xba I和Sal I识别位点之间插入了EcoR V识别位点,用EcoR V进行酶切反应后,再在两侧的3'端添加“T”而成。这样的处理使得pMD18-T载体连接Insert以及克隆的效率大大提高,从而能够得到较多量的模板。2. pMD18-T载体作为模板进行PCR之前,首先经过双酶切变为线状DNA,一方面缩短了模板长度,使PCR更有效的进行,另一方面将模板DNA由环状变为线状,提高了扩增效率、减少了非特异性扩增产物的产生。
本实验方法操作简单,经济快速,效率高,可用于大规模生产。制备出的DNA分子量内标可用于实验、检案及数据库建库等,具有法医物证学实际应用价值。
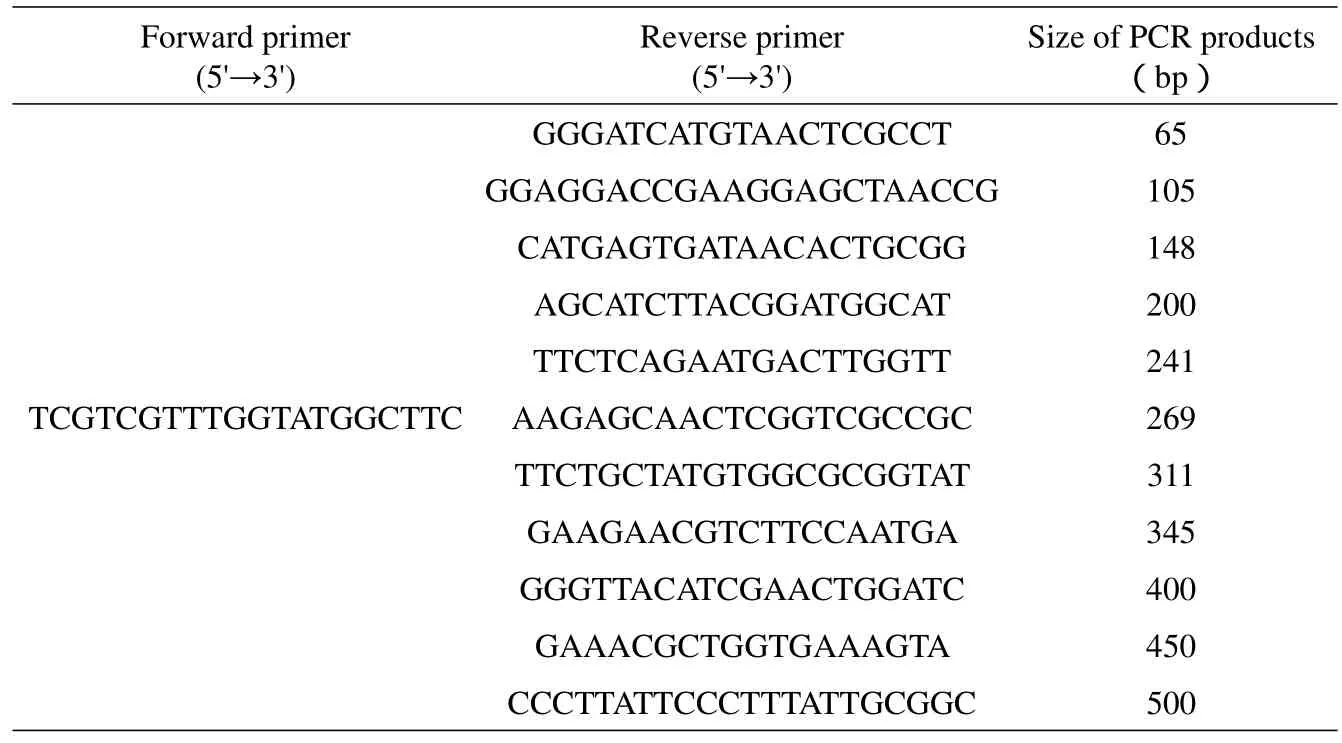
表1引物组合Table1 11 primer combinations
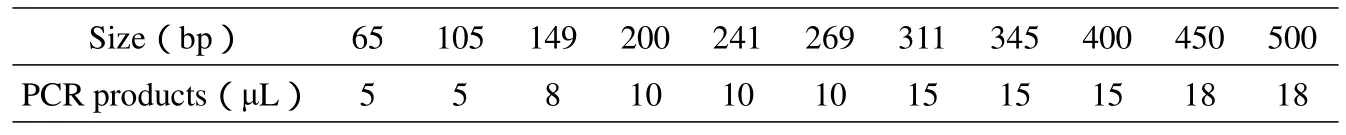
表2PCR扩增产物调平加样量Table2The content of 11 PCR products in the prepared DNA internal lane standard
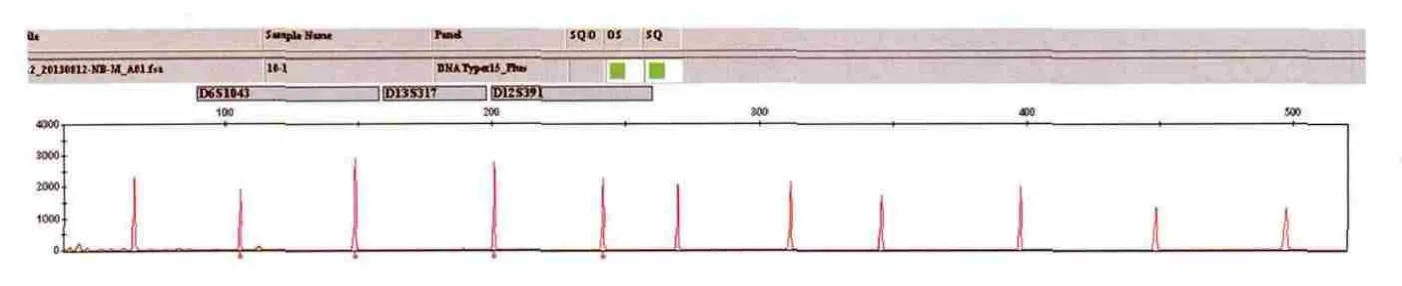
图2制作的DNA分子量内标Figure 2Prepared DNA internal lane standard
[1] 郑秀芬. 法医DNA分析. 北京: 中国人民公安大学出版社, 2002:6-7.
[2] 袁丽.遗传标记分析对DNA证据的影响. 证据科学, 2012, 20(6):737-749.
[3] 侯一平.法医物证学. 3版. 北京: 人民卫生出版社, 2009: 128-134.
[4] Dupuy B M, Olaisen B. A dedicated internal standard in fragment length analysis of hyperpolymorphic short tandem repeats. Forensic Sci Int, 1997, 86(3): 207-227.
[5] John M, Butter E, Buel F C , et al. Forensic DNA typing by capillary electrophoresis using the ABI Prism 310 and 3100 genetic analyzers for STR analysis. Electrophoresis, 2004, 25(10-11): 1397-1412.
[6] 刘慧娟, 冯志国, 何光源, 等. 利用PCR技术快速制备DNA分子量标准物. 生物技术, 2008, 18(2): 38-39.
[7] 王芳, 张俊河, 昝玉玺, 等. DNA标准分子量参照物的制备. 安徽农业科学, 2009, 37(15): 6903,6951.
[8] 张颖, 刘发珍, 李强, 等. DNA分子量标准制备技术: 方法与进展.中国生物工程杂志, 2009, 29(8): 119-123.
[9] Dieter L D, Deforce R E M, Millecamps, et al. Comparison of slab gel electrophoresis and capillary electrophoresis for the detection of the fluorescently labeled polymerase chain reaction products of short tandem repeat fragments. J Chromatogr A, 1998, 806(1): 149-155.
[10] 高阳, 陈初光, 马斌, 等. 一种分子量内标的制备方法及用该方法制备的分子量内标: 中国, 200710064713.4. 2007-10-10.

