老年肺部感染患者脂联素水平的变化及其意义
李智慧,杨长春,韩 盈*,王石磊
老年肺部感染患者脂联素水平的变化及其意义
李智慧1,杨长春2,韩 盈2*,王石磊3
(1新乡医学院,新乡 453003;2武警总医院南楼一科,北京 100039;3郑州大学第一附属医院呼吸内科,郑州 450052)
探讨老年肺部感染患者血清脂联素(APN)水平变化及其与C-反应蛋白(CRP)之间的关系,以期为老年肺部感染患者临床诊断及病情监测提供依据。选取2012年1月至2013年6月武警总医院肺部感染患者70例,其中重症肺部感染30例,轻症肺部感染40例;同时选取老年体检者40例为对照组。应用酶联免疫吸附法测定APN水平,免疫比浊法测定CRP,观察上述指标变化。与对照组比较,轻症肺部感染组、重症肺部感染组血清APN水平均明显降低[(8.89±1.93),(6.79±1.87)(4.89±1.13)mg/L;<0.05],CRD水平明显升高[(1.69±1.12),(13.87±2.72)(25.73±5.77)mg/L;<0.05]。肺部感染组APN水平与CRP呈负相关(=-0.35;<0.05)。logistic回归分析结果显示,APN(OR=0.350,95% CI 0.225-0.544;<0.05),空腹血糖(OR=3.939,95%CI 1.066-14.552;<0.05),年龄(OR=0.870,95%CI 0.781-0.969;<0.05)与老年肺部感染有关。APN水平在老年肺部感染患者显著降低,可能是一个新的抗炎因子,可作为老年肺部感染诊断和病情监测的新的标志物。
老年人;肺部感染;脂联素;C-反应蛋白
老年人肺部感染呈显著上升趋势,是导致死亡的重要原因之一。老年人肺部感染缺乏明显的临床症状和特异性指标,使诊断和病情监测尤为困难。目前临床常应用血常规、C-反应蛋白(C-reactive protein,CRP)等作为诊断感染及监测治疗效果的经典指标[1]。新近研究显示,脂联素(adiponectin,APN)与炎症反应密切相关,它是由脂肪细胞分泌的一种细胞因子,具有抗动脉硬化、抗炎等作用[2]。在心血管系统,APN能够显著抑制多种促炎因子[3],通过促进巨噬细胞抗炎因子——白细胞介素-10的产生及抑制脂多糖诱导的促炎症反应而发挥抗炎作用[4,5]。然而,APN在老年肺部感染患者中的变化及意义国内外尚未见报道。本文旨在探讨老年肺部感染患者血清APN变化规律,并与经典的炎症指标CRP相比较,以期为老年肺部感染的临床诊断及病程监测提供新的指标。
1 对象与方法
1.1 对象
根据第7版《内科学》肺炎及重症肺炎诊断标准[6],筛选入组患者。选取2012年1月至2013年6月在武警总医院住院>60岁的老年肺部感染患者70例,其中男性37例,女性33例,年龄60~90(70.43±6.51)岁。其中30例为重症肺部感染组,40例为轻症肺部感染组。两组观察对象性别、年龄、基础疾病相匹配,且常规行胸片、肺CT、痰培养检查。排除标准:(1)严重免疫抑制(如血液病、艾滋病、骨髓移植后)的患者;(2)肿瘤患者,肥胖,严重心、脑、肾、代谢综合征患者;(3)近期服用调脂药等;(4)患者突然中断治疗或者自动出院者。同期选取武警总医院体检中心40例健康体检者为对照组,其中男性21例,女性19例,年龄60~90(73.03±7.47)岁。
1.2 实验方法
常规测量血压(mmHg)、体质量(kg)、身高(m),计算体质量指数(body mass index,BMI),BMI=体质量(kg)/身高2(m2);患者空腹采静脉血,分别测空腹血糖(fasting blood glucose,FBG)、餐后2h血糖(2-hour postprandial blood glucose,2hPBG)、总胆固醇(total cholesterol,TC)、三酰甘油(甘油三酯,triglycerides,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、CRP。采用7600型日立全自动生物化学分析仪测定血脂指标、葡萄糖氧化酶法测定血糖,免疫比浊法测定CRP。
1.3 APN测定
入选病例于次日清晨抽取空腹静脉血3ml静置2h后,3000r/min离心10min、分离血清后于-80℃保存,采用酶联免疫吸附试验法(ELISA),芬兰(Labsystems Multiskan MS)352型酶标仪,统一测定血清APN。试剂盒均由北京方程生物公司提供,严格按说明书进行测定,批内差异<9%,批间差异<15%。
1.4 统计学处理
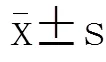
2 结 果
2.1 两组间基线资料的比较
对照组与感染组患者性别、年龄、BMI、收缩压、舒张压、TC、TG、HDL-C、LDL-C、FPG比较,差异无统计学意义(>0.05;表1)。
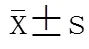
表1 两组患者基线资料比较
BMI: body mass index; SBP: systolic blood pressure; DBP: diastolic blood pressure; TC: total cholesterol; TG: triglycerides; HDL-C: high density lipoprotein cholesterol; LDL-C: low density lipoprotein cholesterol; FBG: fasting blood glucose; 2hPBG: 2-hour postprandial blood glucose. 1mmHg=0.133kPa
2.2 各组患者血清APN和CRP的比较
与对照组比较,轻症组和重症组APN水平明显降低,分别下降23.62%和44.99%,重症组APN水平及降低比例更显著,均有统计学意义(<0.05);与对照组比较,轻症组和重症组CRP水平明显升高,重症组更加明显,分别升高约8.3倍和15.2倍,均有统计学意义(<0.05;表2)。
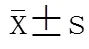
表2 各组血清APN和CRP的比较
APN: adiponectin; CRP: C-reactive protein. Compared with control group,*<0.05; compared with mild pulmonary infection group,#<0.05
2.3 APN与CRP的相关性分析
Pearson相关性分析结果显示,老年肺部感染患者APN与CRP呈负相关关系(=-0.350;<0.05)。
2.4 老年肺部感染相关因素logistic回归分析
APN、FPG、年龄与老年肺部感染有关(表3)。

表3 老年肺部感染相关因素logistic回归分析
BMI: body mass index; SBP: systolic blood pressure; DBP:diastolic blood pressure; TC: total cholesterol; TG: triglycerides; HDL-C: high density lipoprotein cholesterol; LDL-C: low density lipoprotein cholesterol; FBG: fasting blood glucose; 2hPBG: 2-hour postprandial blood glucose; APN: adiponectin
3 讨 论
老年患者由于器官老龄化,免疫功能下降,基础疾病多,容易发生感染,特别是肺部感染在临床极为常见,严重影响老年患者的生存率。因此,进一步探讨老年肺部感染的发病机制,发现新的炎症指标,对该疾病的诊治及病情监测具有重要意义。在心血管系统的研究证实,APN是较强的抗炎因子,通过减少单核巨噬细胞分泌细胞因子,减弱细胞因子的生理效能而发挥抗动脉粥样硬化作用[7]。但APN是否参与老年肺部感染病理生理过程,目前尚未见报道。
本研究发现,在老年肺部感染患者中,血浆APN水平显著下降,重症感染组下降更为显著,提示在感染等急性炎症反应中也会出现低APN血症,机体APN浓度的高低与感染的发生发展有关,APN参与了老年肺部感染的病理过程。CRP是急性炎症时的一种常见急性时相蛋白,由TNF-α,IL-6和IL-1等炎症因子刺激肝脏产生[8]。CRP在急性感染、炎症的6~8h内迅速升高,机体一旦恢复又迅速下降[9]。CRP不仅是一个炎症因子,其本身还是一个致炎因子。高敏CRP在体内高度稳定,不受饮食和昼夜节律影响[10],因此,CRP有利于反应炎症和病情进展程度。本研究显示,老年肺部感染患者CRP显著升高,随病情加重,升高更加显著。APN与CRP的相关分析显示,两者呈显著负相关,推测肺部感染时,APN可能是炎症反应的一种保护因子。
近年研究表明[11],APN是免疫反应的重要负性调节因子,可以抑制TNF-α等致炎因子的表达,终止炎症反应。有研究者[12]发现,使用基因重组APN可通过提高抗炎因子IL-10水平对刀豆球蛋白A诱发的小鼠急性肝损伤发挥保护作用。亦有研究[13]证实,通过提高脓毒症大鼠血液中的APN浓度,可以提高大鼠生存率,提示APN在感染性疾病中发挥保护效应。肺部感染本质是致病微生物引起的炎症反应,是由于致炎因子的大量释放,导致广泛的内皮受损、血流动力学紊乱,出现微血栓,弥散性血管内凝血(disseminated or diffuse intravascular coagulation,DIC),甚至多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)。本研究结果表明,在老年肺部感染患者中,APN浓度变化与CRP向相反方向变化,这种变化反映了感染状态下两种因子的相互拮抗。CRP是致炎因子,APN与其相互拮抗,说明APN具有潜在的抗炎作用。
APN抑制炎症反应的机制尚不清楚,可能与下列因素有关。(1)APN属于蛋白质一族,拥有胶原结构域,可以同内皮下胶原结合(血管壁损伤后暴露),从而阻断并控制炎症级联反应。(2)研究表明,APN在非感染性疾病中的抗炎机制是APN与其受体结合,通过受体介导的途径激活过氧化物酶体增殖物激活受体转导通路,抑制核因子κB(nuclear factor-kappa B,NF-κB)基因的转录活性,抑制促炎因子分泌及降低巨噬细胞活性[14]。APN在肺部感染中的抗炎机制是否与此相同,有待进一步研究。(3)APN能够直接中和细菌的脂多糖而减轻脓毒症症状[15]。(4)APN抑制TNF-α诱发单核细胞吸附,而且还能够直接拮抗TNF-α,减少TNF-α等促炎介质的生成[16]。
综上所述,APN水平在老年肺部感染患者随病情加重逐渐降低,APN水平与CRP呈负相关,APN可能是老年肺部感染中重要的一个新的抗炎因子,可作为老年肺部感染诊断和病情监测的新的标志物。
[1] Riedel S, Melendez JH, An AT,. Procalcitonin as a marker for the detection of bacteremia and sepsis in the emergency department[J]. Am J Clin Pathol, 2011, 135(2): 182−189.
[2] Brochu-Gaudreau K, Rehfeldt C, Blouin R,. Adiponectin action from head to toe[J]. Endocrine, 2010, 37(1): 11−32.
[3] Ohashi K, Parker JL, OuchiN,. Adiponectin promotes macrophage polarization toward an anti-inflammatory phenotype[J]. J Biol Chem, 2010, 285(9): 6153−6160.
[4] Folco EJ, Rocha VZ, Lopez-llascaca M,. Adiponectin inhibits pro-inflammatory signaling in human macrophages independent of interleukin-10[J]. J Biol Chem, 2009, 284(38): 25569−25575.
[5] Mandal P, Pritchard MT, Nagy LE. Anti-inflammatory pathways and alcoholic liver disease: role of an adiponectin/ interleukin 10/hemeoxygenase 1 pathway[J]. World J Gastroenterol, 2010, 16(11): 1330−1336.
[6] Lu ZY, Zhong NS. Internal Medicine[M]. 7th ed. Beijing: People’s Medical Publishing House, 2008: 18−19. [陆再英, 钟南山, 内科学[M]. 第7版. 北京: 人民卫生出版社, 2008:18−19.]
[7] Yamauchi T, Kadowaki T. Physiological and pathophysiological roles of adiponectin and adiponectin receptors in the integrated regulation of metabolic and cardiovascular diseases[J]. Int J Obes(Lond), 2008, 32 (Suppl 7): S13−S18.
[8] Liu X, Li B, Yi K,Role of C-reactive protein in pulmonary infectious diseases[J]. Pract Geriatr, 2012, 26(1): 84−85. [刘 雄, 李 兵, 易 坷, 等. C-反应蛋白在肺部感染性疾病中的应用价值[J]. 实用老年医学, 2012, 26(1): 84−85.]
[9] Yang CC, Gao M, Zhao HB,. Changes of lipoprotein in serum of senile patients with multiple organ dysfunction syndrome induced by pulmonary infections[J]. Chin J Nosocomiol, 2012, 22(14), 3031−3033. [杨长春, 高 敏, 赵海滨, 等. 脂蛋白在肺部感染致老年多器官功能不全中的变化[J]. 中华医院感染学杂志, 2012, 22(14): 3031−3033.]
[10] Ye Q, Kuang J. Clinical value of serum procalcitonin, C-reactive protein and erythrocyte sedimentation rate in the elder patients with pneumonia[J]. Chin J Lung Dis(Electronic Ed), 2011, 4(6), 37−38. [叶 青, 邝 军. 血清降钙素原、C-反应蛋白和血沉联合检测在老年肺炎中的临床价值[J]. 中华肺部疾病杂志(电子版), 2011, 4(6): 37−38.]
[11] Chen YJ, Wan T, Chen FP. Adiponectin: a new anti-inflammatory factor[J]. Int J Pathol Clin Med, 2009, 29(1): 86−92. [陈懿建, 万 通, 陈方平. 脂联素——一种新的抗炎因子[J]. 国际病理科学与临床杂志, 2009, 29(1): 86−92.]
[12] Wolf AM, Wolf D, Avila MA,. Up-regulation of the anti-inflammatory adipokine adiponectin in acute liver failure in mice[J]. J Hepatol, 2006, 44(3): 537−543.
[13] Uji Y, Yamamoto H, Maeda K,. Adiponectin deficiency promotes the production of inflammatory mediators while severely exacerbating hepatic injury in mice with polymicrobial sepsis[J]. J Surg Res, 2010, 161(2): 301−311.
[14] Yamamoto A, Kakula H, Miyachi H,. Involvement of the retinoid X receptor ligand in the anti-inflammatory effect induced by peroxisome proliferator-activated receptorγ agonist[J]. PPAR Res, 2011, 2011: doi: 10.1155/2011/840914.
[15] Folco EJ, Rocha VZ, Lopez-llasaca M,. Adiponectin inhibits pro-inflammatory signaling in human macrophages independent of interleukin-10[J]. J Biol Chem, 2009, 284: 25569−25575.
[16] LI S, Bao HG. Changes in expression of adiponectin in septic rat[J]. Chin J Clinicians(Electronic Ed), 2011, 5 (1): 125−129. [李 莎, 鲍红光, 脓毒症大鼠脂联素表达水平变化的实验研究[J]. 中华临床医师杂志(电子版),2011, 5 (1): 125−129]
(编辑: 王雪萍)
Change of adiponectin levels in elderly patients with pulmonary infection and its significance
LI Zhi-Hui1, YANG Chang-Chun2, HAN Ying2*, WANG Shi-Lei3
(1Xinxiang Medical College, Xinxiang 453003, China;2Department No.1 of South Building, General Hospital of Chinese People’s Armed Police Forces, Beijing 100039, China;3Department of Respiratory Diseases, the First Affiliated Hospital, Zhengzhou University, Zhengzhou 450052, China)
To investigate the changes of serum adiponectin (APN) level in the elderly patients with pulmonary infection and its relationship with C-reactive protein (CRP), in order to provide basis for clinical diagnosis and disease monitoring for these elderly patients.A total of 70 elderly patients with pulmonary infection admitted in our hospital from January 2012 to June 2013 were enrolled in this study. They were divided into severe pulmonary infection group (=30) and mild pulmonary infection group (=40). Another 40 elderly receiving physical examination in the same period served as controls. ELISA and immune turbidimetry were used to detect the serum levels of APN and CRP respectively.The serum levels of APN were significantly lower in the mild and severe pulmonary infection groups than in the controls [(6.79±1.87) and (4.89±1.13)(8.89±1.93)mg/L;<0.05], but that of CRP was significantly increased [(13.87±2.72) and (25.73±5.77)(1.69±1.12)mg/L;<0.05]. A negative correlation was found between the serum levels of CRP and APN in the elderly patients with pulmonary infection (=-0.350;<0.05). Logistic regression analysis showed that APN (OR=0.350, 95% CI 0.225−0.544;<0.05), fasting blood glucose (OR=3.939, 95% CI 1.066−14.552;<0.05), and age (OR=0.870, 95% CI 0.781−0.969;<0.05) were correlated with pulmonary infection in the elderly.Serum level of APN is decreased significantly in the elderly patients with pulmonary infection. It may be a new anti-inflammatory factor, and can be used as a new marker for diagnosis and disease monitoring of pulmonary infection in the elderly.
elderly; pulmonary infection; adiponectin; C-reactive protein
This work was supported by the Project of General Hospital of Chinese People’s Armed Police Forces (wz2012034).
R56
A
10.3724/SP.J.1264.2014.00008
2013−08−28;
2013−10−15
武警总医院院内课题(wz2012034)
韩 盈, E-mail: WJhanying@126.com

