单一畸形精子症患者辅助受孕临床结局分析*
任 默 李 博 黄剑磊 闵保华 夏 英
张 靖 马旭辉 张亨德 刘 闯 王晓红**
第四军医大学唐都医院妇产科(西安 710038)
单一畸形精子症患者辅助受孕临床结局分析*
任 默 李 博 黄剑磊 闵保华 夏 英
张 靖 马旭辉 张亨德 刘 闯 王晓红**
第四军医大学唐都医院妇产科(西安 710038)
目的研究精子形态与胚胎发育及临床结局的相关性。方法回顾性分析2012年4月至2013年5月期间来我中心就诊的不孕不育患者,严格按照WHO第五版规定,以单纯输卵管因素的不孕不育患者(n=112)为对照,其中接受体外受精(IVF)助孕的患者100例,胞浆内单精子显微注射(ICSI)患者12例,以男方单一畸形精子症和女方单一输卵管因素的不孕不育患者(n=75)为研究对象,其中接受IVF助孕的患者59例,ICSI患者16例,以植入前胚胎发育参数(正常受精率、卵裂率、优胚率)和临床妊娠结局(临床妊娠率、流产率)为指标,综合评估精子形态对胚胎发育和妊娠结局的影响。结果行IVF助孕后,对照组的胚胎正常受精率、卵裂率、优胚率、临床妊娠率、流产率分别为83.09%、94.52%、49.58%、62%、5.14%,单一畸形精子症患者的胚胎正常受精率、卵裂率、优胚率、临床妊娠率、流产率分别为83.64%、95.26%、41.88%、64.41%、6.95%,各项指标均无显著差异(P>0.05);行ICSI助孕后,对照组胚胎正常受精率、卵裂率、优胚率、临床妊娠率分别为86.54%、96.80%、43.08%、56%,单一畸形精子症患者的对应指标分别为87.78%、98.13%、41.67%、56.25%,均无统计学差异(P>0.05),但单一畸形精子症患者的流产率却显著升高,差异具有统计学意义(6.19%Vs19.5%,P<0.05)。结论 单一畸形精子症患者行ICSI助孕后胎儿流产风险显著增加。
精子/畸形; 精子注射, 细胞质内; 妊娠结局
世界卫生组织的最新调查数据显示,由于工作压力、环境污染等原因,导致不孕不育疾病的发病率在逐年上升。目前全世界范围内不孕不育的发生率约为15%~20%,全世界目前不孕不育症者50 00万~8 000万人。2012年《中国不孕不育现状调研报告》显示,我国育龄人群中不孕不育率已经高达12.5%,尤其是北京、上海等经济相对发达的地区,不孕不育的发病率甚至已经达到15%以上,其中男性因素占大约40%。在临床上,男性因素不育通常是根据异常的精子参数(如少精子、弱精子、畸形精子等)来诊断的。据报道,70%的男性不育症患者由精液或者精子异常导致。
对于引起男性不育症最常见的3种精液检查结果异常的类型为:少精子、弱精子和畸形精子症,而且这些表型绝大多数情况会偶联出现。目前,关于单一精液表型(如单一少精子症、单一弱精子症、单一畸形精子症)的男性不育研究甚少。我们知道,在临床上,严重的男性因素不育通常会通过卵细胞胞浆内单精子显微注射(ICSI)技术予以辅助助孕[1],而且,越来越多的中心开始将精子畸形率作为是否选择ICSI助孕的重要指标之一[2],但是对于单一畸形精子症的助孕方式的选择目前尚有争议[3]。而根据WHO 2010年第5版《人类精液及精子一宫颈黏液相互作用实验室检验手册》的方法进行精液常规分析,采用巴氏染色法进行精子形态分析。将畸形精子症的定义阈值从第四版的85%提高到了96%,那么,2010年之前关于畸形精子症的研究就需要重新评估,而且新定义之后的畸形精子症患者的精子质量如何,接受何种助孕治疗,辅助助孕后的临床结局如何都亟需进一步研究。
因此,本研究选择单一畸形精子症患者为研究对象,以植入前发育参数和临床妊娠结局为指标,综合评估精子形态与临床结局的相关性,现将研究结果报道如下。
资料与方法
一、临床资料
2012年4月至2013年5月期间在本院生殖医学中心接受助孕治疗的夫妇187对,男方年龄≤40岁。女方年龄≤35岁。平均不育年限3.62年。所有男性患者均严格按WHO第5版《人类精液及精子-宫颈黏液相互作用实验室检验手册》[4]推荐的方法进行精液常规分析,采用巴氏染色法进行精子形态分析。单一畸形精子症诊断依据:精液量>2 mL,精子密度>15 ×106/mL,a级精子>25%或(a+b)级精子>32% ,检测2次以上正常形态精子≤3%。正常形态精子则>15%。女方筛选标准为各项常规检测指标均正常,仅为单一输卵管因素不孕。排除标准为:女方年龄>35岁,多囊卵巢综合征、卵巢囊肿、子宫肌瘤、子宫内膜异位症、子宫内膜息肉、盆腔结核及子宫畸形等。
二、研究分组
根据男方精液检测指标将接受试管婴儿助孕的187对夫妇分为两组:畸形精子症组:75例,纳入标准为正常形态精子≤3%;正常对照组:112例,纳入标准为正常形态精子>15%。
三、精液质量和精子形态分析方法和标准
所有男性患者均严格按WHO第5版《人类精液及精子—宫颈黏液相互作用实验室检验手册》[4]推荐的方法进行精液常规分析,采用巴氏染色法进行精子形态分析,连续计数分析200条以上精子形态。正常精子形态标准是:精子头椭圆形,长度为4.0~5.0μm,宽为2.0~3.5μm,长宽比1.50~1.75;顶体占头部的40%~70%;中段宽度<1μm,大约为头部长度的1.5倍;胞浆小滴应小于正常头部大小的一半;尾部直且均一,非卷曲,长约为45μm。
四、促排卵治疗
女方采用短效长方案、长效长方案及拮抗剂方案促排卵,注射人绒毛膜促性腺激素(HCG)后36h,在阴道B超监测下采集卵泡。HCG日女方子宫内膜形态B-C型及以上,无卵巢囊肿及输卵管积水,无盆腔积液。胚胎移植日子宫内膜形态为B-C型及以上,内膜厚度≥0.8cm。
五、受精、胚胎培养与胚胎移植
受精后l6~18h观察卵子受精情况,以双原核(2PN)卵子作为正常受精卵,第3日按照Peter分级标准选[5],选择优质胚胎进行移植,并同时给予黄体支持。
六、妊娠结局判断
移植后35d行腹部彩超检查,有妊娠囊或原始心管搏动,确定为临床妊娠。流产:妊娠丢失发生在孕28周前。
七、观察指标
观察指标包括植入前胚胎发育参数(正常受精率、卵裂率、优胚率)和临床妊娠结局(临床妊娠率、流产率)。
八、统计学方法
结 果
本研究分析了精子形态畸形与辅助受孕后临床妊娠结局之间的相关性。如表1所示,对照组患者行体外受精技术(IVF)助孕后,胚胎正常受精率为83.09%,卵裂率为94.52%,优胚率为49.58%,临床妊娠率为62%,流产率为5.14%。单一畸形精子症患者行IVF助孕后,胚胎正常受精率为83.64%,卵裂率为95.26%,优胚率为41.88%,临床妊娠率为64.41%,流产率为6.95%,各项指标均无显著差异(P>0.05);对照组患者行ICSI助孕后,胚胎正常受精率为86.54%,卵裂率为96.80%,优胚率为43.08%、临床妊娠率为56%,单一畸形精子症患者行ICSI助孕后,胚胎正常受精率为87.78%,卵裂率为98.13%,优胚率为41.67%,临床妊娠率为56.25%,各项指标均无统计学差异,但单一畸形精子症患者的流产率却显著升高,差异具有统计学意义(6.19%Vs19.5%,P<0.05)。
表1 畸形精子症患者胚胎植入前发育和临床妊娠结局(±s)
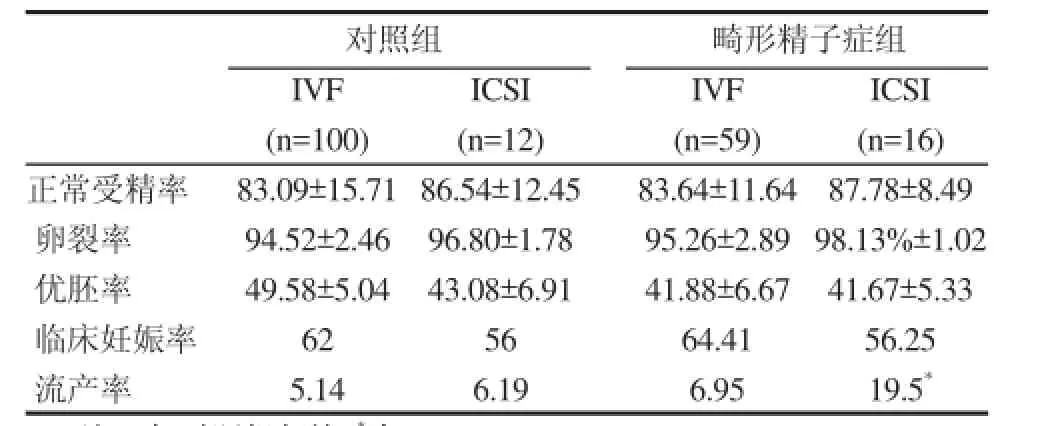
表1 畸形精子症患者胚胎植入前发育和临床妊娠结局(±s)
注:与对照组相比,*为P<0.05
对照组 畸形精子症组IVF ICSI IVF ICSI (n=100) (n=12) (n=59) (n=16)正常受精率 83.09±15.71 86.54±12.45 83.64±11.64 87.78±8.49卵裂率 94.52±2.46 96.80±1.78 95.26±2.89 98.13%±1.02优胚率 49.58±5.04 43.08±6.91 41.88±6.67 41.67±5.33临床妊娠率 62 56 64.41 56.25流产率 5.14 6.19 6.95 19.5*
讨 论
有研究[6,7]显示,单一畸形精子症(精子密度和活力均正常)在男性不育患者中占24.8%,而且随着社会压力增大、环境污染严重等,其发病比例仍在逐年攀升,从而引起了国内外生殖学家的高度关注[8]。
目前,单一畸形精子症是否作为ICSI治疗的适应证仍存在着争议[9],一方面对该类患者行ICSI助孕具有提高卵母细胞利用率,减少受精率低或受精失败的优点;另一方面,我们也要充分考虑到畸形精子症患者精子的“质量”问题,因为ICSI的助孕方式跨越了精子穿透卵母细胞透明带与卵子结合完成受精这一“优胜劣汰”的自然过程,极有可能将有遗传缺陷的精子注入卵母细胞导致被动受精,从而给下一代带来隐患。我们的研究结果显示,单一畸形精子症患者接受ICSI助孕后,虽然在正常受精率、卵裂率、优胚率、临床妊娠率等指标方面与对照组(精液参数正常)相比,无显著差异,这与Brian等[10]的研究报道相一致,但是其流产率却显著增加。这提示我们,对畸精症的评估,应该综合更多的指标,从而更好的为其辅助受孕的安全性提供理论依据。同时,我们的研究结果也显示,单一畸形精子症患者行IVF助孕后,流产率与对照组无显著差异,这可能是因为精卵结合的自然选择过程,有助于筛选出“遗传正常”的精子,从而在一定程度上避免了流产的发生。因此,我们认为,对畸形精子症患者(尤其是合并少精子症,无法进行IVF辅助助孕的患者)辅助受孕的关键,是要进行精子筛选,只有这样才能从源头上避免或者改善助孕后的临床妊娠结局。目前,精子筛选的方法也比较多,主流的是膜电位筛选法[11]、透明带结合筛选法[12,13]、MSOME[14,15]等,从而为畸形精子症患者的精液评估以及临床治疗提供了参考。
因此,在下一步研究工作中,我们将会针对临床上发现的单一畸形精子症患者行ICSI助孕后流产率增加的现象,从精子表观遗传、DNA完整性、以及细胞器形态等方面进行综合的研究和评估,从而为其能够安全应用于临床,奠定一定的理论基础并提供技术支持。
1 Lee RK, Hou JW, Ho HY,et a1. Sperm morphology analysis using strict criteria as a prognostic factor in intrauterine insemination.Int J Androl2002; 25(5): 277-280
2 崔险峰. 应用严格精子形态学测定法评估精子形态对体外受精率的影响. 中华男科学杂志 2006; 12(9): 842-843
3 Nallella KP, Sharma RK, Aziz N,et al. Signif cance of sperm characteristics in the evaluation of male infertility.Fertil Steril2006; 85(3): 629-634
4 World Health Organization. WHO laboratory manual for the examination of human semen and sperm-cervical mucus interaction. Camdg London: Cambridge University Press, 2010: 215
5 Brinsden PR(ed). 体外受精与辅助生殖: Bourn Hall诊所临床实践与实验室操作指南, 223-239. 北京: 人民卫生出版社, 2009
6 蒋敏, 陈新敏, 岳焕勋, 等. 精子形态学分析在男性不育症诊断中的应用. 中国优生与遗传杂志 2007; 15(6): 106-107
7 Knez K, Tomazevic T, Zorn B,et al.Intracytoplasmic morphologically selected sperm injection improves development and quality of preimplantation embryos in teratozoospermia patients.Reprod Biomed Online2012; 25(2): 168-179
8 El Khattabi L, Dupont C, Sermondade N,et al.Is intracytoplasmic morphologically selected sperm injection effective in patients with infertility related to teratozoospermia or repeated implantation failure?Fertil Steril2013; 100(1): 62-68
9 Alder A, La Bella PA, Mc Caffrey C,et al.Poor sperm morphology-is it only ICSI,or is there another alternative?Fertil Steril2000; 74(3 Suppl 1): S219-S221
10 Keegan BR, Barton S, Sanchez X,et al.Isolated teratozoospermia does not affect in vitro fertilization outcome and is not an indication for intracytoplasmic sperm injection.Fertil Steril2007; 88(6): 1583-1588
11 Chan PJ, Jacobson JD, Corselli JU,et al. A simple zeta method for sperm selection based on membrane charge.Fertil Steril2006; 85(6): 481-486
12 Liu F, Qiu Y, Zou Y,et al. Use of zona pellucidabound sperm for intracytoplasmic sperm injection produces higher embryo quality and implantation than conventional intracytoplasmic sperm injection.Fertil Steril2011; 95(2): 815-818
13 Black M, Liu de Y, Bourne H,et al. Comparison of outcomes of conventional intracytoplasmic sperm injection and intracytoplasmic sperm injection using sperm bound to the zona pellucida of immature oocytes.Fertil Steril2010; 93(2): 672-674
14 Setti AS, Paes de Almeida Ferreira Braga D, Iaconelli A Jr,et al. Twelve years of MSOME and IMSI: a review.Reprod Biomed Online2013; 27(4): 338-352
15 Boitrelle F, Guthauser B, Alter L,et al. High-magnif cation selection of spermatozoa prior to oocyte injection: confirmed and potential indications.Reprod Biomed Online2014; 28(1): 6-13
(2013-12-12收稿)
The relationship between isolated teratozoospermia and clinical outcomes*
Ren Mo, Li Bo, Huang JiangLei, Min Baohua, Xia Ying,
Zhang Jing, Ma Xuhui, Zhang Hengde, Liu Chuang, Wang Xiaohong**Department of Obstetrics and Gynecology ,Tangdu Hospital, The Forth Military Medical University, Xi’An 710038, Shanxi, China
Wang Xiaohong, Email: xhwang_1968@126.com
ObjectiveTo determine the relationship between sperm morphology, embryonic development and clinical outcomes.MethodsClinical data of infertility patients in our center were retrospectively analyzed from April 2012 to May 2013. In accordance with criteria (the f fth version of WHO), pure tubal factor infertility patients (n=112) were taken as the control, including 100 couples who underwent IVF and 12 couples for ICSI. The infertility patients (n=75) such as men with isolated teratozoospermia or the women with a single tubal factor were the research object in the study, including 59 couples who underwent IVF and 16 couples for ICSI. The pre-implantation embryo development parameters (including normal fertilization rate, cleavage rate, quality embryos rate) and clinical pregnancy outcomes parameters (clinical pregnancy, spontaneous abortion rate) were indicators to assess the relationship between sperm morphology, embryo development and pregnancy outcomes.ResultsAfter IVF, fertilization rate, cleavage rate, excellent embryo rate, clinical pregnancy, miscarriage rates of the control group were 83.09%, 94.52%, 49.58%, 62% and 5.14%. The embryos normal fertilizationrate, cleavage rate, quality embryos rate, clinical pregnancy, spontaneous abortion rate of the study group were 83.64%, 95.26%, 41.88%, 64.41% and 6.95%, these indicators mentioned above had not significant differences (P>0.05); After ICSI, embryos normal fertilization rate, cleavage rate, quality embryos rate, clinical pregnancy rates of the control group were 86.54%, 96.80%, 43.08%, 56% and 6.19%, corresponding indicators of the isolated teratozoospermia patients were 87.78%, 98.13%, 41.67%, 56.25%, 19.5%, there were no statistical differences (P> 0.05), but the isolated teratozoospermia patients had signif cantly higher rate of spontaneous abortion with a signif cant difference (the control group VS the isolated teratozoospermia patients group,P<0.05).ConclusionIsolated teratozoospermia patients after undergoing ICSI might signif cantly increase the risk of spontaneous abortion.
spermatozoa/abnormatilies; sperm injections, intracytoplasmi; pregnancy outcome
10.3969/j.issn.1008-0848.2014.04.008
R 321-33
资助: 本研究受国家自然科学基金项目资助(项目号:81300531)
**
, Email: xhwang_1968@126.com

