非清髓单倍体相合骨髓移植后自然杀伤细胞参与急性移植物抗宿主病的免疫病理学研究
雷英英,段连宁,罗 渊,郭广进,许鹏飞,陆承荣,王 喆,向培德
1空军总医院中心实验室,北京 100142;2河北北方学院研究生部,河北张家口 075000
非清髓单倍体相合骨髓移植后自然杀伤细胞参与急性移植物抗宿主病的免疫病理学研究
雷英英1,2,段连宁1,罗 渊1,郭广进1,许鹏飞1,陆承荣1,王 喆1,向培德1
1空军总医院中心实验室,北京 100142;2河北北方学院研究生部,河北张家口 075000
目的 研究自然杀伤(natural killer,NK)细胞在非清髓单倍体相合骨髓移植中参与急性移植物抗宿主病(acute graft vs host disease,aGVHD)过程的免疫病理。方法本实验建立了以C57BL/6小鼠为供鼠、CB6F1小鼠为受鼠的急性移植物抗宿主病模型。观察小鼠发生aGVHD的症状体征,流式细胞术检测小鼠移植后嵌合率及NK细胞活化受体NKp46表达强度,免疫荧光染色观察aGVHD靶器官部位NK细胞分布。结果移植鼠aGVHD发生率80%,移植+15 d达到完全嵌合,移植+25 d左右小鼠出现体质量减轻、耸毛、弓背等典型aGVHD症状。发生aGVHD小鼠外周血NK细胞NKp46表达强度低于未发生aGVHD小鼠,受鼠肝汇管区有供鼠源NK细胞浸润。结论在非清髓单倍体相合骨髓移植中NK细胞参与了肝处移植物抗宿主病的病理反应,NK细胞活化受体NKp46表达强弱与aGVHD的发生相关,NKp46表达强度可能为aGVHD诊断提供依据。
非清髓单倍体相合骨髓移植;急性移植物抗宿主病;自然杀伤细胞;NKp46
移植物抗宿主病是影响同种异基因造血干细胞移植患者生存、复发及生活质量的主要并发症。急性移植物抗宿主病(acute graft vs host disease,aGVHD)主要影响受者肝、皮肤、肠道等脏器功能。减低毒性的预处理方案既能获得较好的治疗效果又可降低移植相关毒性,非清髓半相合造血干细胞移植由于解决了供髓来源问题而拥有良好的临床治疗优势。NKp46是自然杀伤(natural killer,NK)细胞的活化性受体之一,其表达水平与杀伤活性密切相关,NK细胞的活化在多种疾病中发挥重要作用[1-2]。NK细胞是同种异基因造血干细胞移植后首先恢复的免疫细胞,NKp46在aGVHD病理损伤方面的机制尚未见深入研究[3-4]。本研究以小鼠单倍体相合骨髓移植模型为对象,探讨NKp46表达强度与aGVHD发生的关系及NK细胞在aGVHD靶器官部位的免疫病理。
材料和方法
1 实验动物 供鼠C57BL/6(H-2b,♂),受鼠CB6F1(Balb/c×C57BL/6,H-2b/d,♀),8 ~ 12周龄,体质量18 ~ 22 g,SPF级,购于北京维通利华实验动物技术有限公司,饲养于解放军304医院动物实验中心无菌层流柜SPF环境中,垫料经过60Co照射处理,饲料经紫外线消毒处理,饮用过滤除菌水,小鼠饲养5只/笼。
2 主要试剂及仪器 Alexa Fluor 488 anti-mouse CD3e,Alexa Fluor 647 anti-mouse H-2d,Alexa Fluor 647 mouse IgG2a同型对照(Biolegend),Anti-NKp46抗体,PE Rat IgG2a同型对照(Miltenyi Biotec),Rabbit Anti-NCR1抗体(北京博奥森生物技术有限公司),Anti-MHC classⅠ抗体(abcam,ab15680),FICT记山羊抗大鼠IgG、Alexa Fluor 594标记山羊抗兔IgG及冷冻切片包埋剂(中杉金桥),BD FACS lysing solution(溶血素)(BD Bioscience),FACA Calibur流式细胞仪为美国BD公司。
3 移植预处理 移植前5 d对小鼠进行标记、称重,开始饮用含庆大霉素3.2×104U/L和红霉素250 mg/L过滤除菌水。单次照射组小鼠接受环磷酰胺200 mg/kg(-2 d、-1 d)腹腔注射及60Co 450 cGy全身照射(0 d),照射剂量率为133 cGy/min。分次照射组小鼠移植前接受环磷酰胺200 mg/kg(-1 d)腹腔注射及200 cGy60Co分次全身照射(-2 d、-1 d,两次照射间隔24 h),照射剂量率为66 cGy/min,60Co照射源为军事医学科学院辐射中心。
4 移植物准备及移植 移植预处理后的小鼠平均分为3组:对照组、小剂量脾细胞移植组、大剂量脾细胞移植组。脱颈处死C57BL/6供鼠,75%酒精充分浸泡10 min,取脾于200目金属网充分研磨,制成单细胞悬液。无菌取股骨胫骨,5 ml注射器连接4#针头插入骨髓腔1 ~ 2 mm,用含10%胎牛血清的RPMI 1640培养基冲洗,直至骨髓腔变白,使骨髓细胞过4#注射器针头制成单细胞悬液。移植当天CB6F1接受供鼠骨髓细胞3×107和脾细胞6×107或1×108尾静脉注射移植,对照组小鼠注射等体积0.9%氯化钠注射液。
5 aGVHD观察 移植后观察小鼠发生aGVHD的症状体征:体质量下降、活动度减低、弓背、耸毛、脱毛,及时对小鼠aGVHD程度进行评估。各指标按严重程度评分0 ~ 2分,共10分,评分>6分为严重aGVHD。
6 嵌合率及NKp46平均荧光强度值检测 移植后15 d、30 d、45 d、60 d经小鼠尾静脉采血100 μl,10 μl肝素抗凝,标本均分成2管,实验管加入CD3-Alexa Fluor 488 1μl、H-2d-Alexa Fluor 647 1 μl和 NKp46-PE 1 μl,对照管加入H-2d和NKp46同型对照各1 μl,室温避光反应20 min,加入红细胞裂解液2 ml,室温避光反应10 min,1 500 r/min离心10 min,弃去上清PBS漂洗2次,离心弃上清,加入400 μl PBS后上机,用Cell Quest software进行分析。检测H-2d(-)CD3(+)细胞群在CD3(+)细胞群中所占比例,即为受鼠移植嵌合率。同时圈定供鼠和受鼠NK细胞,测定其活化受体NKp46平均荧光强度值。
7 病理学检查 处死发生aGVHD的小鼠,采集皮肤、肠道、肝标本,甲醛固定,石蜡包埋切片,HE染色观察病理学改变。
8 免疫荧光染色 采集发生aGVHD小鼠的皮肤、肠道、肝标本,冷冻切片包埋剂OCT包埋干冰速冻后于-80℃冰箱保存。染色时将标本切为5 μm切片晾干,放入预冷的丙酮中固定15 min,PBS洗3次,每次5 min。1∶20山羊血清室温封闭10 min,倾去山羊血清,勿洗,Anti-mouse H-2d一抗(1∶200)、Rabbit Anti-NCR1一抗(1∶400)孵育4℃过夜,PBS洗3次,每次5 min,孵育二抗Anti-Rabbit IgG-Alexa Fluor 594(1∶500)、Anti-Rat IgG-FITC(1∶100),37℃孵育30 min,PBS洗3次,每次5 min,封片,荧光显微镜观察,采图,分析。
9 统计学处理 采用SPSS17.0软件进行统计分析,实验数据采用t检验,表示,P<0.05为差异有统计学意义。
结 果
1 aGVHD小鼠模型的建立60Co 450 cGy(0 d)单次全身照射及环磷酰胺200 mg/kg(-2 d、-1 d)腹腔注射预处理的大小剂量移植组小鼠均未发生aGVHD,对照组小鼠长期存活。分次照射组小鼠移植前接受200 cGy60Co分次全身照射(-2 d、-1 d,两次照射间隔24 h)及环磷酰胺200 mg/kg(-1 d)腹腔注射,同样移植供鼠骨髓细胞3×107和脾细胞6×107或1×108,11只(共14只)小鼠发生了aGVHD,嵌合率稳定,为本实验提供了稳定的动物模型。分次照射组aGVHD严重程度及发生率在大剂量脾细胞移植组与相对小剂量脾细胞移植组无明显差异。
2 小鼠体质量、白细胞波动 小鼠体质量在移植5 d左右降至最低,其后逐渐恢复,移植鼠较对照鼠体质量低。在移植后45 ~ 50 d移植鼠体质量又发生了一定程度的下降,与aGVHD相关。移植后小鼠白细胞也在第5天降至最低,在40 d以后发生了与aGVHD加重相关大幅度下降。移植鼠与对照鼠体质量、白细胞差异无明显统计学意义。见图1。

图 1 小鼠体质量、白细胞波动趋势(n=7) LDT: 小剂量移植组;HDT: 大剂量移植组Fig. 1 Body weight and blood picture of mice after transplantation(n=7) LDT: low dose transplantation, HDT: high dose transplantation


图 3 小鼠移植后嵌合率及NKp46表达强度 A:移植嵌合率:H-2d(-)CD3(+)细胞在CD3(+)细胞中所占的比例;B: NKp46平均荧光强度 H-2d(-)NKp46(+)为供者NK细胞;C: 供鼠NK细胞NKp46平均荧光强度值Fig. 3 Chimerism and NKp46 expression in mice after transplantation A: transplantation chimerism rate; B: mean fuorescence intensity of NKp46; C: mean fuorescence intensity of donor NKp46
3 移植鼠aGVHD表现 分次照射组小鼠在移植后第25天左右出现了小鼠体质量减轻、耸毛、弓背、活动度减低、皮毛不完整等aGVHD典型表现,之后逐渐进展,45 ~ 50 d aGVHD症状加重。见图2。



图 2 典型aGVHD表现 A: 活动度减低; B: 皮毛完不完整、耸毛; C: 弓背Fig. 2 Reduced activity (A), intact fur and skin (B), hunched posture in aGVHD mice (C)
4 移植嵌合率及NKp46平均荧光强度的监测分次全身照射组大剂量移植组和小剂量移植组小鼠在移植后15 d已达到完全供者嵌合状态,NK细胞活化受体NKp46平均荧光强度值在小鼠出现aGVHD症状后的两次检测中,发生aGVHD小鼠的NKp46平均荧光强度值均低于未发生aGVHD小鼠。见图3。
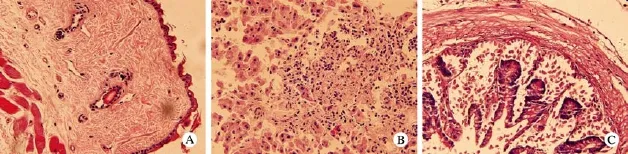
图 4 小鼠aGVHD靶器官组织化学染色 A: 小鼠皮肤; B: 小鼠肝; C: 小鼠肠道Fig. 4 Histochemical staining of fur (A), liver tissue (B) and intestine tissue (C) from aGVHD mice

图 5 小鼠肝免疫荧光染色 A: 正常小鼠肝NK细胞; B: 未发生aGVHD移植鼠肝NK细胞; C: 发生aGVHD移植鼠肝NK细胞(×200)Fig. 5 Immunofuorescence staining of NK cells from normal mice (A), aGVHD-free mice (B) and aGVHD mice (C)
5 组织化学染色 小鼠aGVHD靶器官皮肤、肝、肠道标本HE染色观察到典型的急性移植物抗宿主病组织病理学改变。皮肤表皮基底层细胞有空泡性变,真皮浅层小血管周围有淋巴细胞浸润,小肠肠腺减少,腺上皮细胞部分坏死,肝有淋巴细胞浸润及点状嗜酸性坏死。见图4。
6 免疫荧光染色 aGVHD小鼠的皮肤、肠道NK细胞免疫荧光染色未发现NK细胞(图片未显示)。未发生aGVHD的移植鼠肝组织内NK细胞少量散在分部在肝实质细胞间,发生aGVHD移植鼠肝组织内汇管区周围有NK细胞浸润。见图5。
讨 论
NK细胞杀伤作用无MHC限制性、无需抗原刺激,在造血干细胞移植中的作用备受关注[5]。多数研究认为NK细胞在造血干细胞移植后发挥GVL效应的同时可减轻aGVHD。NK细胞通过其免疫球蛋白样受体(KIR)与HLA-Ⅰ类分子错配在移植后杀伤受者树突状细胞阻断了向供者T细胞提呈宿主抗原的过程减轻移植物抗宿主病,供者衍生的NK细胞通过裂解宿主T淋巴细胞来防止对移植物的排斥[6]。NK细胞也参与移植并发症的转归,通过分泌IFN-γ及直接的毒性作用对控制巨细胞病毒的感染发挥积极作用,消化道黏膜中存在特殊的NK细胞亚群,可促进消化道aGVHD损伤后的黏膜再生[7-9]。Small等[10]研究认为肺部的NK细胞可以发挥抗感染和促进上皮细胞再生,参与移植后肺部感染的抵抗和修复。
NK细胞用于小鼠半相合移植预处理,可以促进植入、预防aGVHD和改善移植后免疫重建[11-12]。陈广华等[13]人研究小鼠半相合骨髓移植时同时植入一定量激活的NK细胞,可在减轻aGVHD、减少白血病复发同时促进免疫重建。Ruggeri等[14]回顾研究报道临床半相合骨髓移植的病人接受供者NK细胞输注治疗可以明显降低复发率、促进植入,但并不增加移植物抗宿主病。
急性移植物抗宿主病对组织器官损伤的免疫病理学研究目前主要集中在宿主树突状细胞的成熟和激活进而启动了供者衍生性T细胞介导的反应[15]。靶器官特异性病理损伤相关研究较少,Fondi等[16]研究移植物抗宿主病皮损活检发现Foxp3+调节T淋巴细胞的增多与轻度GVHD及GVHD的相关治疗反应有关。Gannagé等[17]研究认为γ射线及TNF-α调高组织NKG2D配体的表达引起了aGVHD组织器官的损伤,并用免疫组化染色观察到了损伤器官处NKG2D高于正常组织的表达。Acevedo等[18]研究了aGVHD和cGVHD病人皮肤活检免疫组化染色,发现在aGVHD病人表皮和真皮交界处有大量NKp43+ NK细胞出现,但在cGVHD皮肤活检组织中NKp43+ NK细胞仅少量存在,并认为NK细胞参与了aGVHD的发生。我们发现在aGVHD肝汇管区有NK细胞浸润,从免疫病理学方向说明了NK细胞参与了肝处移植物抗宿主病的病理反应,但NK在其中所发挥的作用有待探讨。NKp46表达低的小鼠发生了aGVHD,而NKp46表达高的小鼠则避免了aGVHD的发生,NK细胞在骨髓移植中发挥减轻aGVHD的作用有利于骨髓移植,本实验结果证实在此过程中NK细胞的活性明显增强,为NKp46成为aGVHD诊断、治疗效果评价的指标提供可能。
1 Walzer T, Bléry M, Chaix J, et al. Identification, activation, and selective in vivo ablation of mouse NK cells via NKp46[J]. Proc Natl Acad Sci U S A, 2007, 104(9): 3384-3389.
2 蒋盼,汪华.自然杀伤细胞表面受体NKp46的研究进展[J].中华临床医师杂志:电子版,2011,5(22):6711-6714.
3 Storek J, Dawson MA, Storer B, et al. Immune reconstitution after allogeneic marrow transplantation compared with blood stem cell transplantation[J]. Blood, 2001, 97(11): 3380-3389.
4 段连宁,闫红敏,薛梅,等.单倍体相合造血干细胞移植后细胞免疫重建的动力学的临床研究[J].中华血液学杂志,2012,33(1):53-55.
5 Caligiuri MA. Human natural killer cells[J]. Blood, 2008, 112(3):461-469.
6 Locatelli F, Pende D, Mingari MC, et al. Cellular and molecular basis of haploidentical hematopoietic stem cell transplantation in the successful treatment of high-risk leukemias: role of alloreactive NK cells[J]. Front Immunol, 2013, 4: 15.
7 Loh J, Chu DT, O’guin AK, et al. Natural killer cells utilize both perforin and gamma interferon to regulate murine cytomegalovirus infection in the spleen and liver[J]. J Virol, 2005, 79(1): 661-667.
8 Arase H, Mocarski ES, Campbell AE, et al. Direct recognition of cytomegalovirus by activating and inhibitory NK cell receptors[J]. Science, 2002, 296(5571): 1323-1326.
9 Sanos SL, Diefenbach A. Isolation of NK cells and NK-like cells from the intestinal lamina propria[J]. Methods Mol Biol, 2010, 612:505-517.
10 Small CL, Shaler CR, Mccormick S, et al. Influenza infection leads to increased susceptibility to subsequent bacterial superinfection by impairing NK cell responses in the lung[J]. J Immunol, 2010, 184(4): 2048-2056.
11 Ruggeri L, Mancusi A, Burchielli E, et al. NK cell alloreactivity and allogeneic hematopoietic stem cell transplantation[J]. Blood Cells Mol Dis, 2007, 40(1): 84-90.
12 于津浦,曹水,辛宁,等.低剂量氟达拉滨、环磷酰胺联合供者NK细胞作为非清髓性预处理用于小鼠单倍相合造血干细胞移植[J].中国实验血液学杂志,2007,15(5):1013-1018.
13 陈广华,吴德沛,王易,等.输注供者自然杀伤细胞对小鼠单倍型相合造血干细胞移植的影响[J].中华器官移植杂志,2008,29(12):745-748.
14 Ruggeri L, Capanni M, Mancusi A, et al. Natural killer cells as a therapeutic tool in mismatched transplantation[J]. Best Pract Res Clin Haematol, 2004, 17(3): 427-438.
15 Ferrara JL, Cooke KR, Teshima T. The pathophysiology of acute graft-versus-host disease[J]. Int J Hematol, 2003, 78(3):181-187.
16 Fondi C, Nozzoli C, Benemei S, et al. Increase in FOXP3+ regulatory T cells in GVHD skin biopsies is associated with lower disease severity and treatment response[J]. Biol Blood Marrow Transplant,2009, 15(8): 938-947.
17 Gannagé M, Buzyn A, Bogiatzi SI, et al. Induction of NKG2D ligands by gamma radiation and tumor necrosis factor-alpha May participate in the tissue damage during acute graft-versus-host disease[J]. Transplantation, 2008, 85(6): 911-915.
18 Acevedo A, Aramburu J, López J, et al. Identification of natural killer (NK) cells in lesions of human cutaneous graft-versus-host disease: expression of a novel NK-associated surface antigen (Kp43)in mononuclear infiltrates[J]. J Invest Dermatol, 1991, 97(4):659-666.
Immunopathology of NK cells participating in aGVHD after nonmyeloablative haploidentical bone marrow stem cell transplantation
LEI Ying-ying1,2, DUAN Lian-ning1, LUO Yuan1, GUO Guang-jin1, XU Peng-fei1, LU Cheng-rong1, WANG Zhe1, XIANG Pei-de1
1Clinical Aviation Medical Laboratory, Chinese PLA AIR Force General Hospital, Beijing 100142,China;2Postgraduate Department of Hebei North College, Zhangjiakou 075000, Hebei Province, China
DUAN Lian-ning. Email:Duanlianning@hotmail.com
ObjectiveTo study the immunopathology of NK cells participating in aGVHD after nonmyeloablative haploidentical bone marrow stem cell transplantation.MethodsA mouse aGVHD model was established with C57BL/6 mice as its donor and CB6F1 mice as its receptor. Symptoms and signs of aGVHD were observed, chimerism and NKp46 expression were detected. Distribution of NK cells in aGVHD target organs was detected with immunofuorescence staining.ResultsThe incidence rate of aGVHD was 80%. The chimerism was achieved in 100% receptors 15 days after transplantation. The body weight of mice was reduced and the symptoms of aGVHD mice such as fur and hunched posture developed about 25 days after transplantation. The expression level of NKp46 was lower in aGVHD mice than in aGVHD-free mice. NK cells infltrated from donors into the portal area of receptors.ConclusionNK cells participate in the pathological response of liver graft versus host disease during nonmyeloablative haploidentical bone marrow stem cell transplantation. NKp46 expression is associated with aGVHD, thus providing evidence for the diagnosis of aGVHD.
nonmyeloablative haploidentical bone marrow transplantation; aGVHD; NK cell; NKp46
R 457.7
A
2095-5227(2014)07-0725-05
10.3969/j.issn.2095-5227.2014.07.022
时间:2014-03-19 08:28
http://www.cnki.net/kcms/detail/11.3275.R.20140319.0828.001.html
2014-01-14
国家自然科学基金项目(30873014)
Supported by the National Natural Science Foundation of China(30873014)
雷英英,女,在读硕士。研究方向:半相合骨髓移植。Email:leiyingying0904@126.com
段连宁,男,博士。Email:Duanlianning@hotmail.com

