43例胰腺浆液性肿瘤的临床分析
路 辉,史宪杰,万 涛,徐明月,吕少诚,李会星,张雯雯
解放军总医院 肝胆外科,北京 100853
43例胰腺浆液性肿瘤的临床分析
路 辉,史宪杰,万 涛,徐明月,吕少诚,李会星,张雯雯
解放军总医院 肝胆外科,北京 100853
目的总结胰腺浆液性肿瘤的诊断及治疗方法。方法回顾性分析2008年1月- 2012年10月本科收治的43例胰腺浆液性肿瘤病人的影像学和实验室检查、手术治疗方法、并发症及预后情况。结果本组病人行腹部B超、胰腺增强CT、外周血肿瘤标记物检查,部分病人行MRI、内镜逆行胰胆管造影(endoscopic retrograde cholangiopancereatography,ERCP)和超声内镜(endoscopic ultrasonography,EUS)检查。肿瘤位于胰头部14例(32.6%),胰腺体部21例(48.9%),胰腺尾部8例(27.6%);40例(93%)行手术治疗,3例(7%)经影像学检查确诊后定期复查。手术病人中行胰十二指肠切除术6例(15%),胰腺体尾部切除术18例(45%),胰腺中段切除术6例(15%),胰腺肿瘤局部切除术10例(25%)。手术时间60 ~ 400 min,术中出血20 ~ 400 ml,术后胰瘘8例(20%),围手术期1例(2.5%)因术后腹腔大出血死亡,伤口感染1例(2.5%),未出现腹腔感染及胃排空延迟并发症。术后病理诊断均为浆液性囊腺瘤。术后随访3 ~ 16个月,手术病人未出现复发及转移,行定期检查病人肿瘤较前无明显变化。结论胰腺浆液性囊性肿瘤是一种少见的胰腺良性病变。通过腹部B超、CT及MRI检查与黏液性肿瘤做好鉴别,根据病变的情况选择合理的治疗方法。
胰腺浆液性肿瘤;外科手术;并发症
胰腺浆液性肿瘤(pancreatic serous cystic neoplasms,PSCNs)是外科少见的胰腺囊性肿瘤,约占胰腺囊性肿瘤的25%,文献鲜有恶性报道[1]。随着影像技术的发展和对疾病认识的增加,浆液性肿瘤的检出率升高。由于其生物学行为有别于其他胰腺囊性肿瘤,术前做出正确的诊断有助于合理地选择治疗方式使病人受益。本文回顾性分析43例PSCNs诊治情况,以提高对本病的诊治水平。
资料和方法
1 资料 2008年1月- 2012年10月解放军总医院肝胆外科收治的PSCN患者43例,其中男性7例(16.3%),女性36例(83.7%)。发病年龄9 ~77(47.04±14.08)岁。患病至就诊时间为3 d ~ 9年。43例中32例(74.4%)无症状,体检时发现,均无阳性体征;11例(25.6%)因非特异性上腹部胀满或腹痛伴腰背不适就诊,其中1例伴黄疸,3例入院查体时有上腹部压痛。
2 研究方法 回顾性分析病人的影像学和实验室检查、手术治疗方法、并发症及预后情况。
结 果
1 影像学检查 入院常规行腹部B超、胰腺增强CT、外周血肿瘤标记物检查,部分病人行MRI、内镜逆行胰胆管造影(endoscopic retrograde cholangiopancereatography,ERCP)和超声内镜(endoscopic ultrasonography,EUS)检查。肿瘤位于胰头部14例(32.6%),胰腺体部21例(48.9%),胰腺尾部8例(27.6%);肿瘤最大为12 cm×10 cm×9 cm,最小为0.8 cm×0.5 cm×0.5 cm。CT检查时肿瘤可强化成网格状或蜂巢状,或仅有囊壁和其内分隔可轻度强化,囊肿处无强化,肿瘤与周围正常胰腺组织边界清晰,部分病例其内可见钙化(图1 ~ 图3),单囊型囊壁可轻度强化,但不易与黏液性囊肿鉴别。
2 实验室检查 本组血清淀粉酶、脂肪酶、血清肿瘤标记物CA 19-9、CA 12-5、CEA、AFP均正常。
3 治疗方法 43例中,40例(93%)行手术治疗,3例(7%)经影像学检查确诊后未行手术治疗,建议定期观察。根据肿瘤的位置、大小和主胰管的关系,选择具体的手术方式。体积较小、与主胰管位置稍远的肿瘤采用局部肿瘤切除术,胰头部较大肿瘤行胰十二指肠切除术,颈部或体部肿瘤行胰腺中段切除术或胰腺体尾部切除术,尾部肿瘤行胰腺尾部切除术(根据与脾血管的解剖关系,保留脾脏或联合脾脏切除)。本组手术病人中行胰腺肿瘤局部切除术10例(25%),胰十二指肠切除术6例(15%),胰腺中段切除术6例(15%),胰腺体尾部切除术18例(45%),其中机器人辅助胰腺中段切除术1例(2.5%),机器人辅助胰体尾部切除术2例(5%),腹腔镜体尾部切除术4例(10%)。
4 术中情况及并发症 手术时间60 ~ 400 min,术中出血20 ~ 400 ml,腔镜手术中胰腺残端采用ENDO-GIA直线切割闭合器离断,开腹手术时经切割闭合器离断后再行手工缝合加固。使用无损伤针缝合胰腺断面后喷洒生物胶外加网膜组织覆盖以减少针孔处的胰液渗漏。胰瘘是术后主要的并发症,术后发生胰瘘8例(20%),分别为胰十二指肠切除术后2例(共6例)、胰腺中段切除术后3例(共6例),胰体尾部切除术后3例(共18例),机器人辅助胰腺中段切除术1例,因术后腹腔大出血死亡,伤口感染1例,全组未出现腹腔感染及胃排空延迟并发症。我们分析病人的年龄、性别、肿瘤大小、手术方式及术中出血量对术后胰瘘发生率的影响,结果显示各因素下胰瘘的发生率差异无统计学意义(P>0.05)(表1)。术后病理诊断均为浆液性囊腺瘤(图4)。胰瘘病人经术部通畅引流和生长抑素保守治疗后均得到治愈,治疗时间14 ~ 51 d。

图 4 囊壁可见立方形上皮细胞Fig. 4 Cuboidal epithelial cells in cystic wall

图 1 平扫期肿瘤位于胰腺颈部,其内可见钙化图 2 动脉强化期肿瘤内分隔可见强化图 3 静脉强化期肿瘤与周围正常胰腺组织边界清晰Fig. 1 Plain scanning showing the tumor located in pancreatic neck with calcif i cationFig. 2 Enhanced septum in arterial enhancement tumorFig. 3 Clear boundary between venous enhancement tumor and its surrounding normal pancreatic tissue
5 随访 通过电话随访,手术病人术后随访3 ~16个月,均存活,未发现复发及转移情况。未行手术病人每6个月复查1次CT,结果示肿瘤大小较入院检查时无明显变化。
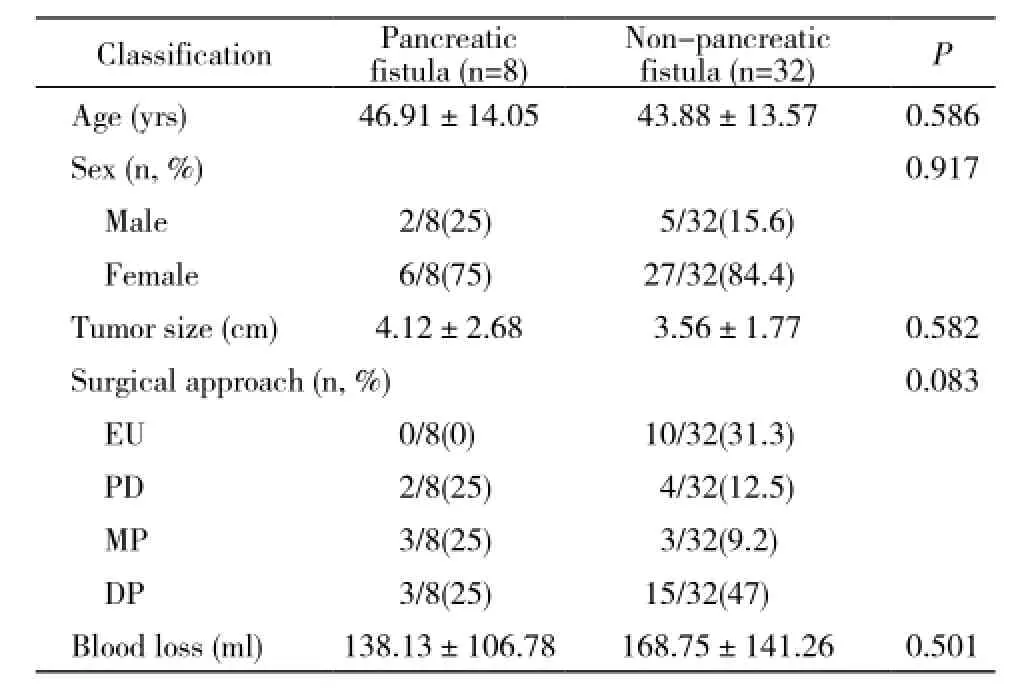
表1 病人资料与胰瘘发生情况分析Tab. 1 Parameters of patients and incidence of pancreatic fi stula
讨 论
1978年Compagno和Oertel[2]根据病理学特征提出了PSCNs的概念,PSCNs由典型的立方形的、富含糖原的上皮细胞组成,这些细胞分泌浆液样液体。目前被认为是一种良性的胰腺囊性肿瘤,文献中只有极少数关于胰腺浆液性囊腺癌的报道[3-4]。PSCNs好发于中年女性,在胰头部较为常见[5]。本组病例中女性病人明显多于男性,与文献报道相符;本组病变位于胰腺体部21例(48.9%),发病率略高于胰头部14例(32.6%),可能与病例数较少有关。PSCNs在形态上分为微囊型、巨囊型或少囊型、微囊巨囊混合型、VHL相关型和实体型5种。大多数PSCNs是呈蜂窝状的微囊型[3]。PSCNs是一种少见的胰腺外分泌肿瘤,占胰腺外分泌肿瘤的1% ~ 2%,占胰腺囊性肿瘤的25%[5]。本病的症状多不典型,多数的病人没有明显的体征,往往在体检时或偶然间发现;少数病人的症状表现为上腹部不适伴或不伴有轻度的疼痛、体质量减轻、明显的上腹部包块、黄疸或当肿物过大时压迫上消化道而导致的梗阻症状。
PSCNs的诊断主要通过腹部B超、CT、MRI及超声内镜等检查方法。通常情况下腹部B超是首选的检查方式,腹部B超有较为特征性的声像图,微囊型声像图表现为:多为边界较清的囊实性病灶,呈蜂窝状或类实质样回声,彩超在囊壁或分隔处可测及点线状彩色血流及动脉血流曲线。彩超在囊壁处可测及少许彩色血流及动脉血流曲线[6]。CT增强扫描肿瘤可强化而呈网格状或蜂窝状肿物,其动脉期、门静脉期的强化程度与正常胰腺组织相仿,而肿瘤壁和内部的囊性结构无强化。部分病例中央可见星状(放射状)瘢痕及其钙化,被认为是特征性表现[7]。文献报道呈分叶状的轮廓与囊壁轻度增强情况有别于黏液性囊性肿瘤[8-11]。Khashab等[12]对257例经过手术治疗的PSCNs研究表明,CT对PSCNs正确的诊断只占到了25%。本组中微囊型和多囊型强化CT检查时囊壁及分隔可见强化,其内囊肿无强化,基本符合诊断标准,出现囊肿中央钙化病例(特征性表现),单囊型与一般囊肿无明显差别,容易误诊。单囊型的术前确诊率低,大多术中冷冻或术后病理证实为PSCNs。单囊型术前诊断影响了PSCNs总体术前诊断的提高。MRI成像病灶轮廓光滑规则,与正常胰腺组织分界清楚,T2WI尤为典型[13]。MRCP可以补充了解肿瘤与主胰管的关系,有助于与胰腺导管内乳头状瘤(IPMNs)的鉴别。文献报道PSCNs病人的肿瘤标记物(CA19-9、CA12-5、CEA、AFP)各项指标多在正常范围,与黏液性肿瘤的鉴别有重要意义,本组病人以上实验室指标均符合文献报道[14]。
PSCNs的治疗方法是手术切除病灶。如同其他胰腺手术,胰瘘是手术后的主要并发症。胰瘘相关的危险因素包括非技术因素和技术因素。非技术因素包括:年龄>65岁、术前黄疸、胰管细小、胰腺柔软、手术方式、术中出血量增加以及放置的内支撑管过早脱落。从手术技术上讲,胰瘘是一种可以预防的并发症。国内外学者使用胰腺空肠套入吻合和胰胃吻合的重建方式来比较胰瘘的发生率,结果显示没有明显差异[15]。本组病人的一般资料与术后胰瘘发生情况没有统计学意义,我们认为仔细处理胰腺的断面是预防胰瘘的关键。发生胰瘘后只要保持通畅的引流,多数可以治愈[16]。本组手术后发生胰瘘8例,各手术术式下胰瘘的发生率差异无统计学意义,发生胰瘘比例以胰腺中段切除术最高,可能因为存在两个胰腺断端提高了胰瘘的发生率。开腹病例使用切割闭合器离断胰腺近端再行手工缝合加固,外加生物胶和网膜组织覆盖断端及吻合口的方法对胰瘘起到了预防的作用。本组胰瘘病人经术部引流和积极保守治疗后均治愈出院。本组中1例死亡病例发生在机器人辅助胰腺中段切除术后,术后发生腹腔内大出血,二次手术探查发现脾静脉出血,术中行远端胰腺和脾切除,但因病人凝血功能障碍,抢救无效死亡。国外学者相关研究认为手术治疗通常适用于那些有症状的、巨大的PSCNs病人,或者肿瘤不能和IPMN相鉴别的病人。也有学者坚持一旦诊断成立就应手术治疗。文献中报道PSCNs的位置和大小提示肿瘤是否存在侵袭性。Hwang等[17]认为手术的时机应该控制在未出现临床症状或肿瘤<5 cm时,采用创伤小的手术方式处理。在Tseng等[18]的研究分析106例PSCNs的病人,可随访的24例病人通过连续影像学检查及分析,平均增长率为0.6 cm/年,当肿瘤直径>4 cm时病人出现明显的腹部症状,平均增长率为1.98 cm/年。Malleo等[19]所在研究机构对145例PSCNs病人的MRI检查结果分析表明:整体平均增长率只有0.28 cm/年,这种增长分为两个阶段,前6年0.1 cm/年,之后0.6 cm/年。可以建议那些没有症状、肿瘤情况描述良好病人进行定期影像学检查,一般两年比较适合。El-Hayek等[20]研究表明从确诊PSCNs到手术治疗的时间不应超过12年。本组中2例非手术病人经定期复查CT,结果显示病变较入院时无明显变化。本研究的局限性在于病人数量较少,获得的病历资料有限。
综上所述,PSCNs是一种少见的胰腺良性病变,罕见复发和转移。通过腹部B超、CT及MRI检查与其他囊性肿瘤做好鉴别。肿瘤体积较小、没有症状、影像学检查可以明确诊断的病人,可以定期检查,监测肿瘤变化情况,如有短期内明显增大并出现症状的病人应选择手术治疗。
1 Sahani DV, Kambadakone A, Macari M, et al. Diagnosis and management of cystic pancreatic lesions[J]. AJR Am J Roentgenol,2013, 200(2):343-354.
2 Compagno J, Oertel JE. Microcystic adenomas of the pancreas(glycogen-rich cystadenomas): a clinicopathologic study of 34 cases[J]. Am J Clin Pathol, 1978, 69(3): 289-298.
3 Pederzoli P, Bassi C. Uncommon Pancreatic Neoplasms[M]. New York: Springer, 2013: 5-12.
4 Atef E, El Nakeeb A, El Hanafy E, et al. Pancreatic cystic neoplasms: predictors of malignant behavior and management[J]. Saudi J Gastroenterol, 2013, 19(1): 45-53.
5 Bassi C, Salvia R, Molinari E, et al. Management of 100 consecutive cases of pancreatic serous cystadenoma: wait for symptoms and see at imaging or vice versa?[J]. World J Surg, 2003, 27(3): 319-323.
6 张晖,王文平,徐智章,等.胰腺浆液性囊腺瘤的超声诊断价值[J].上海医学影像,2008,17(4):283-285.
7 Kim YH, Saini S, Sahani D, et al. Imaging diagnosis of cystic pancreatic lesions: pseudocyst versus nonpseudocyst[J]. Radiographics, 2005, 25(3): 671-685.
8 Galanis C, Zamani A, Cameron JL, et al. Resected serous cystic neoplasms of the pancreas: a review of 158 patients with recommendations for treatment [J]. J Gastrointest Surg, 2007, 11(7): 820-826.
9 Cohen-Scali F, Vilgrain V, Brancatelli G, et al. Discrimination of unilocular macrocystic serous cystadenoma from pancreatic pseudocyst and mucinous cystadenoma with CT: initial observations[J]. Radiology, 2003, 228(3): 727-733.
10 刘阳,程涛.多层螺旋CT在胰腺浆液性腺瘤与黏液性囊性肿瘤中的诊断价值[J].临床放射学杂志,2013,32(4):514-518.
11 罗华,梁亮,曾蒙苏.胰腺巨囊型浆液性囊腺瘤的MSCT表现及其诊断[J].放射学实践,2011,26(7):739-741.
12 Khashab MA, Shin EJ, Amateau S, et al. Tumor size and location correlate with behavior of pancreatic serous cystic neoplasms[J]. Am J Gastroenterol, 2011, 106(8): 1521-1526.
13 刘建滨,范立新,易正湘,等.3.0T MRI对胰腺囊性肿瘤的诊断价值[J].放射学实践,2011,26(5):508-513.
14 Zamboni G, Hirabayashi K, Castelli P, et al. Precancerous lesions of the pancreas[J]. Best Pract Res Clin Gastroenterol, 2013, 27(2):299-322.
15 詹世林,陈建雄,彭林辉,等.中段胰腺切除治疗胰腺良性病变[J].中国普通外科杂志,2010,19(9):977-979.
16 Iacono C, Bortolasi L, Serio G. Indications and technique of central pancreatectomy-early and late results[J]. Arch Surg, 2005, 390(3):266-271.
17 Hwang HK, Kim H, Kang CM, et al. Serous cyst adenoma of the pancreas: appraisal of active surgical strategy before it causes problems[J]. Surg Endosc, 2012, 26(6): 1560-1565.
18 Tseng JF, Warshaw AL, Sahani DV, et al. Serous cystadenoma of the pancreas: tumor growth rates and recommendations for treatment[J]. Ann Surg, 2005, 242(3): 413-419.
19 Malleo G, Bassi C, Rossini R, et al. Growth pattern of serous cystic neoplasms of the pancreas: observational study with long-term magnetic resonance surveillance and recommendations for treatment[J]. Gut, 2012, 61(5): 746-751.
20 El-Hayek KM, Brown N, O’rourke C, et al. Rate of growth of pancreatic serous cystadenoma as an indication for resection[J]. Surgery, 2013, 154(4): 794-800.
Pancreatic serous cystic tumor: A clinical analysis of 43 cases
LU Hui, SHI Xian-jie, WAN Tao, XU Ming-yue, LYU Shao-cheng, LI Hui-xing, ZHANG Wen-wen
Department of Hepatobiliary Surgery, Chinese PLA General Hospital, Beijing 100853, China
Corresponding author: SHI Xian-jie. Email: shixianjie301@126.com
ObjectiveTo summarize the diagnosis and treatment of pancreatic serous tumor.MethodsImaging and laboratory test data, surgical procedures, complications and prognosis of 43 patients with pancreatic serous tumor admitted to our hospital from January 2008 to October 2012 were retrospectively analyzed.ResultsOf the 43 patients, some underwent abdominal B ultrasound, pancreatic enhancement CT and peripheral blood tumor marker examination, some underwent MRI, ERCP and EUS. The tumor was located in pancreatic head, body and tail in 14 patients (32.6%), 21 patients (48.9%) and 8 patients (27.6%), respectively. Of the 43 patients, 40 (93%) underwent surgical operation and 3 (7%) diagnosed by image examination received regular reexamination, 6 (15%) underwent pancreaticoduodenectomy, 18 (45%) underwent pancreatic body and tail resection, 6 (15%) underwent pancreatic middle resection. 10 (25%) underwent local resection. The operation time was 60-400 min with an intra-operative blood loss of 20-400 ml. Pancreatic fi stula was found in 8 patients (20%) after operation, 1 patient (2.5%) died in perioperative period due to massive bleeding in abdominal cavity, wound infection occurred in 1 patient(2.5%). No complications occurred such as abdominal infection and delayed gastric emptying. The patients were followed up for 3-16 months, during which no recurrence and metastasis were observed.ConclusionPancreatic serous cystic tumor is a rare and benign lesion. Abdominal B ultrasound, CT and MRI can differentiate it from mucinous tumors. Rational treatment modalities should be selected according to the lesion situation.
pancreatic serous neoplasm; surgical procedures, operative; complications
R 735.9
A
2095-5227(2014)06-0529-04
10.3969/j.issn.2095-5227.2014.06.003
2014-03-07 15:07
http://www.cnki.net/kcms/detail/11.3275.R.20140307.1507.009.html
2013-11-08
全军医学科学技术研究“十二五”重大专项研究课题(CWS11J096)
Supported by the 12th Five Years major special Projects of Chinese PLA Medical Technologies(CWS11J096)
路辉,男,在读硕士。研究方向:肝胆胰疾病的治疗。Email: luhui1980@gmail.com
史宪杰,男,博士,主任医师,博士生导师。Email: shi xianjie301@126.com

