小鼠精原干细胞的分离纯化及初步鉴定
王永彬,刘凤美,张军令,李艳华,靳淑敏,丁静静
(开封市畜产品质量监测检验中心,河南 开封475000)
对精原干细胞(spermatogonial stem cell,SSCs) 的生理生化特性及其分裂增殖、分化、运动、衰老、死亡等各项生命活动的调节机制的深入研究,精子发生机理的进一步阐明以及精原干细胞异体、异种移植技术的实际应用,都迫切需要找到一种可行的方法将其分离纯化,以期得到较高产量和纯度的有活力的精原干细胞,用于体外培养。
在小鼠睾丸中,大约1 万个睾丸生殖细胞中才有2 ~3 个精原干细胞[1],它的数量稀少妨碍了对其进一步的深入研究。因此,获取大量高纯度的精原干细胞对研究其生物学特征并进行有效操作是非常必要的。随着出生后时间的增长,精原干细胞逐步分化形成各级生精细胞,其数量及所占比例都会越来越少,这样使得SSCs 的分离纯化极为困难,故选择动物的出生天数应较小。一般小鼠选用出生后7 ~8 d,大鼠选用出生后9 ~10 d 的为宜。
本研究旨在探索获得足够数量和纯度的小鼠精原细胞的方法,为精原干细胞的体外培养和移植提供研究材料。
1 材料与方法
1.1 试验动物
出生6 ~8 d 的昆明白小鼠。
1.2 主要试剂
胶原酶(C-5138,美国Sigma 公司) 、胰蛋白酶(T0303- 1G,Sigma- Aldrich 公司) 、台盼蓝(Trypan Blue,T6146-5G,美国Sigma 公司) 、Percoll(P- 1644,美国Sigma 公司) 、DMEM(12800058,美国Gibco公司) 、无Ca2+、Mg2+的PBS,其余药品为国产分析纯。
1.3 主要仪器
超净工作台(NUAIRE) 、低速离心机(HETTICH MIKRO-22) 、二氧化碳培养箱(THERMO) 、一次性无菌培养皿、实体显微镜、恒温水浴锅、手术剪刀、镊子、细胞筛、血球计数板。
1.4 取样
将5 只6 ~8日龄昆明白小鼠颈椎脱臼处死,然后用碘酒和酒精消毒腹部,沿腹正中线切口,在两侧腹股沟处找到并无菌取出睾丸,置于盛有无Ca2+、Mg2+PBS 的塑料平皿中备用。
1.5 Percoll 梯度溶液的制备
先用1.5 mol/L 的NaCl 将Percoll 液稀释为90% 的Percoll 母液,然后用PBS 作为Percoll 稀释液将母液稀释到表1 各密度梯度。
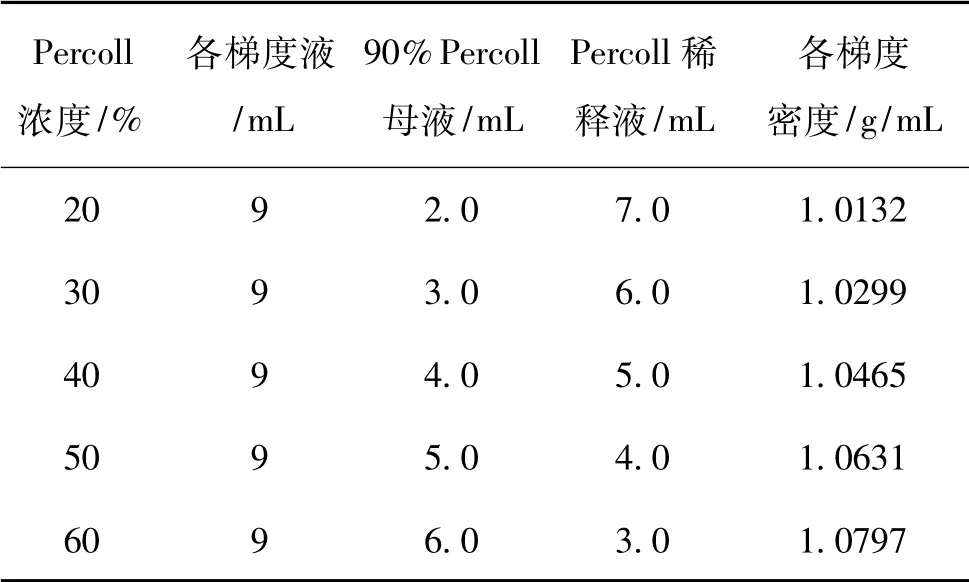
表1 Percoll 密度梯度的浓度、组成及密度
1.6 细胞悬液的制备
在实体镜下去除睾丸周围脂肪组织、附睾及白膜,收集松散的曲细精管,移入盛有适量无Ca2+、Mg2+PBS 的5 mL 离心管中,待曲细精管完全沉淀后弃上清。加入相当于组织10 倍体积的含1 mg/mL Ⅳ型胶原酶的DMEM 后放入培养箱,37 ℃消化15 min,每5 min 轻摇1 次。弃上清后再用PBS 清洗两次,然后再向离心管中加入含1.5 mg/mLⅠ型透明质酸酶和含0.25 mg/mL 胰蛋白酶的DMEM,放入培养箱消化10 min。200 目细胞筛(74 μm) 过滤两次,600 ×g 离心5 min,弃上清,加入2 mL 的DMEM 混匀,制成单细胞悬液。用移液器取出1 滴制备好的细胞悬液,加入1 滴0.4%台盼蓝混匀,在3 min内倒置相差显微镜下用血球计数板分别计算活细胞、死细胞、细胞团的数目和细胞总数,镜下观察时死细胞被染成淡蓝色,而活细胞拒染。
1.7 Percoll 梯度的制备及离心分离
用带长针头的注射器从已制备好的每级Percoll 密度梯度液中各取1 mL,按密度从大到小依次分层叠加到15 mL 离心管中。用吸管吸取2 mL 待分离的细胞悬液,大约含8 ×106个细胞,小心加在15 mL 离心管中梯度液顶层的分离介质上面。将离心管放置4 h或以1 400 r/min(800 g) 离心30 min 使细胞分层。
1.8 细胞收获及计数
用带长针头的注射器将各梯度中形成的细胞带小心吸取出,移至事先标记好的5 mL离心管中,各加入2 mL PBS 稀释,以1 000 r/min离心5 min,弃上清,重新加入2 mL的DMEM 培养液,并轻轻吹打均匀。取出1 滴制备好的细胞悬液,加入1 滴0.4%台盼蓝混匀,在3 min 内倒置相差显微镜下用血球计数板分别计算活细胞、死细胞、细胞团的数目和细胞总数,镜下观察死细胞被染成淡蓝色,而活细胞拒染。细胞收获量为每个睾丸获得的细胞总数,用每次实验获得的细胞总数除以该次实验所用睾丸个数即可。
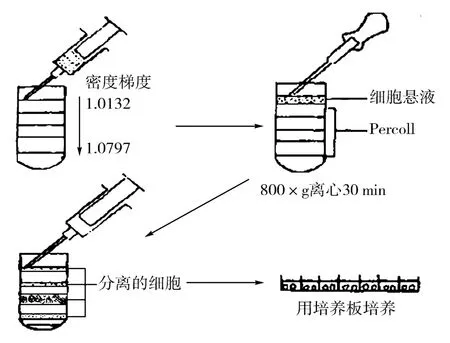
图1 Percoll 密度梯度法纯化精原干细胞流程图
1.9 差异贴壁和碱性磷酸酶染色
经Percoll 梯度离心分离的精原细胞中混有支持细胞,将此细胞悬液接种在含10%FBS 的DMEM 无菌培养皿中,置CO2培养箱中37 ℃、5%CO2、95%空气、饱和湿度条件下,培养约12 h,待细胞贴壁后进行碱性磷酸酶(AKP) 染色,倒置显微镜下观察、计数。
2 实验结果
2.1 小鼠睾丸细胞消化效果
本实验对6 ~8日龄乳鼠睾丸共进行了4次分离,分离后获得了小鼠睾丸组织单细胞悬液。4 次实验所获悬液量均为2.0 mL。平均每个睾丸可获得4.53 ×105个细胞,其中死细胞、活细胞、细胞团平均所占百分比依次为2.97%、97.03%、2.95%(表2) 。
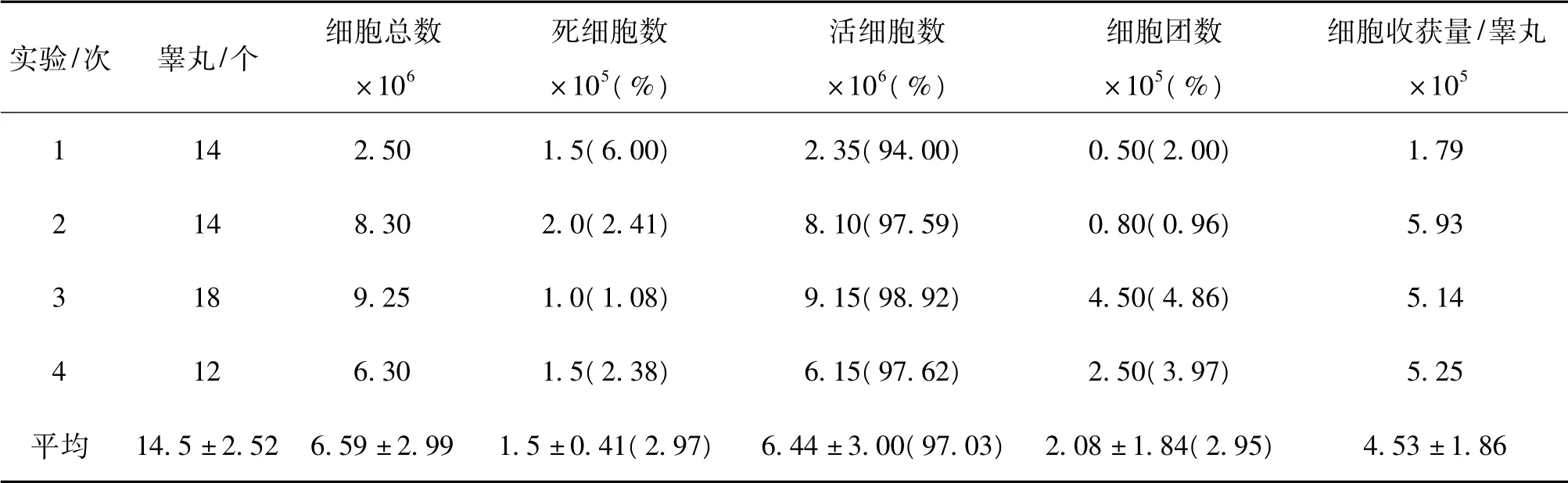
表2 两步酶消化的效果
2.2 Percoll 密度梯度初步纯化结果
经Percoll 密度梯度离心,细胞主要在相邻梯度的界面处形成细胞带。分布在20% ~30% Percoll 梯度间的主要是细胞间质、细胞碎片及少量死细胞,记为1 带; 分布在30%~40%Percoll 梯度间的细胞较少,平均密度为3.64×105个/mL,记为2 带; 分布在40%~50%Percoll 梯度间的细胞最多,平均密度达3.20×106个/mL,记为3 带; 分布在50%~60%Percoll 梯度间的细胞也较少,平均密度为3.86×105个/mL,记为4 带(表3) 。
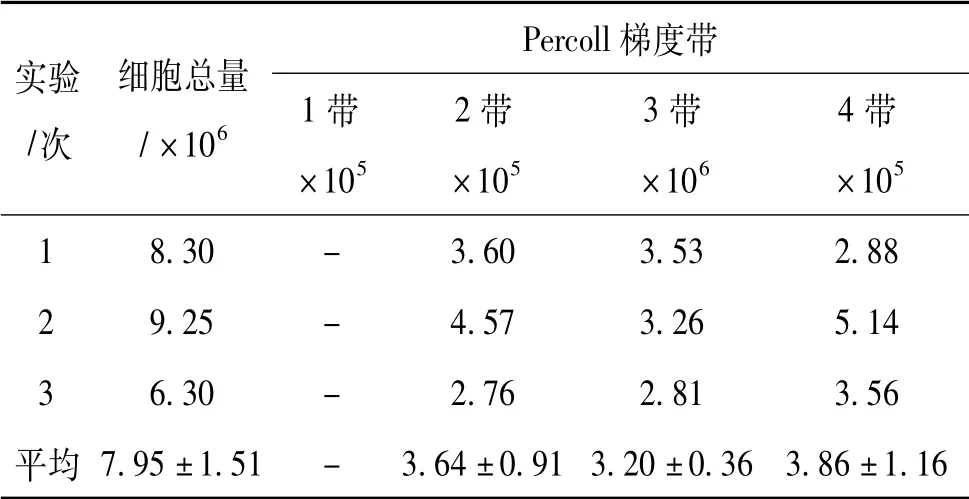
表3 细胞在Percoll 密度梯度中的分布
2.3 精原干细胞的初步鉴定
3 带中的细胞培养12 h 进行AKP 染色,精原干细胞呈阳性或强阳性,被染成深褐色,支持细胞和精原细胞呈阴性,不着色。通过染色后获得的照片对阳性细胞数进行统计计数,精原干细胞的纯度平均为6.47%。
3 讨论
本实验选取6 ~8日龄乳鼠睾丸,两步酶消化法分离获得了含有SSCs 的细胞悬液。这一时期分离到的细胞悬液除了含有精原细胞和支持细胞外,其它杂细胞较少。平均每个睾丸可获4.53 ×105个细胞,和张学明等[2]的研究结果相似。
目前,研究者们已经采取多种方法并结合隐睾模型、维生素A 缺乏动物模型、基因突变小鼠等来分离和纯化精原干细胞,将精原干细胞的纯度大大提高了。如单位重力沉降法、牛血清白蛋白梯度和单位重力速度沉降法等。利用免疫荧光激活细胞分选术能分离出大量有活性的精原干细胞[3]; 根据细胞表面标记结合隐睾模型,应用流式细胞仪进行免疫荧光激活的多参数筛选,并将筛选的精原细胞移植到受体小鼠的睾丸,以移植细胞的克隆数作为评估指标,证实可以将精原干细胞纯化152 ~166 倍[4]; 运用磁性细胞分类技术能快速有效地分离出仓鼠、小鼠以及猴的精原细胞[5]; 通过Percoll 不连续密度梯度法能分离出纯度达65% ~87%的A 型精原细胞[6]。
Percoll 是一种经聚乙烯吡咯烷酮(PVP)处理的硅胶颗粒,渗透压低,对细胞无毒,惰性,与生物膜不发生粘附。用它制成的梯度在室温下放置数星期而梯度的形状不发生变化。Percoll 密度梯度离心已被许多学者用来分离各种动物的精子,用来分离精原干细胞也有很多报道。本实验结果表明,小鼠精原细胞主要分布在40% ~50%Percoll 梯度间,和已有的报道结果相似。
本试验对3 带中的细胞进行碱性磷酸酶(AKP) 染色,有被染成深褐色的阳性细胞,这些细胞具有干细胞特性,是精原干细胞,占3 带中细胞总量的6.47%。该带细胞接种后,根据精原细胞与支持细胞贴壁速度快慢的不同,利用差异贴壁法,可将其进一步纯化。
本实验根据细胞分离理论,结合实践经验,对昆明白小鼠睾丸生殖细胞进行了体外分离和初步培养鉴定。结果表明,该实验方法能够分离出较高生物学活性的精原细胞,并可以为精原干细胞移植和深入研究精子发生机理提供研究材料和技术支持。
[1]Luo Jinping,Megee,Rathi,et al.Protein gene product 9.5 is a spermatogonia- specific marker in the pig testis: application to enrichment and culture of porcine spermatogonia [J].Mole Repro And Devel,2006,73: 1531-1540.
[2]Tegelenbosch RA,de Rooij DG.A quantitative study of spermatogonial multiplication and stem cell renewal in the C3H/101 F1 hybrid mouse.Mutat Res,1993,290(2) : 193-200.
[3]Shinohara T,Orwig KE,Avarbock MR,et al.Spermatogonial stem cell enrichment by multiparameter selection of mouse testis cells.Proc.Natl.Acad.Sci.,2000,97(15) : 8346-8351.
[4]Von Schonfeldt V,Krishnamurthy H,Foppiani L,et al.Magnetic Cell Sorting Is a Fast and Effective Method of Enriching Viable Spermatogonia from Djungarian Hamster,Mouse,and Marmoset Monkey Testes.Biol Reprod,1999,61: 582-.589.
[5]Izadyar F,Spierenberg GT,Creemers LB,et al.Isolation and purification of type A spermatogonia from the bovine testis.Reproduction,2002b,124(1) : 85-94.
[6]Shuttlesworth GA,de Rooij DG,Huhtaniemi I,et al.Enhancement of A spermatogonial proliferation and differentiation in irradiated rats by gonadotropin-releasing hormone antagonist administration.Endocrinology,2000,141(1) : 37-49.
[7]Shinohara T,Avarbock MR,Brinster,RL.β1- and α6-integrin are surface markers on mouse spermatogonial stem cells.Proc.Natl.Acad.Sci.,1999,96:5504-5509.
[8]Schrans-Stassen BH,van de Kant HJ,de Rooij DG,et al.Differential expression of c- kit in mouse undifferentiated and differentiating type A spermatogonia.Endocrinology,1999,140: 5894 ~5900
[9]毕聪明,张仕强,彭树英,等.牛精原干细胞的分离和纯化及体外培养的一般特性[J].畜牧兽医学报,2006,37(10) : 977-981.
[10]刘春霞,张 茨,王玲珑,等.小鼠精原干细胞分选[J].中华男科学杂志,2007,13(1) : 24-26.
[11]张学明,赖良学,李德雪,等.小鼠精原细胞的分离和纯化[J].解剖学报,2000,31(3) : 235-238.

