凡纳滨对虾(Litopenaeus vannamei)造血激素的组织分布及细胞定位分析*
徐萌霖 梁 艳 卢金凤 王晓雯李 晨 邢 婧 黄 倢
凡纳滨对虾()造血激素的组织分布及细胞定位分析*
徐萌霖1, 2梁 艳2卢金凤2王晓雯1, 2李 晨2邢 婧1黄 倢2①
(1. 中国海洋大学海水养殖教育部重点实验室 青岛 266003; 2. 农业部海洋渔业资源可持续利用重点开放实验室 中国水产科学院研究院黄海水产研究所 青岛 266071)
造血激素(astakine)是一种具有促进造血组织细胞分化和增殖作用的甲壳动物细胞因子, 参与甲壳动物的造血活动, 对于只依赖于非特异性免疫的甲壳动物抗感染能力有重要的意义。本实验室前期成功克隆凡纳滨对虾造血激素(LvAST)的基因Lvast。为了进一步了解其功能, 本文通过实时荧光定量PCR技术检测了Lvast表达的组织分布, 同时还用Dlight标记抗LvAST抗体进行了LvAST在对虾细胞和组织中的免疫荧光定位分析。荧光定量PCR测定结果说明, Lvast主要在肝胰腺、鳃和肌肉中大量表达, 而淋巴器官和血淋巴细胞中表达量较低; 免疫荧光结果显示, LvAST可同时存在于血淋巴细胞内和血淋巴细胞膜表面, 不同的血淋巴细胞表面的LvAST分布呈现出明显差异, 可能具有重要的血细胞分类意义。LvAST蛋白在肝胰腺、鳃、肌肉、淋巴器官等组织中均有分布, 并且肝胰腺组织中分布较多, 淋巴器官组织中分布较少。
凡纳滨对虾; 造血激素; 荧光定量PCR; 激光共聚焦显微镜; 荧光定位
虾类等无脊椎动物没有抗体和特异性免疫功能, 缺少脊椎动物获得性免疫系统的适应性和记忆能力, 它们的免疫防御功能主要依赖于先天的非特异免疫机制(Lorenzon, 1999; Philippe, 1999)。虽然如此, 甲壳动物的先天免疫系统仍然是高度发展的, 其发挥免疫功能的细胞和体液依赖血液的循环作用散布于身体的多种组织, 其对外源侵染的反应非常高效而复杂(Smith, 1991)。当甲壳动物的机体受到体内外刺激后, 游离的血细胞数量会急剧下降(Lorenzon, 1999), 而新的血细胞的补充对于维持甲壳类动物生理机能的稳定十分关键(Johansson, 2000)。近年研究发现了一种类细胞因子的造血激素(Astakine, AST), 这是一种具有促进造血组织细胞分化和增殖的甲壳动物细胞因子(Lin, 2009, 2011; 梁高峰等, 2012), 这种造血激素极有可能在虾的免疫防御反应中起到重要作用。
AST最早由Lin等在软尾太平蝲蛄()中发现, 随后斑节对虾()造血激素和凡纳滨对虾()造血激素(LvAST)的cDNA序列也相继被克隆出来(Hsiao, 2010; 梁高峰等, 2012)。LvAST的序列中包含一个脊椎动物前动力蛋白(Prokineticin, PK)功能域, PK是一类存在于脊椎动物中的分泌蛋白(Hsiao, 2010), 其在多种组织中均有分布。该蛋白在脊椎动物中具有促血管内皮细胞增生的作用, 在血管生成、创伤感应、昼夜节律控制等行为的调制等方面具有重要作用(Melchiorri, 2001; Ng, 2005; Matsumoto, 2006)。但是LvAST的N-端没有PK蛋白中保守的AVITGA, 因此LvAST的功能可能与PK蛋白的功能有所差别(梁高峰, 2011)。Söderhäll等(2005)和Watthanasurorot等(2011)证实AST参与到造血作用中并且对于调节无脊椎动物的昼夜节律有重要作用。另外本实验室前期研究中表明, AST对于白斑综合征病毒(white spot syndrome virus, WSSV)有一定程度的抑制作用(梁高峰, 2011)1)。而Lin等(2009)通过多种实验方法证明F1F0-ATP合酶β亚基是造血激素的一个受体。本实验前期研究中也发现F1F0-ATP合酶β亚基具有和LvAST相同的组织和细胞分布。
目前对于AST的研究仍然很少, 本研究通过实时定量PCR和免疫荧光技术对凡纳滨对虾AST蛋白在细胞和组织上进行定位, 为进一步了解AST的生物学功能和丰富凡纳滨对虾基础研究资料提供数据。
1 材料与方法
1.1 对虾
凡纳滨对虾()活体于2011年4月购自青岛南山市场, 体长8—10cm, 经PCR检测无WSSV, 在实验室暂养3d。
1.2 抗体及其荧光素标记
将本实验室重组表达的LvAST(梁高峰, 2011)委托GenSript公司(美国)制备成兔抗LvAST多克隆抗体, 经过抗原抗体吸附法进行纯化后经间接ELISA法测定其滴度为1∶3000。分别将100µL兔抗LvAST多抗和100µL 2.5g/mL BSA(Sigma公司)加入到50μg Dlight 649-NHS荧光素粉末(Themor, 美国)中; 同时, 分别将100µL兔阴性血清和100µL兔抗β-actin单克隆抗体(1∶500, Proteintech公司, 美国)加入到50μg Dlight 488-NHS荧光素(Themor, 美国), 各在室温下连接1h后, 于4°C在PBS (8g/L NaCl 8g, 2.9g/L Na2HPO4·12H2O, 0.2g/L KCl, 0.2g/L KH2PO4, pH 7.4)中透析过夜, 除去未标记上的荧光素。
1.3 RNA提取及cDNA第一链的合成
从3尾凡纳滨对虾腹节血窦取血淋巴并混合, 同时分别取对虾的鳃、肌肉、肝胰腺、淋巴器官组织, 加入1mL TRIzol试剂(Invitrogen, 美国), 按照试剂所附操作方法提取总RNA。对所得到的RNA分别用无RNase的DNase I (上海生工生物工程有限公司)消化, 以Oligo(dT)为反转录引物, 使用Trans Script First-Strand cDNA Synthesis Super Mix试剂盒(Transgen公司, 德国), 将RNA反转录成cDNA。
1.4 实时荧光定量PCR
以合成的cDNA为模板, 根据序列(GenBank: HM594944), 用Primer Premier 5.0设计特异性引物Lvast-F和Lvast-R(表1), 以β-actin作为内参基因, 使用Titan One Tube RT-PCR Kit试剂盒(Roche公司, 德国), 在Rotor Gene 3000荧光定量PCR仪(Corbett Research公司, 澳大利亚)上进行实时定量PCR测定。操作方法参照说明书, 25µL反应体系中含模板cDNA 1.0µL, 10µmol/L引物0.5µL, 2× qPCR Super Mix 12.5µL, DyII 0.5µL。反应条件为95°C预变性10 s; 45个循环的95°C变性15 s, 57°C退火10 s, 72°C延伸15 s; 72°C延伸10 min。使用Rotor-Gene6软件进行结果分析。
表1 实验中用到的引物及其序列
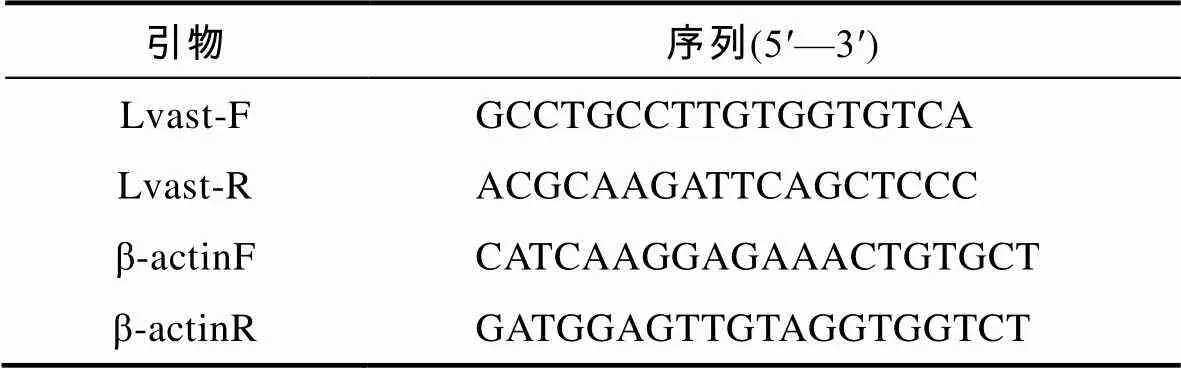
Tab.1 Primers used in the experiments
1.5 对虾血淋巴细胞原代培养
取3尾凡纳滨对虾, 用75%酒精消毒体表, 用无菌注射器从对虾腹节血窦抽取血淋巴(注射器内预先抽取等体积抗凝剂: 450mmol/L NaCl, 10mmol/L KCl, 10mmol/L EDTA, 10mmol/L HEPES, pH 7.45), 于100×离心10min, 收集细胞沉淀, 用2×L15培养基(含19%胎牛血清, 100U/mL青霉素和100μg/mL链霉素)重悬, 混匀后加入24孔细胞培养板中, 28°C培养2h。
1.6 石蜡组织切片的制备
向活凡纳滨对虾的肝胰腺部位分多点注射1mL Davidson’s AFA固定液(Lightner, 1988), 取出肝胰腺、鳃、肌肉、淋巴器官组织, 分别放入10倍体积的固定液中固定8h, 按对虾组织学手册的方法制备石蜡切片, 每张载玻片放置4块切片, 展片后进行后续荧光定位实验。
1.7 LvAST在血淋巴细胞上定位
取出贴壁生长良好的血淋巴细胞, 倒去培养基, 2×PBS轻轻洗涤2次, 每次3min, 分成4个实验组。其中实验组A和B用无水乙醇处理3min以增加细胞膜通透性; 实验组C、D血淋巴细胞不进行处理。2×PBS洗涤后用10% BSA(溶于PBS中)37°C封闭1h, 去除封闭液后, 在A和C组细胞中加入1∶1的Dylight 649标记的兔抗LvAST多抗和1∶1 Dylight 488标记的兔抗β-actin单抗, B和D组加入Dylight488标记的免疫前兔血清和Dylight 649标记的BSA作为阴性对照, 37°C避光孵育2h。2×PBS洗涤后, 用300nmol/L DAPI (溶于2×PBS中)复染3min, 用激光共聚焦显微镜(Nikon A1R, 日本)观察。
1.8 LvAST在肝胰腺、肌肉、鳃、淋巴器官石蜡切片上的定位
取肝胰腺、鳃、肌肉、淋巴器官石蜡切片各一张, 按照对虾组织学手册的方法脱蜡后PBS洗2×5min; 放入100mL 10mmol/L柠檬酸钠缓冲液(pH 6.0), 用微波炉高火加热至沸腾, 室温下放置10min后再次加热至沸腾, 待温度降为室温后PBS漂洗3×5min; 加10% BSA(溶于PBS中)室温封闭1h, PBS漂洗3×5min; 切片用基因芯片围栏(博奥生物有限公司, 北京)隔成A、B两部分。在各切片围栏A部分样品上加入200µL 1∶1 Dylight 649标记的LvAST多克隆抗体, 各切片围栏B部分加入等体积的Dylight 488标记的免疫前兔血清, 室温孵育1h, PBS洗涤后, 加DAPI核染3min, 漂洗后50%甘油封片, 在激光共聚焦显微镜下(Nikon A1R, 日本)观察。
1.9 激光共聚焦显微观察
分别以激发光488nm(观察Dylight 488在518nm的绿色荧光)、425nm(观察DAPI在461nm的蓝色荧光)、654nm(观察Dylight 649在673nm的红色荧光)在激光共聚焦显微镜(Nikon A1R, 日本)下观察并照相。观察时采用20×物镜, 应用NIS软件进行图像分析。
1.10 荧光显微照片荧光强度的定量分析
应用激光共聚焦显微镜(Nikon A1R, 日本)自带NIS软件进行荧光强度定量分析, 记录每张照片的激发光强度(Laser power, LP)和照相时的发射光增益(PMT Gain, PG): 利用软件求出选定区域内所有颜色荧光的轮廓所覆盖的面积(AF)和该区域内的红色荧光强度(R), 则LvAST在单位重量的组织中的相对量(LvAST)按以下公式计算。
LvAST=R/ (AF·LP·PG)
2 结果
2.1 Lvast mRNA在各组织中的特异性表达
凡纳滨对虾鳃、肌肉、肝胰腺、淋巴器官、血淋巴5种组织经实时荧光定量PCR对和β-actin的mRNA进行分析, 检测到这5种组织中均有mRNA 的表达。扩增产物荧光定量溶解曲线为单峰, 表明不存在非特异扩增及引物二聚体。根据Rotor-Gene 6软件采用ΔΔCT方法对结果进行分析, 以肌肉组织作为校正样品(Calibrator), 浓度定为1, 比较不同组织中在凡纳滨对虾组织中的表达(图1)。结果表明mRNA在所检测的鳃、肌肉、肝胰腺、淋巴器官、血淋巴中的表达差异很大, 其中肝胰腺、肌肉和鳃中表达量最高。
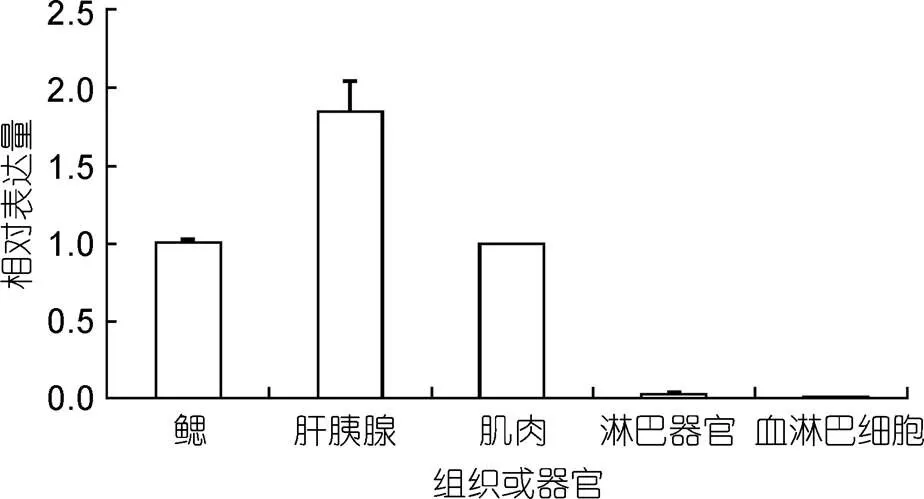
图1 实时荧光RT-PCR对对虾不同组织中Lvast mRNA表达的定量分析
注: 纵坐标的相对表达量为ΔΔCT相对定量分析(以β-actin为内参基因)
2.2 LvAST在血细胞上的免疫荧光定位
凡纳滨对虾血淋巴细胞用无水乙醇破坏细胞膜的通透性后(实验组A), 与绿色荧光素(Dylight 488)标记的抗β-actin抗体孵育, 在细胞内呈现出大量细胞骨架蛋白β-actin的阳性信号(绿色荧光)(图2c), 同时经红色荧光素Dylight 649标记的抗LvAST抗体染色后, 细胞内呈现大量带状或点状的红色荧光(图2c), 这种红色荧光几乎在所有的细胞中均能看到, 不过不同细胞上的荧光强度有明显差异; 未经无水乙醇处理的血淋巴细胞(实验组B), 与荧光标记的抗β-actin抗体和抗LvAST抗体孵育后, 未观察到β-actin的阳性信号, 但部分血淋巴细胞依然可以观察到明显的LvAST的红色荧光, 而部分细胞几乎没有或只有很少的点状分布的红色荧光(图2a); 免疫前血清孵育的阴性对照组未观察到绿色和红色荧光信号(图2d)。上述结果表明LvAST可分布在血淋巴细胞内和细胞膜表面, 但在不同血淋巴细胞表面的分布似乎有明显的差异。
2.3 LvAST的荧光免疫组织化学染色定位
采用免疫荧光组织化学染色的方法对LvAST进行定位。用红色荧光素DyLight 649标记的抗LvAST多克隆抗体对对虾肝胰腺、鳃、肌肉、淋巴器官的石蜡切片染色后, 经654nm外源性激发光激发, LvAST染色呈红色荧光, 从图3中可以看出LvAST在肝胰腺、肌肉、鳃、淋巴器官中均有分布(图3a, 3c, 3e, 3g)。细胞核染色后呈蓝色, 阴性对照(图3b, 3d, 3f, 3h)无明显荧光信号。
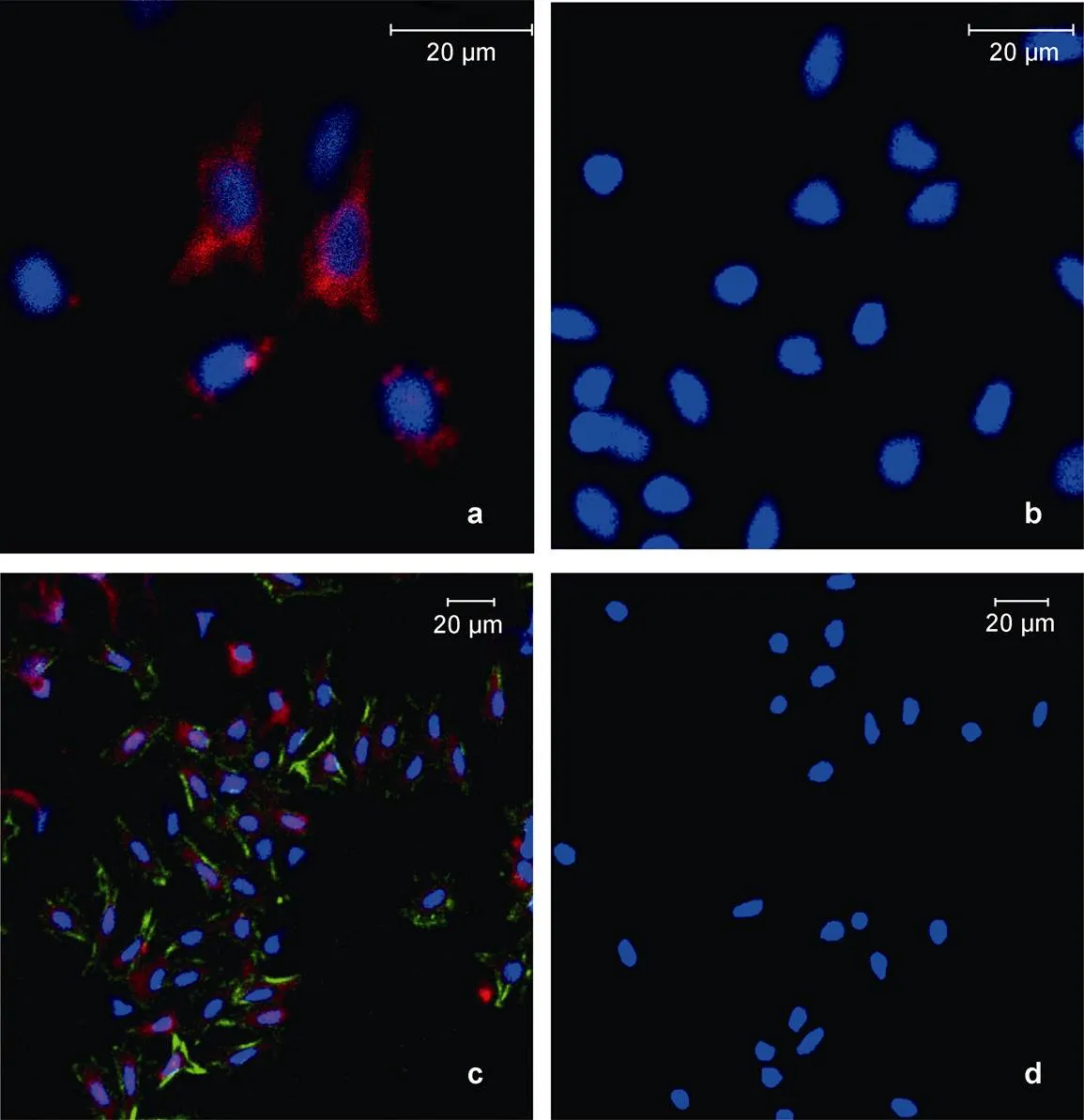
图2 激光共聚焦显微镜下免疫荧光细胞染色
a: 未经乙醇处理的血淋巴细胞用抗LvAST荧光抗体和抗β-actin荧光抗体染色, b: 未经乙醇处理的血淋巴细胞经荧光标记BSA和阴性血清染色的阴性对照, c: 乙醇处理的血淋巴细胞用抗LvAST荧光抗体和抗β-actin荧光抗体染色, d: 乙醇处理的血淋巴细胞用荧光标记的BSA和阴性血清染色的阴性对照
2.4 显微照片荧光强度的相对定量分析
应用NIS软件获得视野中所有显示红色或蓝色荧光的组织中的红色荧光的平均荧光强度, 结合相应照片的增益和激发光强度, 求出单位面积组织中的红色荧光强度即为LvAST在组织中的相对量(图2)。结果显示, LvAST在肝胰腺中分布最多, 在淋巴器官中分布最少, LvAST蛋白不同组织的分布结果与荧光定量PCR所得的mRNA在不同组织中特异性表达的结果相近, 但由于前者为蛋白水平后者为mRNA水平, 存在蛋白翻译水平的调控, 因此存在少许差异。不经乙醇处理和经过乙醇处理的血淋巴细胞经荧光免疫染色后的荧光定量分析, 结果表明LvAST在血淋巴细胞表面的分布是LvAST在血淋巴细胞内及其表面总量的50%。
3 讨论
WSSV是对虾大规模死亡的主要病原, 具有高致死率和广宿主嗜性, 自爆发以来对水产养殖业造成巨大损失。WSSV可感染对虾甲壳下上皮组织、血淋巴细胞、结缔组织、造血组织、鳃、肝胰腺管间血窦和淋巴器官细胞(雷志文等, 2002), 本实验室前期通过养殖实验分析LvAST对凡纳滨对虾抗WSSV感染的影响证明LvAST能在一定程度上提高对虾抗WSSV感染的能力, 起到保护作用(梁高峰, 2011)。
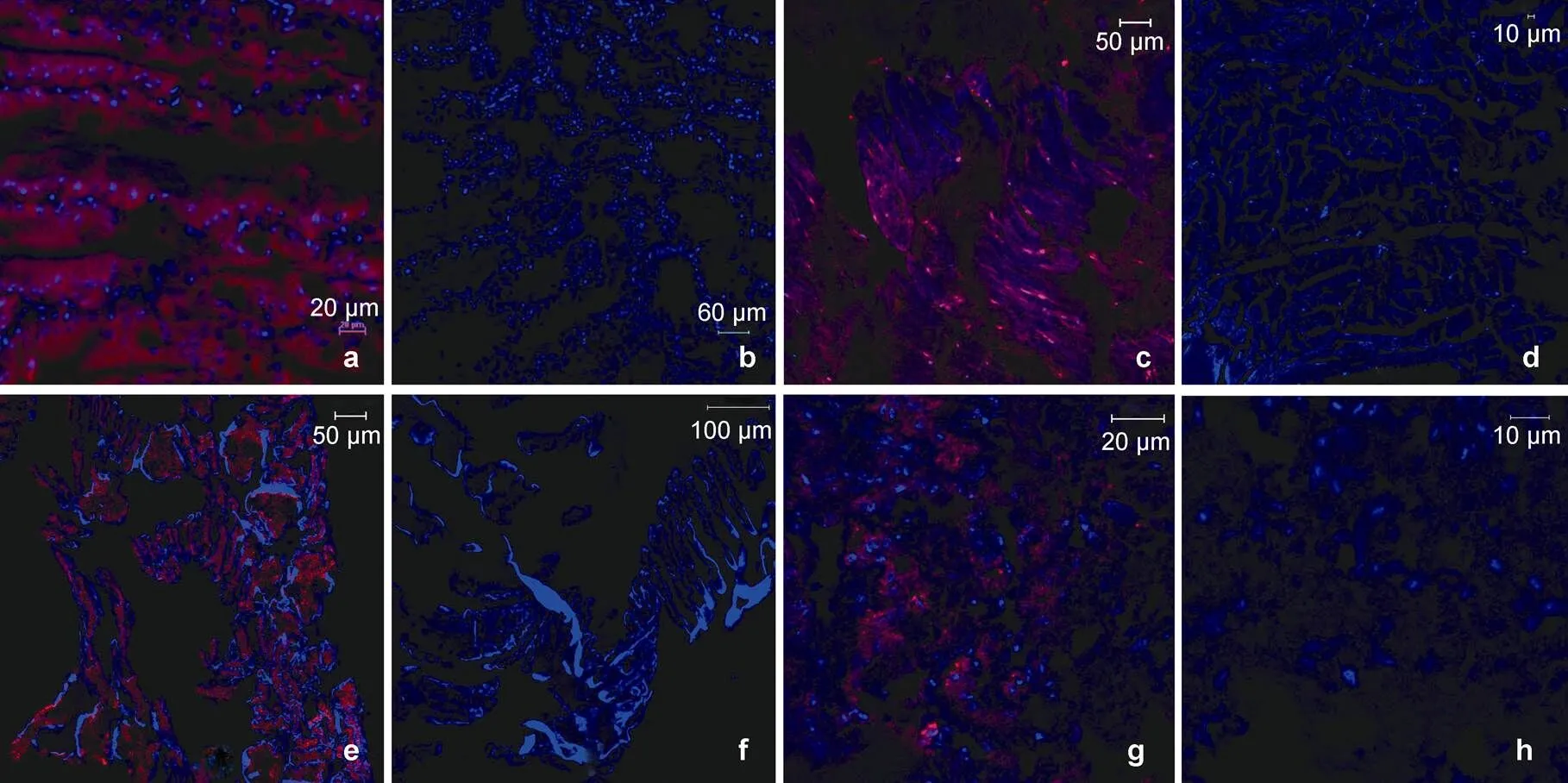
图3 激光共聚焦显微镜下LvAST的免疫荧光组织化学染色
a: 肝胰腺用抗LvAST荧光抗体染色, b: 肝胰腺经荧光标记的阴性血清染色的阴性对照, c: 肌肉用抗LvAST荧光抗体染色, d: 肌肉经荧光标记的阴性血清染色的阴性对照, e: 鳃用抗LvAST荧光抗体染色, f: 鳃经荧光标记的阴性血清染色的阴性对照, g: 淋巴器官用抗LvAST荧光抗体染色, h: 淋巴器官经荧光标记的阴性血清染色的阴性对照
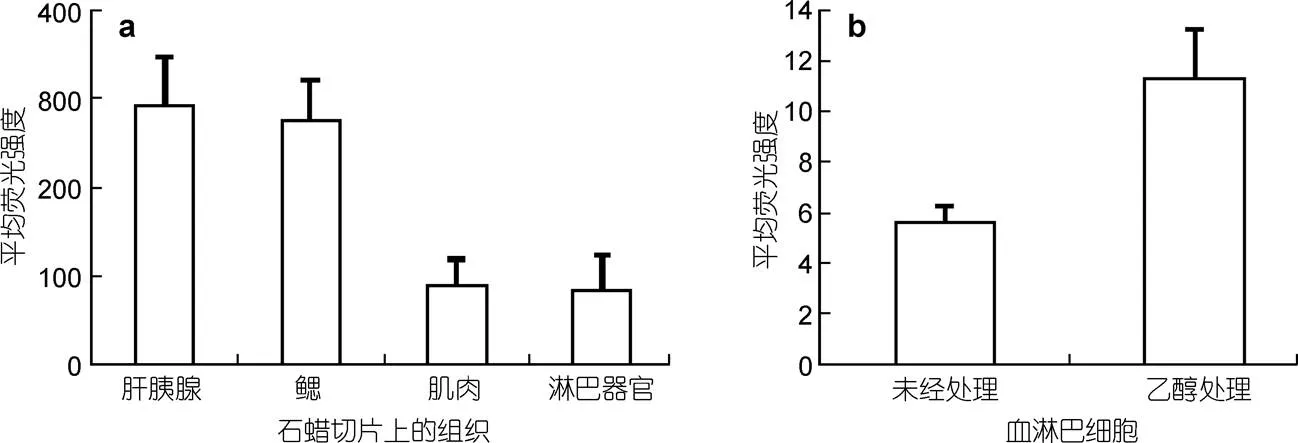
图4 凡纳滨对虾组织切片和培养细胞的荧光免疫化学检测的荧光强度定量分析
A. 石蜡切片的荧光免疫化学检测; B. 培养的血淋巴细胞经乙醇处理前后荧光免疫化学检测
通过荧光定量PCR检测, 本文揭示的mRNA主要在肝胰腺、肌肉和鳃中表达, 在淋巴器官和血淋巴细胞中的表达量很低, 这与Hsiao等(2010)的结果有所差异, 他认为造血激素主要分布在血淋巴细胞上, 而在肝胰腺中分布较少, 这种差异是否是与实验所用的虾的状态、种类等因素有关, 还需要进一步证明。
本实验首次通过免疫荧光细胞染色和免疫荧光组织化学染色的方法对LvAST在血淋巴细胞和肝胰腺上进行了LvAST蛋白的定位, 发现LvAST不仅在所有血淋巴细胞内存在, 而且也能分布在部分血淋巴细胞的表面, 并且根据刘勇等荧光强度的相对定量的计算方法, 在血淋巴细胞膜上的LvAST约为血淋巴细胞内及表明总量的50%; 而其组织分布特征显示LvAST在凡纳滨对虾的肝胰腺、鳃、肌肉和淋巴器官中均存在, 在肝胰腺中分布最多, 其蛋白的分布特征与mRNA的表达特征基本相符, 但由于前者为蛋白水平后者为mRNA水平, 存在蛋白翻译水平的调控, 因此存在少许差异。LvAST在血淋巴细胞表面分布呈现的细胞差异可能具有重要的血细胞分类意义。目前对这一方面还没有相关报道, 我们将在接下来的实验中进一步证明。
在LvAST的免疫荧光细胞定位观察时, 为了更准确地证实LvAST是否在细胞膜上定位, 排除可能因为细胞不完整而带来的干扰, 作者使用了绿色荧光标记的抗β-actin抗体作为细胞膜通透性的证明, 使实验严谨地证明了LvAST的确在血淋巴细胞膜的外表面存在分布。本实验采用DyLight染料标记抗体, 此染料的荧光强度较高, 光稳定性较好并且在很宽的pH范围内都有很好的荧光信号, 并且此染料的水溶性保证偶联反应中较高的染料-蛋白比例而不会引起染料的沉淀, 同时此染料的非渗透性保证了实验的准确。
本文通过荧光免疫技术, 成功实现了LvAST在细胞和组织中的定位观察, 首次证实LvAST几乎在所有血淋巴细胞内及部分细胞膜外均有分布, 这一研究为下一步明确LvAST、ATP合酶和WSSV-VP37之间在细胞水平的相互作用研究提供了技术途径。
刘 勇, 2012. 运用免疫荧光法检测温热对于硼化合物细胞微分布影响. 中华临床医师杂志, 10(6): 2618—2623
梁高峰, 2011. 凡纳滨对虾造血激素(astakine)的表达与功能研究. 青岛: 中国海洋大学硕士学位论文, 1—83
梁高峰, 梁 艳, 成君军等, 2012.凡纳滨对虾造血激素(astakine)基因全长序列分析及其克隆与表达. 渔业科学进展, 32(2): 76—85
雷志文, 黄 倢, 寇运同等, 2002.对虾白斑综合症(WSSV)的分子流行病学研究进展. 中国水产科学, 9(3): 260—264
Hsiao C Y, Song Y L, 2010. A long form of shrimp astakine transcript: Molecular cloning, characterization and functional elucidation in promoting hematopoiesis. Fish & Shellfish Immunology, 28(1): 77—86
Johansson M W, Keyser P, Sritunyalucksana K, 2000.
Crustacean haemocytes and haematopoiesis. Aquaculture, 191: 45—52
Lin X, Kim Y A, Lee B L, 2009. Identification and properties of a receptor for the invertebrate cytokine astakine,involved in hematopoiesis. Experimental Cell Research, 315(7): 1171—1180
Lin X, Söderhäll I, 2011. Crustacean hematopoiesis and the astakine cytokines. Blood, 117: 6417—6424
Lightner D V, Bell T A, 1998. A Handbook of Normal Penaeid Shrimp Histology, Baton Rouge, La: World Aquaculture Society, 1—114
Lorenzon S, De Guarrini S, Smith V J, 1999. Effects of LPS injection on circulating haemocytes incrustaceans in vivo. Fish Shellfish Immunol, 9: 31—50
Matsumoto S, Yamazaki C, Masumoto K H, 2006. Abnormal development of the olfactory bulb and reproductive system in mice lacking prokineticin receptor PKR2. Proc Natl Acad Sci USA, 103(11): 4140—4145
Melchiorri D, Bruno V, Besong G, 2001. The mammalian homologue of the novel peptide Bv8 is expressed in the central nervous system and supports neuronal survival by activating the MAP kinase/Pi—3—kinase pathways. Eur J Neurosci, 13(9): 1694—1702
Ng K L, Li J D, Cheng M Y, 2005. Dependence of olfactory bulb neurogenesis on prokineticin—signaling. Science, 308: 1923—1927
Philippe Roch, 1999. Defense mechanisms and disease prevention infarmed marine invertebrates. Aquaculture, 172: 125—145
SmithV J, 1991. Invertebrate immunology: phylogenetic, ecotoxicological andbiomedical implications. Comparative Haematology International, 1(2): 61—76
Söderhäll I, Kim Y A, Jiravanichpaisal P, 2005. An ancient role fora prokineticin domain in invertebrate hematopoiesis. Journal of Immunology, 174(61): 53—60
Watthanasurorot A, Söderhäll K, Jiravanichpaisal P, 2011. An ancient cytokine, astakine, mediates circadian regulationof invertebrate hematopoiesis. Cellular and Molecular Life Sciences, 68:315—323
THE TISSUE DISTRIBUTION AND CELLULAR LOCALIZATION OF ASTAKINE IN SHRIMP
XU Meng-Lin1, 2, LIANG Yan2, LU Jin-Feng2, WANG Xiao-Wen1, 2, LI Chen2,XING Jing1, HUANG Jie2
(1. The Key Laboratory of Mariculture, Ministry of Education, College of Fisherie, Ocean University of China, Qingdao 266003, China; 2. Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Science, Qingdao 266071, China)
Astakine, a cytokine in crustaceans, involves in hematopoiesis for stimulating cell proliferation and differentiation, and plays a key role in crustacean immune responses. In our previous studies, the gene ofin shrimp(LvAST) was cloned and expressed. To get more information about the function of LvAST, its tissue distribution was quantified by real time RCR; and additionally, its cellular localization was observed by immunofluorescence method. Results reveald that thegene distributes widely in different tissues, with relative higher expression in hepatopancreas, muscle, and gills. The cellular location recognized by Dylight 649 labeled polyclonal antibody of LvAST showed that LvAST is expressed not only in hemocytes but also on some hemocytes. In histology immunofluorescence method, we observed that the LvAST protein distributed in hepatopancreas, gills, muscle, and lymphoid organ, which is in accordance with the result of its gene expression in shrimp tissues.
; astakine; immunofluorescence; location; laser-scanning confocal microscope
10.11693/hyhz20121206001
* 国家重点基础研究发展计划(973计划)项目课题, 2012CB114400号; 国家自然科学基金课题, 31101934号; 基本科研业务费专项经费, 20603022013009号; 中央级科研院所基本科研业务费资助, 2010-cb-06号。徐萌霖, 硕士研究生, E-mail: weihaichongzi@163.com
黄倢, 研究员, E-mail: huangjie@ysfri.ac.cn
2012-12-06,
2013-02-12
Q346

