pCO2增加引起的海洋酸化对造礁珊瑚光合效率的影响*
周 洁 余克服 施 祺
CO2增加引起的海洋酸化对造礁珊瑚光合效率的影响*
周 洁1, 2①余克服1施 祺1
(1. 中国科学院南海海洋研究所 广州 510301; 2. 中国科学院海南热带海洋生物实验站 三亚 572000)
本研究采用叶绿素荧光技术, 选取三种鹿回头珊瑚礁区常见的珊瑚种类(、和), 分别设置海水环境为450μatm、650μatm(IPCC预测的2065年的水平)、和750μatm(IPCC预测的2100年的水平)的三个CO2浓度梯度, 监测珊瑚在不同CO2浓度下10天内的光合荧光参数的变化。实验结果表明, 水体CO2为650μatm时, 珊瑚的总体光合效率最高, 但随着时间延长, 珊瑚荧光参数在三个浓度梯度下都会显示不同程度的下降趋势。虽然三种珊瑚对不同浓度CO2的响应程度不同, 但均显示出在低浓度CO2时, pH下降引起的酸化作用控制着珊瑚共生藻的光合效率; 而随着CO2浓度增加, CO2增加引起的施肥效应则愈加明显, 并与酸化作用竞争, 共同作用于珊瑚共生藻, 使得光合荧光参数在波动中发生变化。
关键词 海洋酸化;CO2; 造礁珊瑚; 光合效率; 酸化效应; 施肥效应
Vostok冰芯记录(Petit, 1999)显示, 在过去的42万年里, 大气CO2浓度在180ppmv到280— 300ppmv之间以约10万年为周期呈波动变化。但受人类活动影响, 目前大气CO2浓度已从工业化前的280ppmv上升至现在的380ppmv, 远远超过了自然变化的幅度。大气CO2浓度的增加带来了严重的温室效应, 使得全球气候变暖, 同时导致海水中CO2浓度过饱和以及酸度增加。根据已得到的测量结果(Mehrbach, 1973; Caldeira, 2003; Feely, 2009), 海洋吸收的CO2已经导致表层海水pH值下降了0.12, 这相当于海水中氢离子(H+)浓度上升了30%。按照现在人类活动排放CO2的速率, 到2100年海洋平均pH值将会比现在再降低0.5, 即从现在的8.2下降到7.7, 那时海水中H+浓度将是现在的三倍。大气CO2浓度升高导致海水酸化的同时也会改变海水溶解无机碳(CO2、HCO3-、 CO32-)的浓度与比例, 以致海水CO2分压(CO2)和HCO3-浓度增加, CO32-浓度下降(Kleypas, 2000)。目前一般认为, CO32-浓度的变化影响海水碳酸钙(CaCO3)的饱和度, 进而影响钙质生物的钙化作用(Gattuso, 1993; Elderfield, 2002; Feely, 2004; Orr, 2005)。建模实验(Langdon, 2000)表明, 在大气CO2浓度为560ppmv的环境下, 珊瑚礁的钙化率将降低40%。
造礁珊瑚最基本的生态特征便是与一类称为虫黄藻(zooxanthellae)的单细胞藻类共生。珊瑚共生藻可以通过光合作用为宿主的钙化作用提供必要的能量, 因此酸化条件下共生藻是否可以为其提供充足的能量对宿主的生存至关重要。但到目前为止, 关于酸化对珊瑚的影响研究基本集中在钙化方面, 对珊瑚共生虫黄藻活性的影响研究较少(Goiran, 1996; Reynaud, 2003; Marubini, 2008), 且研究结果多样, 至今还存在较大的争议。为此本文探讨CO2浓度升高及其导致的海水酸化对造礁珊瑚共生藻光生理学特性的影响, 希望有助于全面评估海洋酸化对珊瑚礁生态系统的影响。
1 研究地点与方法
1.1 珊瑚采集
海南三亚鹿回头珊瑚礁(109°28′E, 18°13′N)发育有非常典型的珊瑚岸礁, 是我国研究程度最高的珊瑚岸礁之一。鹿回头珊瑚礁的优势珊瑚科为鹿角珊瑚科(Acroporidae)、杯形珊瑚科(Pocilloporidae)和滨珊瑚科(Poritidae), 优势珊瑚属为滨珊瑚属()和鹿角珊瑚属(), 优势珊瑚种为澄黄滨珊瑚()(赵美霞等, 2009)。
本研究选取了三亚鹿回头珊瑚礁海域三种常见种作为室内建模实验的研究对象, 包括强壮鹿角珊瑚、稀杯盔形珊瑚和秘密角蜂巢珊瑚。将野外采集的珊瑚样品于1h内运入位于中国科学院海南热带海洋生物实验站的“珊瑚礁环境监测-记录实验室”内珊瑚养殖箱, 并分成4小块。每个养殖箱尺寸为150cm×60cm× 80cm, 水流控制为6500L/h, 利用空调使水温稳定在26°C左右, 盐度控制在33左右, 400W金属卤化吊灯(色温为20000K)提供光源, 每天6:00—18:00给予12h的光照。大约一周后, 待珊瑚情况稳定后开始进行实验。本实验中的珊瑚种属鉴定得到了赵美霞的帮助。
1.2 室内模型的建立
根据前期野外监测获得的资料, 三亚鹿回头海域海水CO2的平均值为390μatm, 鉴于实验室的密闭环境会使海水CO2略有升高, 因此拟在实验室建立本底为450μatm的模拟环境, 以650μatm(IPCC预测2065年水平)、750μatm(IPCC预测2100年水平)(IPCC, 2007)为浓度梯度, 以10天为实验周期, 观察珊瑚在不同浓度中的响应。CO2水平的调节是通过向过滤槽内通入CO2实现的, 并通过计泡器来调节CO2的流速。通过监测养殖箱内pH, 从而间接对CO2水平进行实时监控。
1.3 研究方法
1.3.1 海水理化参数的测量 利用YSI6920V2型多参数水质观测仪测量养殖箱内海水的温度、盐度。每隔6h对养殖箱内海水进行采集, 测其pH和总碱度(TA)。以上各参数使用软件CO2SYS Program(Pierrot, 2006), 选择Mehrbach等人(1973)提出并经Dickson等(1987)修订后的常数, 可计算碳酸盐体系各组分(CO2, CO32-, HCO3-, 海水总溶解CO2*, 文石饱和度War)。
1.3.2 珊瑚共生藻叶绿素荧光参数的测定 为了检测环境因子对珊瑚共生藻光合作用的影响, 我们利用超便携式调制叶绿素荧光仪Mini-PAM(Walz, Effeltrich, Germany)测量珊瑚共生藻叶绿素荧光参数来指示这些变化。将珊瑚样品置于黑暗环境下20min, 测量其荧光诱导曲线和快速光响应曲线(Rapid Light Curve, RLC), 得到以下7个荧光参数: 最大光量子产量v/m、实际光量子产量PSII、光化学淬灭系数P、非光化学淬灭系数NPQ、系统效率、最快电子传递速率rETRmax和最低饱和辐射k, 各参数的意义与计算方法已列于表1中。
表1 荧光参数及其定义

Tab.1 Parameters and definitions of fluorescence
*光响应曲线
测量时, 将Mini-PAM光导纤维探头置于与珊瑚表面垂直距离约为2mm处, 所用光纤的有效光径为5.5mm, 电信号阻尼(Damping)和增益(Gain)的设置分别为1和2。每天早上5:00开始, 每隔6h对养殖箱内珊瑚样品进行叶绿素荧光参数的测定。
1.4 数据统计分析方法
数据间的正态性检验采用Shapiro-Wilk的检验统计量, 方差齐性检验采用Levene’s检验。不同CO2水平下各参数间的差异采用一元方差分析(one-way ANOVA), 用Student-Newman-Keuls(SNK)法比较各组间平均值间的差异是否有统计学意义。若不满足正态性或方差齐性, 则选用Krusal-Wallis秩和检验进行分析。同一CO2水平下不同日期间的参数比较采用检验和符号秩和检验(不满足正态性或方差齐性)。影响因子与参数之间的相关关系采用Pearson直线相关分析。所有统计都在SAS 9.2软件(SAS Institute, Cary, NC)中完成, 显著性水平设定为=0.05。
2 实验结果
2.1 环境参数
根据野外监测结果建立的室内模型参数如表2所示, 温盐都控制在珊瑚正常生长范围内。三个处理组间的CO2与pH统计学差异显著(<0.05)。其它类似的酸化实验所建立的模型中(表3), 虽然温度、盐度等具体参数不尽相同, 但基本上当CO2从450μatm增加到650μatm时, pH的变化范围为0.116—0.171; 当CO2从450μatm增加到750μatm时, pH的变化范围为0.180—0.250。本实验将CO2从450μatm增加到650μatm和750μatm时, pH分别降低了0.118和0.183, 属于变化的正常范围。
图1将本模型中的CO2和pH与自然环境海水中的变化趋势作了比较, 可看出室内模型的总体水平要低于自然环境的变化。根据野外监测数据拟合出的多元线性趋势表明, 当pH降到7.9时, 其CO2可增加到950μatm以上, 而模型中只增加到800μatm左右, 达不到900μatm, 但二者的趋势变化是相似的。若将表3中其他研究的室内模型参数放入图中, 模拟出来的水平也要低于自然环境的变化。
2.2 pCO2水平升高下珊瑚共生藻荧光参数的响应
2.2.1 荧光参数平均水平变化
2.2.1.1 实际光量子产量PSII总体来看(图2a), 三种珊瑚650μatm组的PSII值都最大。其中,在CO2为450μatm时其PSII平均值为0.70±0.07, 与650μatm组的(0.73±0.04)差异显著(χ2=9.3234,=0.0095), 而750μatm组的PSII(0.72± 0.05)与其它两组都无明显差异。对于, 当CO2从450μatm升到650μatm时, 其PSII无统计学差异, 约为0.72, 而升到750μatm时,PSII值明显下降到0.70±0.09(χ2=10.1271,=0.0063)。共生藻的PSII值是三种珊瑚中相对低的, 450μatm组的平均值仅为0.58±0.12, 显著(χ2=124.9,<0.0001)低于650μatm组(0.67±0.04), 而其与750μatm组(0.60±0.09)两组间无明显差异。
2.2.1.2 最大光量子产量v/m从平均水平来看(图2b), 与PSII类似, 三种珊瑚650μatm组的v/m值都是最大的,要明显低于另2种珊瑚。其中,三组的差异都很明显(χ2=65.1053,<0.0001),CO2为450、650和750μatm时其v/m平均值分别为0.66±0.03、0.73±0.02和0.69±0.03。对于, 当CO2从450μatm升到650μatm时, 其v/m平均值从0.72±0.02增加到0.75±0.02, 而当升到750μatm时, 又下降到0.72±0.02, 因此450和750μatm两组差异并不显著。CO2为450、750μatm时,的v/m值无显著差异, 这两组都明显低于650μatm组的0.68±0.02。
表2 鹿回头礁区自然环境和室内实验环境的海水参数
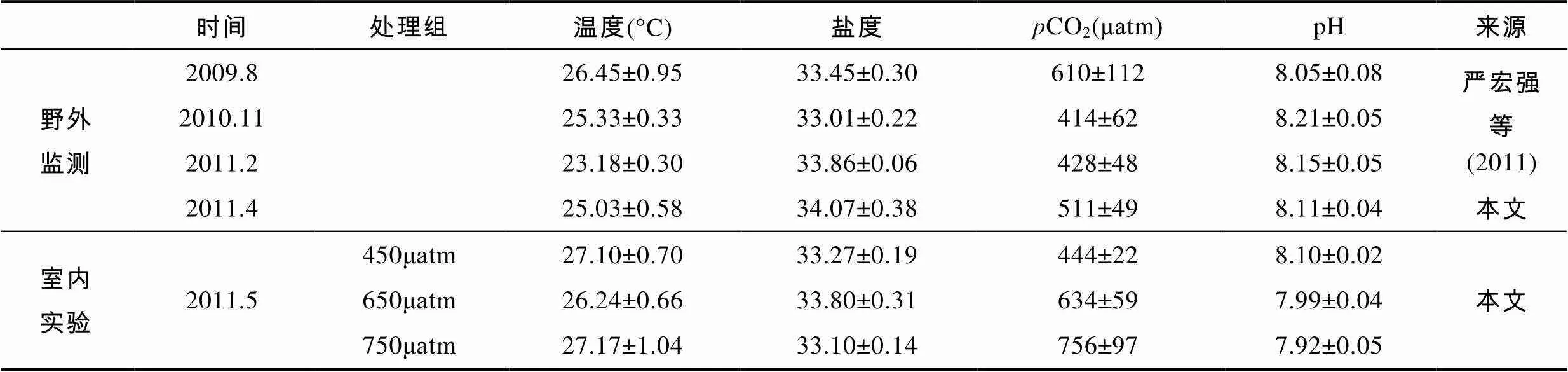
Tab.2 Comparison of seawater parameters between field monitoring and CO2-dosing control experiment
表3 建模实验碳酸盐系统参数
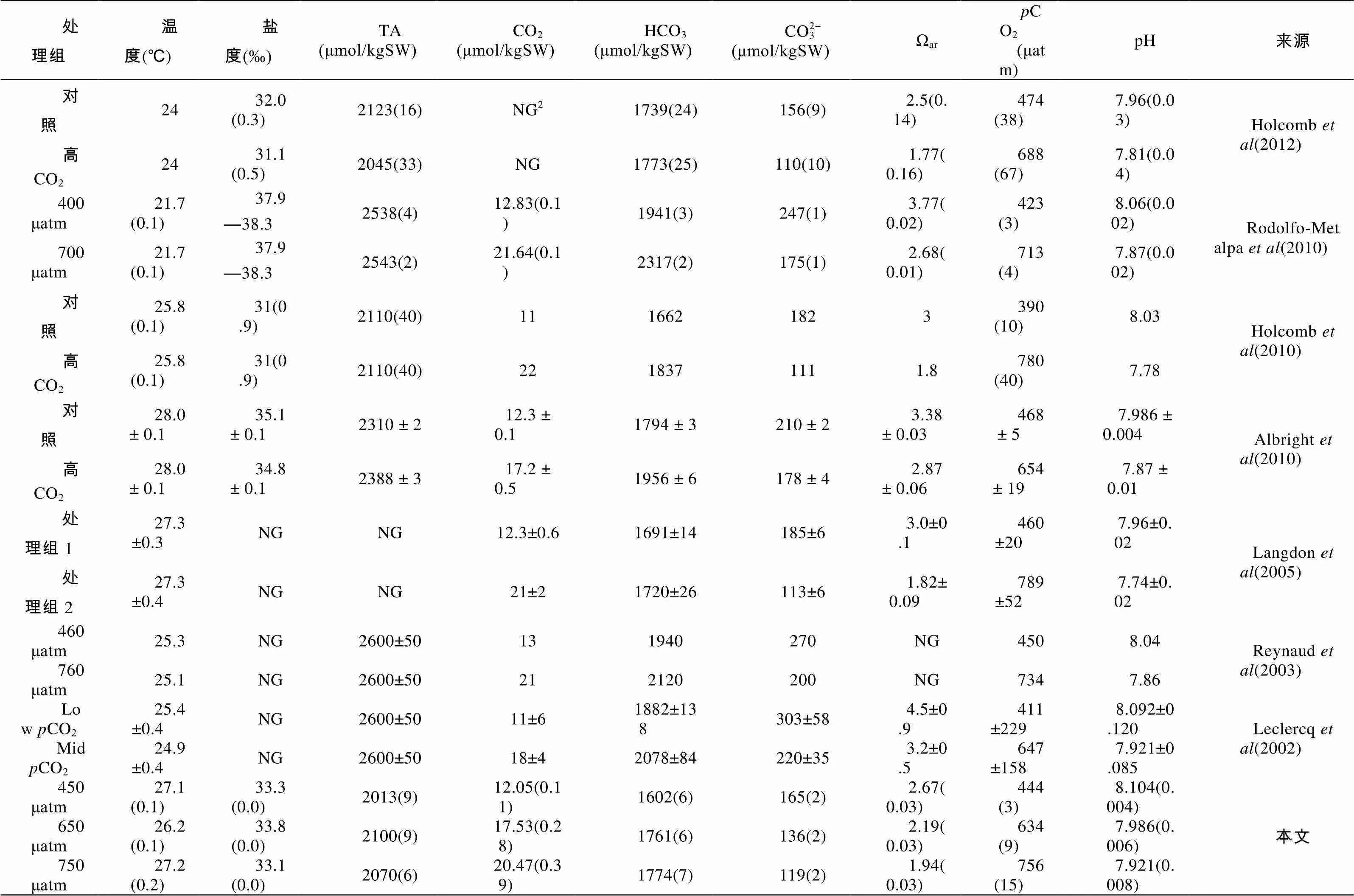
Tab.3 Summary in parameters of carbonate chemistry from available sources
括号内为标准误差; SW指海水中含量;NG表示文献未给出该参数。
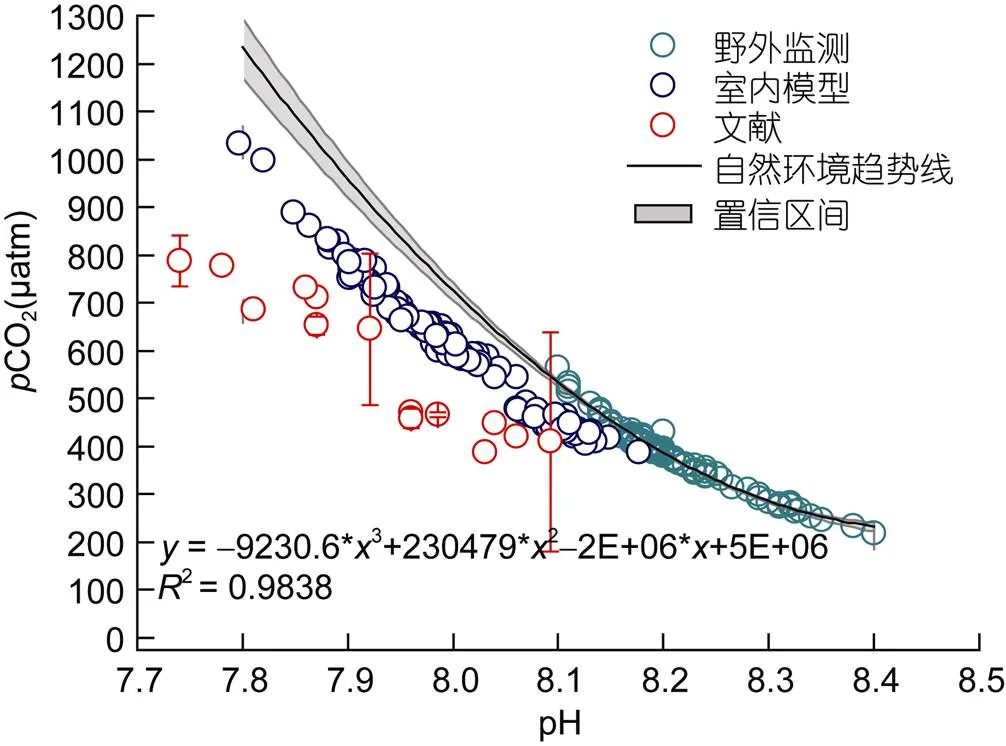
图1 鹿回头海域野外监测点(青色)与室内模型(蓝色)以及其他研究(红色)的pCO2和pH浓度
2.2.1.3 系统效率总体来看(图2c), 三种珊瑚在不同的CO2下, 其都差异较显著, 且750μatm组的明显低于650μatm组。其中,和的变化趋势相似, 450μatm组的最低, 平均分别为0.19±0.02和0.16±0.02, 要明显低于其他两组(χ2=90.0233,<0.0001)。对于, 当CO2从450μatm增加到650μatm时,没发生明显变化。
2.2.1.4 光化学淬灭系数P从平均水平来看(图2d), 三种珊瑚在CO2为750μatm时,P达到最大。其中,750μatm组的P平均为0.92±0.09, 450μatm组的值(0.88±0.12)要高于650μatm组(0.86± 0.07)(χ2=37.5829,<0.0001)。对于, 随CO2逐渐增加, 从450μatm的0.70±0.07升到650μatm的0.73±0.10, 最终增加到750μatm的0.81± 0.11。并且三个处理组中,的P水平都要低于。是三种珊瑚中水平最高的, 650μatm时其P平均组为0.93±0.08, 略低于450、750μatm组(χ2=175.2057,<0.0001)。
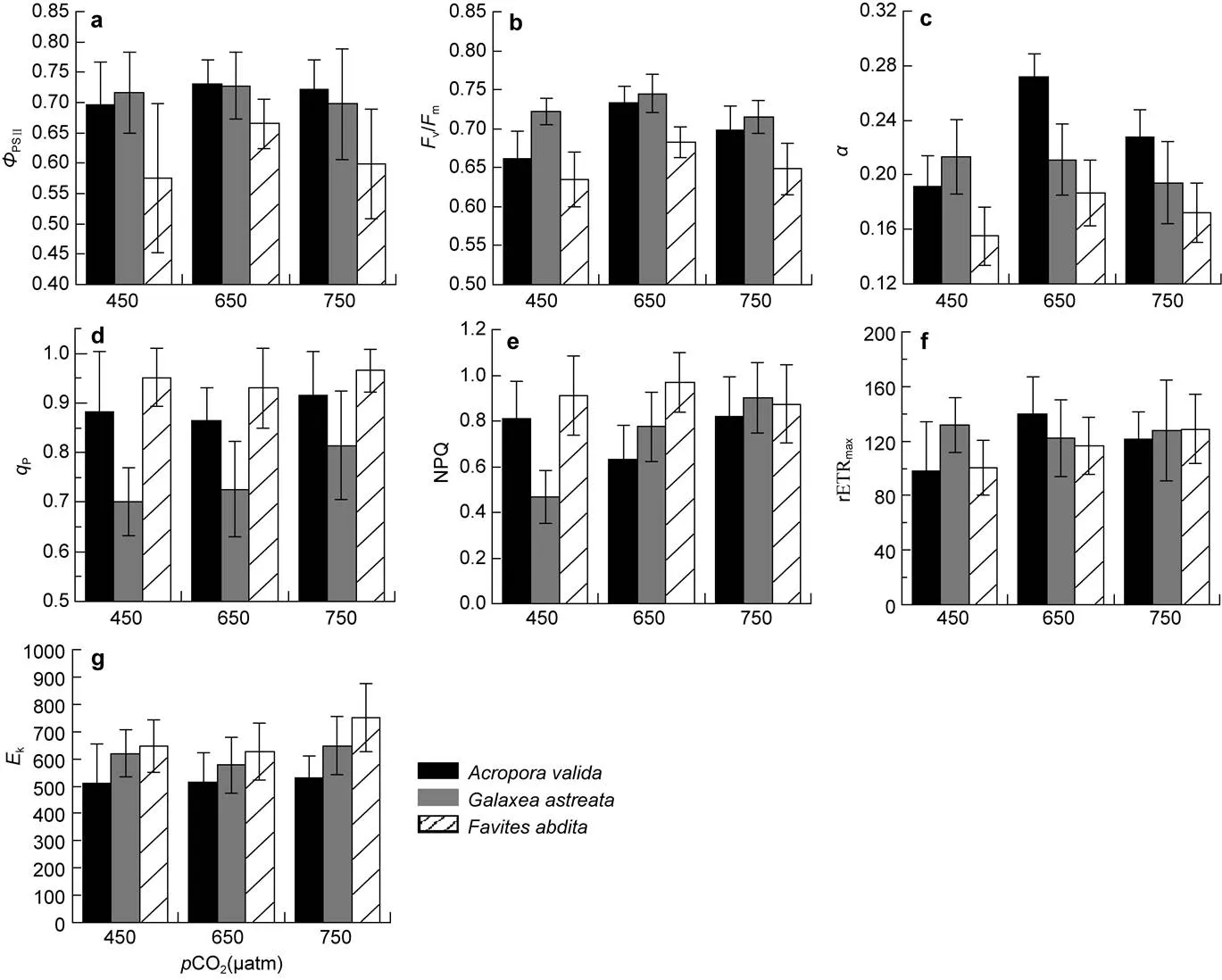
图2 不同pCO2水平下珊瑚共生藻荧光参数均值比较
a.PS II的实际光量子产量PSII; b. PS II的最大光化学量子产量v/m; c. 电子传递链效率; d.光化学淬灭系数P; e. 非光化学淬灭系数NPQ; f. 最快电子传递速率rETRmax; g. 最低饱和辐射k
2.2.1.5 非光化学淬灭系数NPQ 三种珊瑚的NPQ在CO2增加时的变化差异很大。650μatm组的NPQ平均为0.63±0.15, 是三个处理组中最低的(χ2=92.0785,<0.0001), 而450和750μatm组无明显差异。对于, 随CO2渐渐增加, 其NPQ从450μatm的0.47±0.11升到650μatm的0.77±0.15, 最终增加到750μatm的0.90±0.15, 三组之间差异显著(χ2=241.742,<0.0001)。而的平均最高NPQ出现在650μatm组, 约为0.97±0.13, 450μatm和750μatm组的平均NPQ无明显差异。
2.2.1.6 最快电子传递速率rETRmax从平均水平来看(图2f), 不同CO2下和的rETRmax存在显著差异(χ2=33.1254,<0.0001; χ2= 31.1395,<0.0001)。与相似,在450μatm组的值最低, 而650μatm组的值最大。对于, 当CO2从450μatm增加到750μatm时, rETRmax没发生明显变化。随CO2的增加,的rETRmax由450μatm组的100.3±20上升到750μatm组的128.8±25。
2.2.1.7 最低饱和辐射k从平均水平来看(图2g), 不同CO2下的k平均水平不存在显著差异(χ2=1.962,=0.3749)。对于, 当CO2从650μatm增加到750μatm时,k水平明显上升(=5.50,=0.0052)。而在CO2较低时无较大变化, 当升到750μatm时,k出现显著的增加(χ2=47.3661,<0.0001)。
2.2.2 低浓度下珊瑚共生藻荧光参数的响应
2.2.2.1当CO2为450μatm时,的七种荧光参数中有三种出现明显下降 (图3a):PSII(=-0.9536,<0.0001)、v/m(=-0.7954,= 0.0034)和(=-0.6861,=0.0197)。其它四种参数虽有下降趋势, 但并不显著。同时该浓度下,的v/m和NPQ变化与pH呈显著的正相关(v/m=0.4118,=0.0067; NPQ=0.4808,=0.0013), NPQ还与CO2略呈负相关关系(=-0.3588,=0.0196), 说明低浓度时的v/m和NPQ主要受pH控制。
2.2.2.2与相比,在CO2为450μatm的环境下变化并不大, 只有PSII略微下降(=-0.7262,=0.0114), 其他的荧光参数虽有波动, 但未出现显著的趋势(图3b)。众多荧光参数与pH、CO2相关性分析结果显示, 只有v/m的日平均值在该浓度与CO2有略显著的负相关关系(=-0.6666,=0.0251), 说明CO2的增加会减少的光合产量。
2.2.2.3在CO2为450μatm的环境中,共生藻的荧光参数中有两种出现了较明显的下降(图3c):PSII(=-0.8127,=0.0024)和(=-0.8387,=0.0013)。相关性分析结果表明,P随pH的增加而增加, 略呈正相关关系(=0.3712,=0.0155), 说明450μatm环境下的P变化主要受pH控制。
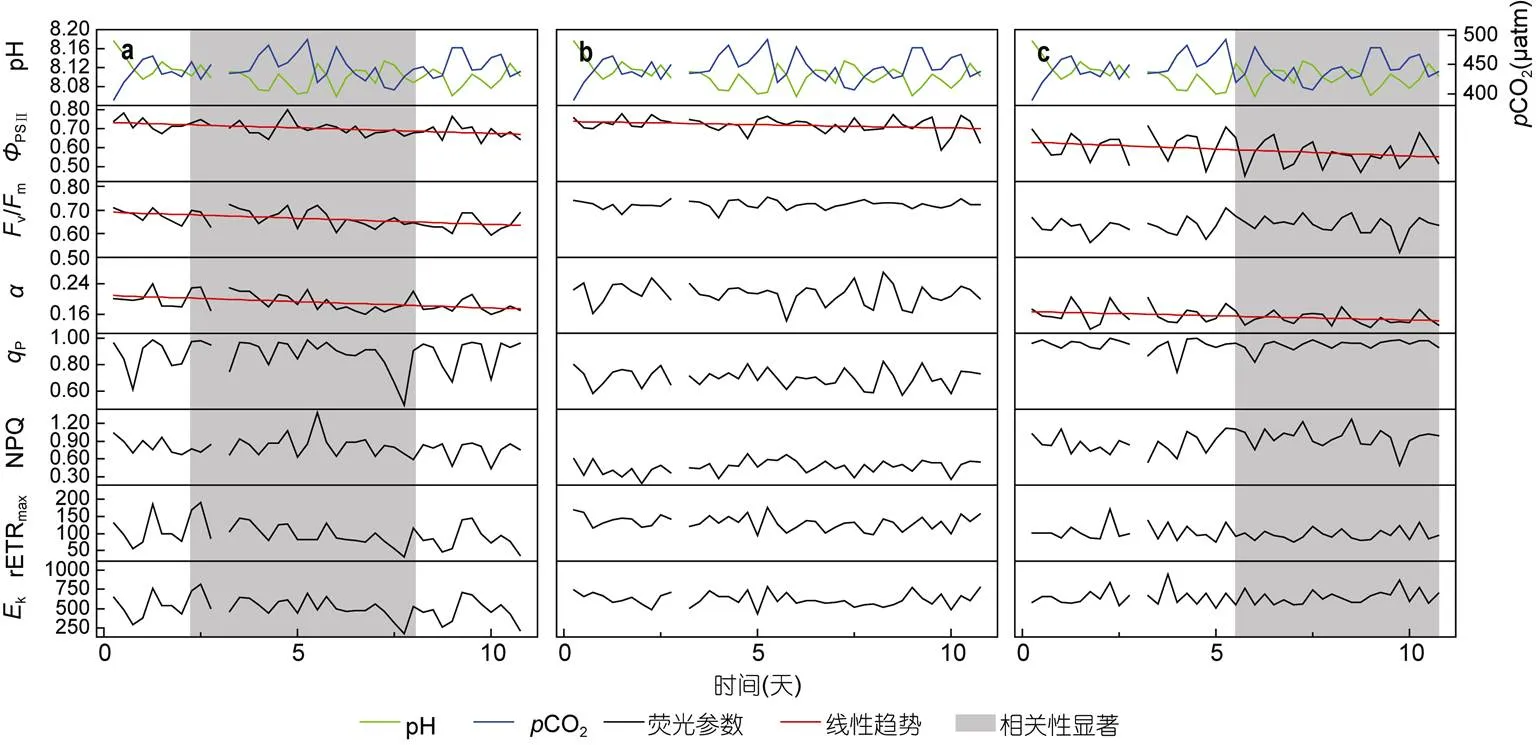
图3 450μatm时珊瑚共生藻荧光参数在实验期间的变化
2.2.3 中浓度下珊瑚共生藻荧光参数的响应
2.2.3.1在650μatm组中,的七种荧光参数中仅有两种出现了显著下降(图4a):v/m(=-0.8613,=0.0007)和(=-0.8071,=0.0027), 但其下降幅度都不及450μatm组。同时,v/m的日平均值与pH呈较显著正相关(=0.6586,=0.0275), 说明该浓度下的v/m受到了pH变化的影响。
2.2.3.2与450μatm组相比,在CO2为650μatm时光量子产量并未受到较大影响, 而电子传递链, 即rETRmax和k均出现明显下降(=-0.65112,=0.03;=-0.82986,=0.0016), 同时这两个参数还与pH呈正相关关系,k与CO2呈负相关关系, 说明该组的电子传递链主要受pH影响(图4b)。
2.2.3.3与类似,在CO2为650μatm时, 其大多数共生藻荧光参数并未受到太大影响, 仅v/m(=-0.7297,= 0.0108)和(=-0.7080,=0.0148)受到了较明显抑制, 但抑制程度远不及450μatm组(图4c)。但相关分析显示, 七个所测量的荧光参数的日平均值都与pH呈明显的正相关关系, 说明650μatm的酸化环境已经明显影响到了该珊瑚的光合作用。
2.2.4 高浓度下珊瑚共生藻荧光参数的响应
2.2.4.1当CO2增加到750μatm时,共生藻的PSII(=-0.6341,=0.0362)、v/m(=-0.8613,=0.0007)和(=-0.6149,=0.0441)都有明显的下降, 但下降幅度仍不及450μatm组, 后两种参数的显著性水平也不及450μatm组(图5a)。相关性分析显示,共生藻各荧光参数的变化与pH或CO2增减没有明显的相关关系。
2.2.4.2与CO2为450μatm时类似,在CO2较高的环境下变化也不大, 只有PSII有较明显的下降(=-0.7809,= 0.0046), 其他的荧光参数虽有波动, 但未出现显著的趋势(图5b)。同时,PSII与pH呈正相关关系(=0.5238,= 0.0004), 与CO2呈负相关关系(=-0.4846,= 0.0011); 与此相反,v/m与pH呈负相关关系(=-0.3143,=0.0454), 与CO2呈正相关关系(=0.3532,=0.0235), 此外,和rETRmax也与CO2有一定的正相关关系(:=0.3591,=0.0211; rETRmax:= 0.3178,=0.0429)。说明在CO2为750μatm的环境下,的PSII主要受pH控制, 而v/m、以及rETRmax主要受CO2影响。
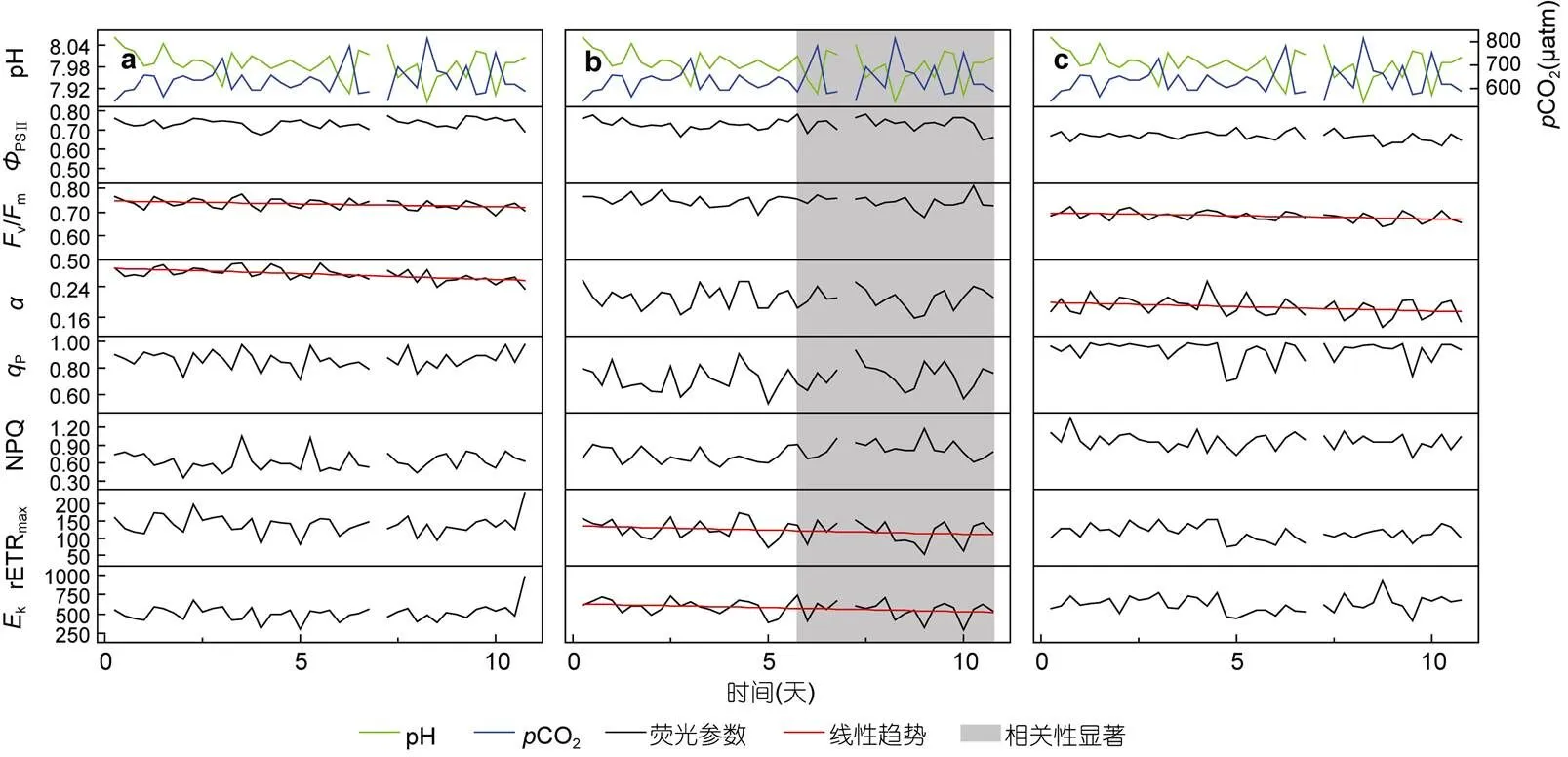
图4 650μatm时珊瑚共生藻荧光参数在实验期间的变化
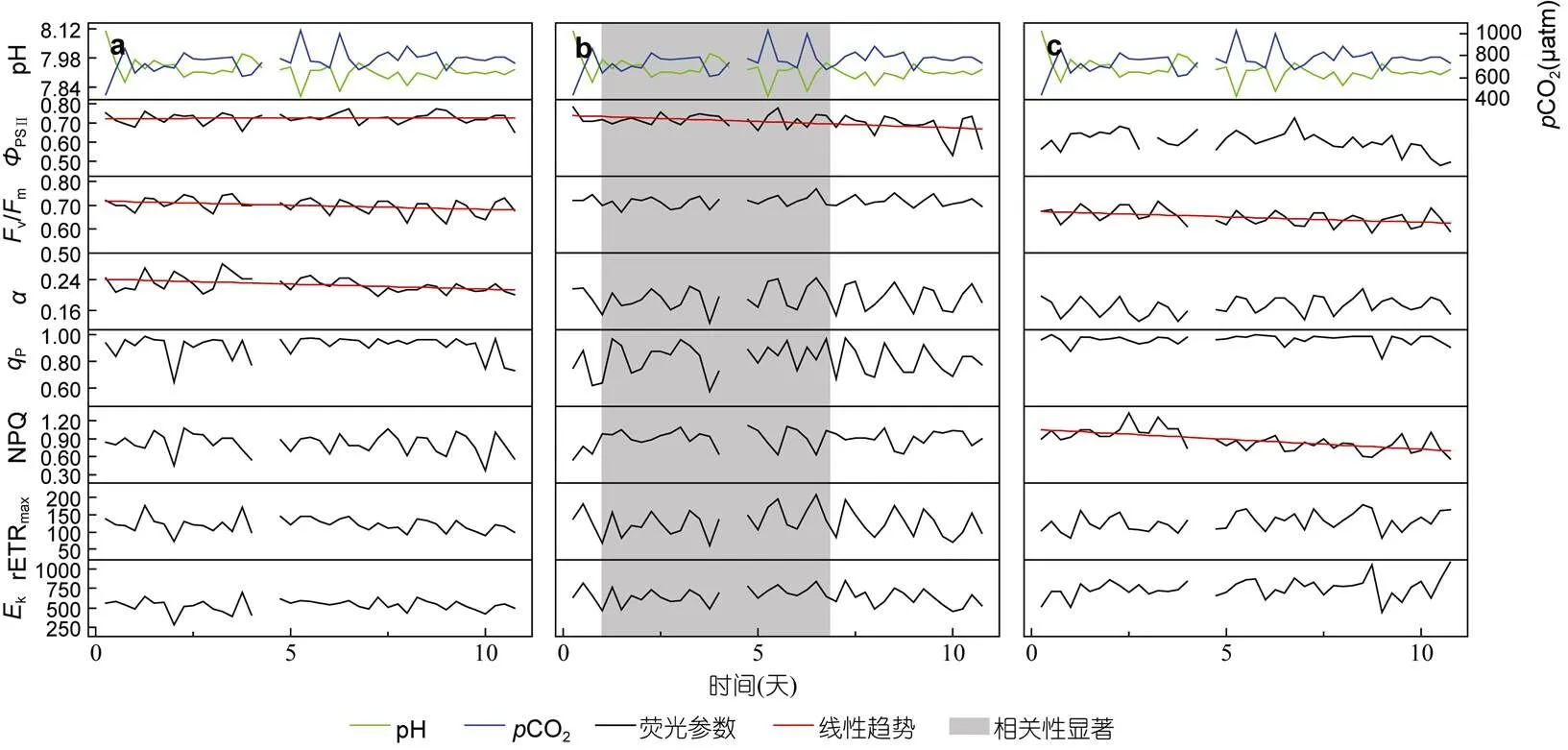
图5 750μatm时珊瑚共生藻荧光参数在实验期间的变化
2.2.4.3在CO2较高的环境下,有两种荧光参数发生了较明显的下降(图5c):v/m(=-0.7111,=0.0141)和NPQ(=-0.7755,=0.005)。相关分析结果显示,PSII和v/m、P和NPQ的日平均值都与pH呈正相关关系, 与CO2呈负相关关系; 而与电子传递链有关的另外三个参数则与pH呈负相关关系, 与CO2呈正相关关系。说明CO2的增高已严重抑制了的光合产量, 但同时刺激了光合系统中电子传递链的效率。
3 讨论
3.1 pCO2增加引起的海洋酸化对珊瑚共生藻光合作用的影响
CO2增加首先改变了海水的碳酸盐平衡, 本研究建立的模型中, 在其从450μatm升到750μatm的过程中, 海水pH值从8.10±0.02降到7.99±0.04, 最终降到7.92±0.05。海水pH的降低会对珊瑚内部pH梯度产生作用(Marubini, 1999), 最终影响蛋白质性质、细胞膜的渗透性和包括碳酸钙沉积速率在内的其他生物功能(Gattuso, 2000; Jiang, 2005)。
过去人们普遍认为, 与陆地植物的CO2施肥效应类似, CO2增加会促进珊瑚共生藻的生长, 从而使钙化速率增加。这一误区建立在两个关于珊瑚-藻共生关系的假设上: 1)光合作用的增加会促进钙化率; 2)共生藻光合作用会随着CO2的上升而增加。第一个假设建立在珊瑚虫黄藻在光下的钙化作用要比黑暗中快这一事实(Kawaguti, 1948; Chalker, 1975), 而且白化珊瑚的钙化作用会减慢或停止(Leder, 1991)。这一推断的结果是光合作用促进了钙化作用。但值得注意的是, 光促钙化的机制还未完全解开, 有研究者(Cohen, 2003)提出了另一种完全相反的观点, 认为是钙化作用促进了光合作用。第二个假设忽略了这一事实: 虫黄藻主要使用HCO3-为底物进行光合作用, 其次利用CO2(有些是呼吸作用产生的)(Burris, 1983; Goiran, 1996), 且有人发现向海水中添加HCO3-会增强光合作用(Weis, 1993; Herfort, 2008; Marubini, 2008)。本研究中未发现珊瑚的电子传递速率随CO2增加而普遍加快的现象, 说明珊瑚共生藻并不是直接利用CO2进行光合作用。并且, 当大气CO2增加一倍时水中溶解的CO2浓度会随之增加100%, 但HCO3-浓度只会增加约14% (Kleypas, 2006); 而本研究模型中,CO2从450μatm增加到750μatm时, HCO3-浓度从1602μmol/kg增加到1774μmol/kg, 仅增加了10.6%, 同时pH下降了0.18个单位, 这相当于海水中H+浓度增加了52%, 因此本研究中CO2的增加并没引起HCO3-浓度的大幅度增加, 其对共生藻光合作用的促进作用很有限。而CO2增加的另一效应——pH降低成为抑制珊瑚生长的主要因素, 两种效应相互抵消, 这可能是本研究中有些参数的变化趋势不显著的主要原因。
叶绿素荧光技术是监测珊瑚共生藻生理变化的一个实用工具, 本研究运用该技术, 将三种造礁珊瑚置于CO2为450、650和750μatm环境中, 监测了CO2增加导致的酸化环境下珊瑚光合效率的变化。结果显示, 650μatm时珊瑚的总体光合效率最高, 该处理组三种珊瑚的PSII、v/m和(图2)平均水平都高于450和750μatm处理组。这三个参数都反映了光合效率的高低以及被用于光合作用的能量多少。但从各处理组实验期间参数的变化来看,在三个处理组中, 都呈现出v/m和下降的趋势(图3—5); 而出现了PSII下降(图3, 5)、rETRmax减慢和k降低的趋势(图4);则出现了光量子产量下降趋势(图3—5)。其中, 电子传递速率的降低会影响到光合作用的效率, 同时k的降低表明在低辐射下, 珊瑚共生藻的光合效率会达到饱和, 从而更易受到高辐射胁迫造成光损伤, 使珊瑚对辐射的耐受性降低。虽然有些趋势不显著, 但即使在光合效率最高的650μatm处理组也有这种下降趋势, 只是相对来说, 其变动幅度不及另外两个处理组大, 说明CO2从450μatm增加到650μatm, 并没有提高珊瑚的光合效率。并且, 若珊瑚长期处于这种环境, 其光合作用也将受到严重的抑制。
本研究发现,CO2增加引起的两种效应——酸化作用与施肥效应, 相互影响、竞争, 同时对珊瑚光合作用起作用。当CO2较低时, pH降低引起的酸化作用强于CO2的施肥效应, 表现在450μatm时,的v/m和NPQ的变化都与pH呈显著的正相关关系(表4), pH的控制作用较明显。而当CO2逐渐增加时, 施肥效应渐渐明显, 表现在650、750μatm时,v/m和NPQ的变化受pH影响减小, 或不受其明显影响。的v/m与CO2的相关性随CO2的增加而改变(表4), 在450μatm处理组中v/m与CO2呈负相关, 而到了750μatm处理组却转变为正相关关系, 说明施肥效应在高浓度时强于酸化作用, 而作用于虫黄藻的光合效率。类似地, 其和rETRmax也是在750μatm才显现出与CO2显著的正相关关系。CO2增加对的影响主要在高浓度体现出来, 650μatm时所有荧光参数的日均值都与pH有显著的正相关关系, 而当CO2增加到750μatm时,PSII、v/m、P和NPQ与pH的正相关更显著, 同时这几个参数与CO2的负相关性明显, 但、rETRmax和k这三个与电子传递链相关的参数在此时有着截然相反的相关性, 同时rETRmax随着CO2的增加而加快(表4), 表明高浓度的CO2刺激了电子传递链的效率, 但同时抑制了光合量子的产量及光合效率, 说明此时酸化作用与施肥效应共同作用于。
综上可见,CO2增加引起的酸化对珊瑚的效应不如明显, 仅rETRmax和k有较明显的下降趋势, 说明酸化作用主要影响其电子传递过程。在这种效应下,的光合速率在较低辐射下就能达到饱和状态, 若辐射进一步增加, 则更易受到光损伤。本研究中, 其PSII明显下降, 表明电子传递速率的降低已影响到光合效率。并且随CO2增加, 其NPQ的水平越高, 这种光保护机制的激发并不是由光辐射增加引起的, 而是酸化作用使对辐射的耐受性降低, 以至于在正常光照下就会发生抑制现象; 同时也可看出的光保护机制并未受到酸化作用的破坏。
表4 荧光参数与pH、CO2相关性分析

Tab.4 Correlation between fluorescence parameters and pH or pCO2
+: 正相关;-: 负相关; *: 平均值
早在1992年, Raven(1993)就提出珊瑚细胞中存在一种类似藻类的CO2浓缩机制, 它可以有效的吸收和富集HCO3-来维持共生藻的光合作用。这种机制间接地控制了生物体内的pH和CO2流量, 因此外部环境中pH和CO2的下降对其影响并不像人们想像的那么严重(Giordano, 2005; Royal Society, 2005)。但同时,CO2增加还会直接影响细胞和组织的pH和缓冲能力(Pelejero, 2010), 继而影响酶活性、蛋白质结构和离子输送等过程, 特别是新陈代谢速率较快生物的氧气输送过程, 导致组织发生“酸中毒”, 使可利用的能量减少, 降低了蛋白质合成和呼吸活动(Pörtner, 2008)。目前, 鲜少有人对造礁珊瑚及其共生藻在酸化胁迫后的恢复力进行过研究。同高温胁迫对造礁珊瑚的影响类似, 可以想象, 当海水中的CO2恢复到目前的水平, 只要有足够的时间并且未受到环境胁迫, 造礁珊瑚可以从周围环境中获取正常的共生藻, 以重新建立起珊瑚-藻共生体系, 还可能通过新陈代谢进行自身的修复。但可惜的是, 海洋酸化这一进程是不可逆的。
3.2 珊瑚对海洋酸化响应的种间差异
本研究发现CO2增加对三种珊瑚的影响程度有明显差异。共生藻的光合作用在酸化作用下受到了严重抑制, 光合系统受到损害, 使共生体对辐射的耐受性降低。的光合效率则未受到明显抑制, 仅电子传递链受到了破坏。而的电子传递链虽然在高浓度下受到了施肥效应的明显刺激作用, 但同时其光合产量与效率不断受到酸化作用的抑制。Hii等人(2010)曾将两种珊瑚置于pH为7.90和8.19的环境中, 也发现酸化对不同的珊瑚效应有所差异,在酸化条件下呼吸速率、光合速率、虫黄藻密度和细胞有丝分裂指数都会明显降低, 而的净光合速率无变化, 总光合速率增加。他们认为两种珊瑚组织的厚度差异是造成这种结果的主要原因。本研究中的珊瑚与其类似,和的组织层要明显厚于, 因此宿主如此厚的组织层对其下面的虫黄藻起到保护作用, 使其远离胁迫环境。Krief等人(2010)认为珊瑚在胁迫环境下, 由于能量有限, 更愿意将有限的能量应用于耗能少的代谢过程。而钙化作用需要Ca2+-ATP合成酶将质子转移到钙化层外来换取Ca2+, 需要耗费大量的能量, 所以宿主将原用于骨骼生长的能量部分转移到了增加组织生物量上。与此类似, CO2浓缩机制需要用H+-ATP合成酶和碳酸脱水酶将海水中的HCO3-脱水成CO2, 这一高能耗过程在酸化胁迫时被珊瑚搁置于次要位置。同时, 珊瑚组织厚度的增加间接地增加了缓冲层的厚度, 从而降低了外界胁迫对共生藻的威胁水平。
对珊瑚的白化研究发现, 枝状珊瑚一般比块状珊瑚更易白化, 如2003年夏威夷群岛白化的珊瑚主要是蔷薇珊瑚属()和杯形珊瑚属(), 而块状滨珊瑚()白化的很少(Aeby, 2003)。李淑等人(2008)进行的高温胁迫实验表明, 在同样的胁迫环境下(32°C, 72h), 枝状的鹿角和杯形珊瑚共生藻平均损失了60.7%, 而叶片状的却只损失了14.9%。时翔等(2008)在探索磷酸盐胁迫对珊瑚的影响时发现, 与相比,在胁迫后受到的抑制程度较小、恢复时间较短且恢复程度更高。可见, 即使是同一属的珊瑚其对胁迫的抵抗力也有所差异, 因此不同的珊瑚种对环境胁迫的抵抗程度不同。
4 结论
本研究采用叶绿素荧光技术, 通过模拟海南岛三亚鹿回头珊瑚礁海域状况, 建立了实验室模型, 通过不同CO2浓度海水环境下的珊瑚生长实验, 开展了CO2浓度升高及其导致的海水酸化对造礁石珊瑚虫黄藻光合效率的影响研究。主要结论如下:
(1) 水体CO2为650μatm时, 珊瑚的总体光合效率(PSII、v/m和)都高于水体CO2为450μatm和750μatm时的水平。实验期间各参数的具体变化表明, 即使在各荧光参数的平均值都相对较高的650μatm组, 随着胁迫时间的延长, 珊瑚的荧光参数都会呈现不同程度的下降趋势。
(2) 研究发现, 珊瑚对CO2增加引起的海洋酸化的响应呈现较明显的种间差异。其中在实验环境中仅PSII、rETRmax和k出现明显下降, 说明CO2上升仅对电子传递链有抑制作用。而和的光量子产量(PSII和v/m)和有显著降低, 说明CO2的增加已经影响到了这两种珊瑚的光合系统。
(3) 实验过程中,CO2增加引起的酸化作用与施肥效应此消彼长, 共同作用于珊瑚。水体CO2为450μatm时,共生藻的PSII、v/m和的下降幅度都要高于750μatm, 而且450μatm组的v/m和NPQ与pH均呈明显的正相关。随着CO2的增加, 这几个参数与pH的相关关系逐渐减弱, 当上升到750μatm时,的v/m、和rETRmax的变化与CO2有均显著的正相关关系, 而与pH变化无关。特别是共生藻的光合作用在高浓度时同时显现出两种截然相反的相关关系。这说明CO2浓度较低时, 酸化作用强于CO2的施肥效应, 主导着珊瑚共生藻的变化, 而随着CO2增加, 施肥效应越加明显, 与酸化作用竞争, 共同对珊瑚起作用, 使得参数在实验过程不断的波动。
严宏强, 余克服, 施祺等, 2011. 南海珊瑚礁夏季是大气CO2的源. 科学通报, 56(6): 414—422
李淑, 余克服, 施祺等, 2008. 海南岛鹿回头石珊瑚对高温响应行为的实验研究. 热带地理, 28(6): 534—539
时翔, 谭烨辉, 黄良民等, 2008. 磷酸盐胁迫对造礁石珊瑚共生虫黄藻光合作用的影响. 生态学报, 28(6): 2581—2586
赵美霞, 余克服, 张乔民等, 2009. 近50a来三亚鹿回头石珊瑚物种多样性的演变特征及其环境意义. 海洋环境科学, 28(2): 125—130
Aeby G S, Kenyon J C, Maragos J E, 2003. First record of mass coral bleaching in the Northwestern Hawaiian Islands. Coral Reefs, 22(3): 256
Albright R, Mason B, Miller M, 2010. Ocean acidification compromises recruitment success of the threatened Caribbean coral. Proceedings of the National Academy of Sciences of the United States of America, 107(47): 20400—20404
Burris J E, Porter J W, Laing W A, 1983. Effects of carbon dioxide concentration on coral photosynthesis. Marine Biology, 75(2): 113—116
Caldeira K, Wickett M E, 2003. Anthropogenic carbon and ocean pH. Nature, 425(6956): 365
Chalker B E, Taylor D L, 1975. Light-enhanced calcification, and the role of oxidative phosphorylation in calcification of the coral. Proceedings of the Royal Society of London Series B: Biological Sciences, 190(1100): 323—331
Cohen A L, McConnaughey T A, 2003. Geochemical perspectives on coral mineralization. Reviews in Mineralogy and Geochemistry, 54(1): 151—187
Dickson A G, Millero F J, 1987. A comparison of the equilibrium constants for the dissociation of carbonic acid in seawater media. Deep Sea Research Part A, Oceanographic Research Papers, 34(10): 1733—1743
Elderfield H, 2002. Climate change: carbonate mysteries. Science, 296(5573): 1618—1621
Feely R, Sabine C, Lee K, 2004. Impact of anthropogenic CO2on the CaCO3system in the oceans. Science, 305(5682): 362—366
Feely R A, Orr J, Fabry V J, 2009. Present and future changes in seawater chemistry due to ocean acidification. In: McPherson B J, Sundquist E T eds. Carbon Sequestration and Its Role in the Global Carbon Cycle. American Geophysical Union, Washington D C, US: 175—188
Gattuso J P, Buddemeier R W, 2000. Ocean biogeochemistry: calcification and CO2. Nature, 407(6802): 311—313
Gattuso J, Pichon M, Delesalle B, 1993. Community metabolism and air-sea CO2fluxes in a coral reef ecosystem (Moorea, French Polynesia). Marine Ecology Progress Series, 96: 259—267
Giordano M, Beardall J, Raven J A, 2005. CO2concentrating mechanisms in algae: Mechanisms, environmental modulation, and evolution. Annual Review of Plant Biology, 56(1): 99— 131
Goiran C, Al-Moghrabi S, Allemand D, 1996. Inorganic carbon uptake for photosynthesis by the symbiotic coral/ dinoflagellate association I. Photosynthetic performances of symbionts and dependence on sea water bicarbonate. Journal of Experimental Marine Biology and Ecology, 199(2): 207— 225
Herfort L, Thake B, Taubner I, 2008. Bicarbonate stimulation of calcification and photosynthesis in two hermatypic corals. Journal of Phycology, 44(1): 91—98
Hii Y S, Ambok Bolong A M, Yang T T, 2010. Effect of elevated carbon dioxide on two scleractinian corals:(Dana, 1846) and(Linnaeus, 1767). Journal of Marine Biology, 2009: 215196
Holcomb M, Cohen A L, McCorkle D C, 2012. An investigation of the calcification response of the scleractinian coralto elevatedCO2and the effects of nutrients, zooxanthellae and gender. Biogeosciences, 9(1): 29—39
Holcomb M, McCorkle D C, Cohen A L, 2010. Long-term effects of nutrient and CO2enrichment on the temperate coral(Ellis and Solander, 1786). Journal of Experimental Marine Biology and Ecology, 386(1—2): 27—33
The Intergovernmental Panel on Climate Change (IPCC), 2007. Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Forth Assessment Report of the IPCC. Cambridge University Press, New York, US: 989
Jiang C, Rojas A, Wang R, 2005. CO2central chemosensitivity: why are there so many sensing molecules? Respiratory Physiology & Neurobiology, 145(2–3): 115—126
Kawaguti S, Sakumoto D, 1948. The effects of light on the calcium deposition of corals. Bulletin of Oceanography Institution of Taiwan, 4: 65—70
Kleypas J, Langdon C, 2002. Overview of CO2-induced changes in seawater chemistry. In: Moosa M K, Soemodihardjo S, Soegiarto Aeds. Proceedings of the Ninth International Coral Reef Symposium. Vol.2. Ministry of Environment, Jakarta, Indonesia: 1085—1089
Kleypas J A, Langdon C, 2006. Coral reefs and changing seawater carbonate chemistry. In: Phinney J T, Hoegh-Guldberg O, Kleypas Jeds. Coral Reefs and Climate Change: Science and Management. American Geophysical Union, Washington D C, US: 73—110
Krief S, Hendy E J, Fine M, 2010. Physiological and isotopic responses of scleractinian corals to ocean acidification. Geochimica et Cosmochimica Acta, 74: 4988—5001
Langdon C, Atkinson M J, 2005. Effect of elevatedCO2on photosynthesis and calcification of corals and interactions with seasonal change in temperature/irradiance and nutrient enrichment. Journal of Geophysical Research, 110(C9): C09S07
Langdon C, Takahashi T, Sweeney C, 2000. Effect of calcium carbonate saturation state on the calcification rate of an experimental coral reef. Global Biogeochemical Cycles, 14(2): 639—654
Leclercq N, Gattuso J P, Jaubert J, 2002. Primary production, respiration, and calcification of a coral reef mesocosm under increased CO2partial pressure. Limnology and Oceanography, 47(2): 558—564
Leder J J, Szmant A M, Swart P K, 1991. The effect of prolonged “bleaching” on skeletal banding and stable isotopic composition in. Coral Reefs, 10(1): 19—27
Marubini F, Atkinson M J, 1999. Effects of lowered pH and elevated nitrate on coral calcification. Marine Ecology Progress Series, 188: 117—121
Marubini F, Ferrier-Pagès C, Furla P, 2008. Coral calcification responds to seawater acidification: a working hypothesis towards a physiological mechanism. Coral Reefs, 27(3): 491—499
Mehrbach C, Culberson C H, Hawley J E, 1973. Measurement of the apparent dissociation constants of carbonic acid in seawater at atmospheric pressure. Limnology and Oceanography, 18(6): 897—907
Orr J, Fabry V, Aumont O, 2005. Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms. Nature, 437(7059): 681—686
Pörtner H O, 2008. Ecosystem effects of ocean acidification in times of ocean warming: a physiologist's view. Marine Ecology Progress Series, 373: 203—217
Pelejero C, Calvo E, Hoegh-Guldberg O, 2010. Paleo-perspectives on ocean acidification. Trends in Ecology and Evolution, 25(6): 332—344
Petit J R, Jouzel J, Raynaud D, 1999. Climate and atmospheric history of the past 420000 years from the Vostok ice core, Antarctica. Nature, 399(6735): 429—436
Pierrot D, Lewis D E, Wallace D W R, 2006. MS excel program developed for CO2system calculations. ORNL/CDIAC-105a. Carbon Dioxide Information Analysis Center, Oak Ridge National Laboratory, U S Department of Energy. Oak Ridge, Tennessee, US.
Raven J A, 1993. Energy and nutrient acquisition by autotrophic symbioses and their asymbiotic ancestors. Symbiosis, 14(1—3): 33—60
Reynaud S, Leclercq N, Romaine-Lioud S, 2003. Interacting effects of CO2partial pressure and temperature on photosynthesis and calcification in a scleractinian coral. Global Change Biology, 9(11): 1660—1668
Rodolfo-Metalpa R, Martin S, Ferrier-Pagès C, 2010. Response of the temperate coralto mid-and long-term exposure toCO2and temperature levels projected for the year 2100 AD. Biogeosciences, 7: 289— 300
Royal Society, 2005. Ocean acidification due to increasing atmospheric carbon dioxide. The Royal Society, London, UK: 51
Weis V M, 1993. Effect of dissolved inorganic carbon concentration on the photosynthesis of the symbiotic sea anemoneCarlgren: Role of carbonic anhydrase. Journal of Experimental Marine Biology and Ecology, 174(2): 209—225
EXPERIMENTAL STUDY ON THE IMPACT OF OCEAN ACIDIFICATION ON PHOTOSYNTHESIS EFFICIENCY IN SYMBIOTIC ZOOXANTHELLAE OF CORALS
ZHOU Jie1, 2, YU Ke-Fu1, SHI Qi1
(1. South China Institute of Oceanology, CAS, Guangzhou 510301, China; 2. Hainan Tropical Marine Biology Research Station, CAS, Sanya 572000, China)
Ocean acidification as a phenomenon of lowering pH in the ocean is believed caused by the increase in concentration of CO2at atmosphere, and it has become a global concern on the environmental threat in recent year. Ocean acidification has already threatened coral reefs and calcifying organisms. Indicated by latest forecast models and field data, the consequences caused by ocean acidification may be much more severe than forecast previously. The objectives of this short-term study are to investigate the viability of three ecologically important reef-building coral species,,,and. Corals were exposed to highCO2conditions, during which changes in physiological parameters were monitored. Fragments of corals were kept for 10 days under controlled aquarium conditions characterized by elevatedCO2conditions, i.e.CO2values at 450, 650, and 750 μatm. Fluorescence spectra show that the gross photosynthetic efficiency was highest at 650 μatm ofCO2in seawater. During 10-day experiments, with the time lasting in the acidified seawater, parameters of fluorescence presented a tendency of decrease in diverse degrees, although the responses of the three corals are not consistent with each other. WhenCO2was low, acidification that controlled the changes of zooxanthellae was stronger than fertilization induced by increasing CO2. As theCO2increases, the fertilization became apparent, coral assemblage started to fight against acidification for survival, leading to the variations of fluorescence parameters.
ocean acidification;CO2; scleractinian coral; photosynthetic efficiency; acidification effect; fertilization effect
10.11693/hyhz20121221001
* 国家重大科学研究计划课题, 2013CB956102号; 国家自然科学基金项目, 40830852号, 41025007号, 41272199号。
周洁, 博士研究生, E-mail: zhoujielyg@sina.com
2012-12-21,
2013-01-31
P734

