仔猪感染猪轮状病毒的鉴定及基因分析
苏 雪 ,侯怡轩,王 康,虞凌雪,程 群,谢 春,姜一峰,杨志彪,李云章,童光志,周艳君
(1.内蒙古农业大学兽医学院,呼和浩特 010018;2.中国农业科学院上海兽医研究所,上海 200241;3.上海交通大学农业与生物学院,上海 200240)
仔猪感染猪轮状病毒的鉴定及基因分析
苏 雪1,2,3,侯怡轩2,3,王 康2,虞凌雪2,程 群2,谢 春3,姜一峰2,杨志彪3,李云章1,童光志2,周艳君2
(1.内蒙古农业大学兽医学院,呼和浩特 010018;2.中国农业科学院上海兽医研究所,上海 200241;3.上海交通大学农业与生物学院,上海 200240)
为弄清2013年年初上海某猪场发生的仔猪腹泻疫情病因,本研究随机采集发病猪场的仔猪腹泻样品9份,利用RT-PCR方法对采集样品进行病原检测。结果显示,9份临床样品中有4份为猪轮状病毒阳性,而猪流行性腹泻病毒和猪传染性胃肠炎病毒均为阴性。根据GenBank公布的猪轮状病毒参考株序列设计两对引物,对其中阳性样品的VP6和VP7基因进行RT-PCR扩增、基因克隆和序列测定分析。结果显示,4份阳性样品的VP6基因大小为1356 bp,VP7基因大小为1100 bp;序列分析结果显示,VP6基因与A群代表株OSU的氨基酸同源性为64.1%~87.0%,与代表株Gottfriend的氨基酸同源性为26.3%~60.8%;VP7基因与不同G型代表株的氨基酸同源性为71.8%~97.3%。根据上述结果分析,我们推测引起此次仔猪腹泻疫情中的主要病原是由属于A群G9血清型的猪轮状病毒引起,本研究为此次仔猪腹泻疫情的诊断提供了依据。
猪轮状病毒;VP6基因;VP7基因;序列分析
仔猪腹泻病是近年来猪场较为严重的传染性疾病,常发生于冬、春季节,该病发病病程较短,传播较快、死亡率较高,曾一度给养猪业造成了巨大的经济损失。轮状病毒(Rotavirus,RV)是一种可引起婴幼儿和幼龄动物发生急性腹泻的人畜共患传染性病毒。1968年Mebus等首次从犊牛粪便中分离获得牛轮状病毒,1973年Bishop等从腹泻患者体内发现了人感染的轮状病毒,1974年Woode等从感染猪体内分离到猪轮状病毒(Porcine Rotavirus,PoRV)[1]。此外人们在鸡等多种禽类也发现有轮状病毒的感染,可见该病毒的传播不仅给畜禽等养殖业带来了严重威胁,同时也危害着人类的健康[2]。
轮状病毒在猪群中的感染率较高,低日龄的仔猪感染轮状病毒后主要表现为腹泻、呕吐、脱水、消瘦、生长缓慢和死亡等。其病原PoRV属于呼肠孤病毒科、轮状病毒属,病毒粒子呈球形、无囊膜,基因组大小为18 kb,由11个分节段双链RNA组成。这些RNA共编码6种结构蛋白(VP1、VP2、VP3、VP4、VP6、VP7)和5种非结构蛋白(NS53、NS35、NS34、NS28、NS26)[3]。其中结构蛋白VP6基因编码病毒的内衣壳蛋白,在病毒复制过程中起重要作用,由于其基因高度保守,因此可以作为病毒的诊断靶抗原[4]。基于VP6结构蛋白的抗原性不同,分为 A~G 7个群以及两个亚群(I、II),其中A、B、C和E群可感染猪。VP7基因编码病毒的外衣壳蛋白[5],属于糖基化蛋白,也是病毒的主要中和抗原[6],与抗病毒免疫保护紧密相关。轮状病毒基因型呈现多样性,其中外壳蛋VP7决定G基因型,研究证实轮状病毒不同血清型间具有不完全的免疫交叉保护性[7]。
近几年在我国国内部分猪场爆发了仔猪腹泻疫情,一些检测普遍认为猪流行性腹泻病毒感染的阳性率较高[8],同时不排除有其他病原感染,2013年年初,在上海某猪场也发生了仔猪腹泻疫情,为了弄清该猪场此次疫情的病因,本研究采集了该猪场的仔猪腹泻临床样品,对可能感染的病原进行了检测和分析,为发病猪场对腹泻疫情的防治提供可靠依据。
1 材料和方法
1.1 病毒及样品来源猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)和猪轮状病毒(PoRV)由中国农业科学院上海兽医研究所猪传染病研究室提供,9份小肠及内容物样品采集自上海某个发生仔猪腹泻疫情猪场中发病死亡的仔猪。
1.2 主要试剂QIAGEN RNeasy Mini Kit 试剂盒、TaKaRa 快速反转录试剂盒、LATaqDNA 聚合酶、pMD18-T 载体、DL2000 购自TaKaRa生物公司;DH 5α菌株购自天根生化科技公司; OMEGA Gel Extraction 试剂盒。
1.3 样品处理将小肠内容物用PBS重悬,混匀后反复冻融3次,5900×g离心10 min,取上清于-80℃保存;按照RNA提取试剂盒RNeasy Plus Mini Kit试剂盒说明书操作,提取9份小肠内容物样品的RNA,RNA按照单链cDNA合成试剂盒RevertAidTMFirst Strand cDNA Synthesis Kit说明书反转录合成cDNA。
1.4 样品PCR鉴定以上述合成的cDNA为模板,利用本实验室设计合成的PEDV、TGEV和PoRV三对特异性鉴定引物(PJD1/PJD2:5'-CACTGTTTAAAGCGTCT-3'/5'-CTCAAAA| GTGATGTAAT-3';TN1/TN2:5'-AGTCGTG GTGCTAATAATG-3'/5'-GACCTTTCTGCAGAT TTAG-3';PP1/PP2:5'-ATGATAGTTACTATG AATG-3'/5' AGCACAGATTCACAA ACTG-3'),进行RT-PCR扩增,获得的PCR产物经1%琼脂糖凝胶电泳观察。
1.5 VP6、VP7基因引物设计根据GenBank中登录的PoRV参考株序列(GenBank登录号:AY538664.1),利用Primer 5.0软件设计引物。引物序列见表1。
1.6 VP6、VP7基因扩增选取上述样品中PoRV阳性样品分别利用VP6-U/VP6-L与VP7-U/VP7-L两对引物进行PCR扩增,反应条件:95℃预变性5 min;94℃变性30 s,50℃退火30 s,72℃延伸1.5 min,35个循环;72℃再延伸10 min。PCR产物经回收纯化后与pMD18-T载体连接,转化到E.coliDH5α感受态细胞中,培养后挑取单个菌落,进行PCR鉴定,阳性克隆由上海生物工程(上海)股份有限公司进行测序。
1.7 VP6、VP7序列分析利用DNAStar 和MEGA 5.0软件,对测得的VP6、VP7基因序列进行分析,并构建系统进化树,参考序列见表2。

表1 猪轮状病毒 VP6、VP7基因扩增引物Table 1 The primers of PoRV VP6,VP7 gene

表2 PoRV 基因序列比较的参考序列Table 2 The reference strains of PoRV gene
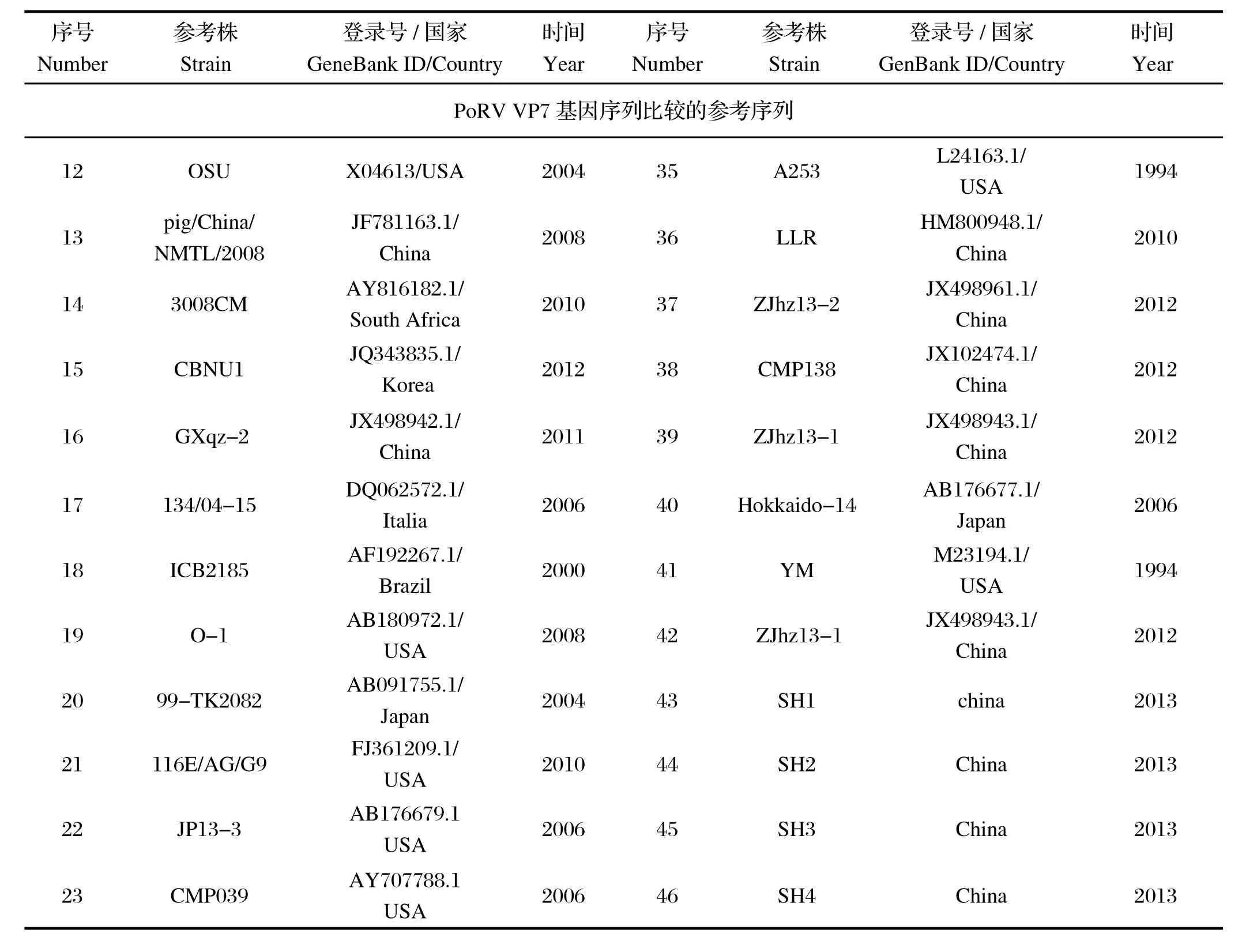
(续上表)
2 结果

图1 PoRV PCR 检测结果Fig.1 Results of RT-PCR amplif cation for PoRV
2.1 RT-PCR鉴定结果利用实验室已有的PEDV、TGEV和PoRV特异性鉴定引物对9份临床样品进行PCR鉴定,结果显示9份临床样品中有4份为PoRV阳性(图1),而TGEV、PEDV结果为阴性(图略)。
2.2 VP6、VP7基因的RT-PCR扩增对4份阳性临床样品VP6和VP7基因进行扩增,经琼脂糖凝胶电泳,结果显示,VP6基因可扩增出大小约1300 bp的条带(图2),VP7基因可扩增出大小约1100 bp的条带(图3),与预期片段大小相一致。
2.3 VP6基因的序列分析将SH1、SH2、SH3和SH4四个阳性样品的VP6基因测序,结果显示,4株样品的VP6基因全长1300 bp,编码397个氨基酸。4份样品的VP6基因与10株PoRV参考株的氨基酸同源性分别为79.1%~97.6%,其中与A群代表株OSU(AF317123.1)的氨基酸同源性为54.1%~67.0%,与代表株Gottfriend(登录号:D00326.1)的氨基酸同源性为26.3%~60.8%,进化树分析显示本研究获得的4个样品与OSU(AF317123.1)亲缘关系较近,同属于A群中的I亚群(图4)。
2.4 VP7基因序列分析将本研究获得的4个阳性样品VP7基因测序,结果显示,4株样品的VP7基因为1100 bp,编码326个氨基酸。本研究获得的VP7基因与G9基因型参考株氨基酸同源性为87.5%~97.1%,与G5基因型参考株氨基酸同源性为74.2%~78.4%,进化树分析显示本研究获得4份临床样品同属于G9血清型(图5)。
3 讨论
猪轮状病毒是引起仔猪腹泻的主要病原之一,其临床表现常与猪流行性腹泻、猪传染性胃肠炎难以区分,PoRV感染后可使仔猪免疫力降低,诱发多种病原混合感染,导致仔猪生长停滞或死亡率上升。VP6是PoRV重要的群抗原,在病毒上与VP4、VP7紧密相连,构成病毒的框架[9]。VP7是病毒的主要免疫保护性抗原,能刺激机体产生中和抗体,决定病毒的G血清型,而且相同血清型的不同毒株之间VP7是高度保守的,但在不同血清型之间变化较大[10]。
近年来仔猪腹泻疫情在我国流行较为频繁,曾一度给养猪业造成了重大损失,引起了人们的广泛关注。已有相关研究表明近期发生的仔猪腹泻疫情主要是以猪流行性腹泻病毒感染为主[11,12],当然也有一些其他病原感染的报道如博卡病毒等[13]。2013年初上海某猪场发生了新生仔猪腹泻疫情,该猪场发病前未使用过如PEDV-TGEV二联灭活疫苗等与腹泻相关的疫苗,发病的新生仔猪主要表现为腹泻、脱水、厌食、消瘦和死亡等,此次疫情传播能力较强,同产房新生仔猪发病率和死亡率都超过了50%。本研究中我们从该发病猪场随机采集部分临床样品进行病原检测,结果显示PEDV、TGEV两种主要腹泻病原均为阴性,而样品中有4份临床样品呈PoRV阳性,据此我们推测PoRV可能是此次该猪场发病过程中不容忽视的重要病原。
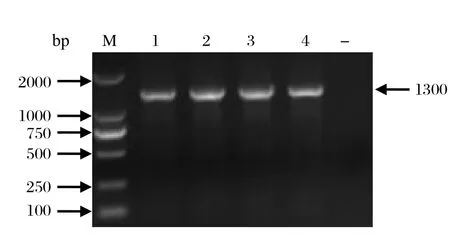
图2 PoRV VP6 基因PCR扩增结果Fig.2 RT-PCR for VP6 gene from PoRV
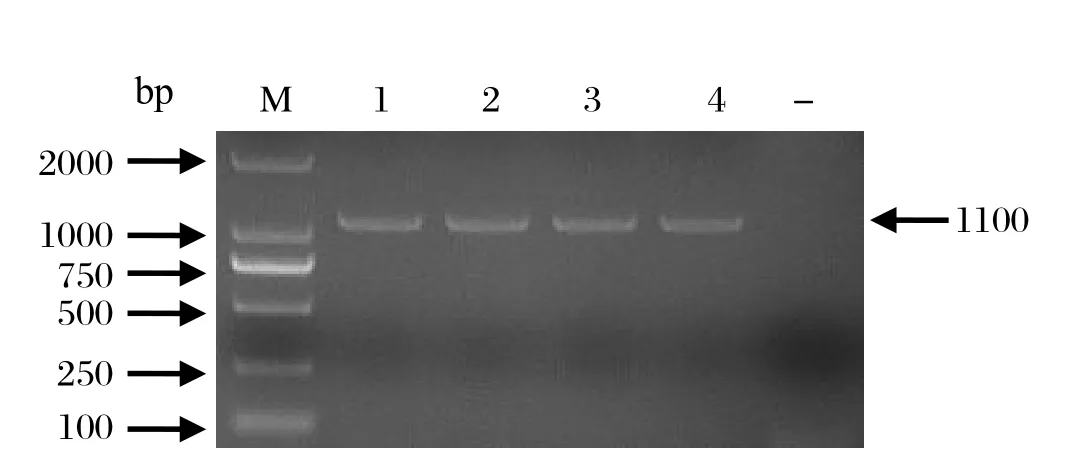
图3 PoRV VP7 基因PCR扩增结果Fig.3 RT-PCR for VP7 gene from PoRV
我们对本研究中获得的4株病毒VP6基因进行序列分析,结果显示,4个流行毒的VP6基因与典型的A群轮状病毒OSU株属于同一分支,且与LL3354株亲缘关系较近,二者间氨基酸同源性为88.5%~97.7%。LL3354株是A群人轮状病毒的流行代表株,是否本次流行的PoRV与人源轮状病毒存在相关性还需要进一步研究。对4份临床样品的VP7基因进行序列分析,结果显示,本研究获得的SH1、SH2、SH3和SH4和近几年在我国国内分离得到的毒株ZJhz13-1、GXqz-2等同属于G9基因型,氨基酸同源性为88.7%~97.3%,而与另一分支G5基因型代表株的氨基酸同源性则较低。根据上述分析结果我们初步证实本次流行的PoRV A群轮状病毒G9基因型。RV是一种常见的人畜共患病,近年来随着猪群中仔猪腹泻疫情的不断发生,在对一些PEDV等重要病原关注的同时,本研究结果提示我们猪轮状病毒感染是不容忽视的,只有及时准确的鉴别诊断仔猪腹泻疫情的病因,才能对仔猪腹泻疫情进行有效预防和控制。
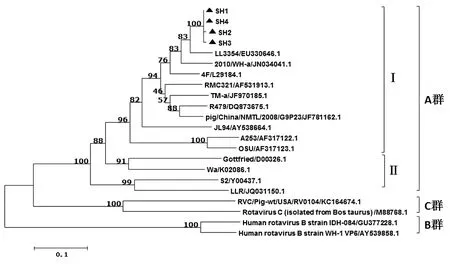
图4 猪轮状病毒VP6 基因进化树分析(▲代表本研究获得样品序列)Fig.4 Phylogenetic tree of VP6 gene fragment of Porcine rotavirus (▲:Samples in this study)
[1] Estes M K, Cohen J. Rotavirus gene structure and function [J]. Microbiol Rev, 1989, 53(4)∶ 410-449.
[2] Matthijnssens J, Ciarlet M, Heiman E,et al. Full genomebased classification of rotaviruses reveals a common origin between human Wa-like and porcine rotavirus strains and human DS-1-like and bovine rotavirus strains[J]. J Virol, 2008, 82(7)∶ 3204-3219.
[3] Burke B, McCrae M A, Desselberger U,et al. Sequence analysis of two porcine rotaviruses differing in growth in vitro and in pathogenicity∶ distinct VP4 sequences and conservation of NS53, VP6 and VP7 genes[J].Virology, 1994, 75∶ 2205-2212.
[4] Mukherjee A, Dutta D, Ghosh S,et al. Full genomic analysis of a human group A rotavirus G9P strain from Eastern India provides for porcine-to-human interspecies transmission [J]. Arch Virol, 2009, 154(5)∶ 733-746.
[5] Santos N, Volotao E M, Soares C C,et al. Predominance of rotavirus genotype G9 during the 1999, 2000, and 2002 seasons among hospitalized children in the city of Salvador, Bahia, Brazil∶ implications for future vaccine strategies [J]. J Clin Microbiol, 2005, 43(8)∶ 4064-4069.
[6] 高秀春, 时洪艳, 佟有恩, 等. A群猪轮状病毒JS株VP6基因序列分析[J]. 黑龙江畜牧兽医, 2007, (7)∶ 27-29.
[7] 汤璘珊, 陈兰举. 轮状病毒结构蛋白的研究进展[J]. 医学综述, 2013, (5)∶ 18-20.
[8] 吴玉璐, 朱建平, 杨莘, 等. 猪流行性腹泻病毒N 基因的表达及抗原性分析[J]. 中国预防兽医学报, 2013, 35(4)∶299-303.
[9] 彭蕊. 中国河北省卢龙地区猪C组轮状病毒分子流行病学检测和特性分析[D]. 长春∶ 吉林大学, 2013.
[10] Kim H H, Park J G, Matthijnssens J,et al. Pathogenicity of porcine G9P[23] and G9P[7] rotaviruses in piglets[J]. Vet Microbiol, 2013, 166(1-2)∶ 123-137.
[11] Zhou Y J, Wu Y L, Zhu J P,et al. Complete genome sequence of a virulent porcine epidemic diarrhea virus strain[J]. J Virol, 2012, 86(24)∶ 13862 .
[12] 吴玉璐, 程群, 虞凌雪, 等. 猪流行性腹泻病毒RT-PCR鉴别诊断方法的建立[J]. 中国农业科学, 2013, 46(20)∶4370-4377.
[13] 翟少伦, 陈胜男, 魏文康. 猪博卡病毒的研究进展[J]. 病毒学报, 2012, (2)∶ 190-193.
GENETIC ANALYSIS OF PORCINE ROTAVIRUS INFECTION IN PIGLETS
SU Xue1,2,3, HOU Yi-xuan2,3, WANG Kang2, YU Ling-xue2, CHENG Qun2, XIE Chun3, JIANG Yi-feng2, YANG Zhi-biao3, LI Yun-zhang1, TONG Guang-zhi2, ZHOU Yan-jun2
(1.College of Veterinary Medicine, Inner Mongolia Agricultural University, Hohhot 010018, China; 2.Shanghai Veterinary Research Institute, CAAS, Shanghai 200241,China; 3. School of Agriculture and Biology, Shanghai Jiao Tong University, Shanghai 200240, China)
Diarrhea outbreaks occurred in piglets in early 2013 in Shanghai. To identify the etiological agents, nine fecal samples were randomly collected from ill animals and tested in RT-PCR for the presence of rotaviruses, Transmissible gastroenteritis virus (TGEV)and Porcine epidmic diarrhea virus (PEDV). Four of 9 samples were rotavirus positive (44.4%). All samples were TGEV or PEDV negative. Based on sequences of VP6 and VP7 of reference strain in GenBank, two pairs of primers were designed for amplifying the target genes. The full-lengths of VP6 and VP7 were 1300 bp and 1100 bp. Sequence alignments showed that VP6 shared 64.1% - 87.0% amino acid homology with OSU strain in group A and 26.3% - 60.8% with Gottfriend strain. As for VP7, homology of amino acid sequences ranged from 71.8% to 97.3% with G type strains. Analysis of PoRV VP7 suggested that it belong to G9 genotype. These results established a reliable basis for prevention and control of piglet diarrhea.
Porcine rotavirus; VP6 gene; VP7 gene; sequence analysis
S852.659.4
A
1674-6422(2014)02-0020-07
2014-01-20
国家生猪现代产业技术体系建设项目(CARS-36)
苏雪,女,硕士研究生,临床兽医学专业
童光志,E-mail:gztong@shvri.ac.cn;周艳君, E-mail:yjzhou@shvri.ac.cn

