固态法发酵白酒中正丙醇产生的机理研究
柏永昊,熊小毛,缪礼鸿 *,陈文静
(1.武汉轻工大学生物与制药工程学院,湖北 武汉 430023;2.湖北白云边酒业股份有限公司,湖北 松滋 434200)
中国传统白酒以谷物为原料,采用大曲或小曲提供糖化力和发酵力,经过浸泡、蒸煮、堆积、发酵和蒸馏等工序制成。其制曲工艺多为敞开式人工制曲,堆积培菌后进入窖池,窖泥微生物参与到发酵过程中来,因而固态法发酵白酒是一个由多种微生物参与的复杂转化过程[1]。研究白酒中的微量组分与微生物之间的关系已成为热点[2]。高级醇作为白酒呈香呈味的物质之一,能衬托酯类的香气,含量太低会导致口味淡薄,但含量太高会引起酒体辛辣苦涩,刺激神经,使人上头易醉[3],因此我国白酒行业对高级醇含量有着严格的限制。正丙醇是高级醇的重要组分之一,在不同香型白酒中差异较大,兼香型白酒行业标准对其含量要求为0.2~1.0g/mL[4]。
固态白酒发酵过程中高级醇的产生机理尚不清楚,因此目前国内的研究主要从改变工艺条件对其加以控制,如改变投粮量、加曲量、加糠量、接种温度等[5-7]。国外学者针对高级醇产生的机理,从细菌、酵母菌等菌种角度展开了研究。JANSSEN P H[8]证实了一株厌氧梭菌(Anaerobic clostridium)能够发酵苏氨酸产生丙酸和正丙醇。CARRAN F M[9]发现在低氮水平下,一株葡萄酒酵母能产生更多高级醇。酵母菌的乙醇脱氢酶(alcohol dehydrogenase,ADH)活性与葡萄酒的高级醇产生量呈正相关[10]。而有关正丙醇的产生机理有2个推论:其一,蛋白质分解机理,即蛋白质分解为氨基酸,氨基酸被酵母菌或细菌利用,苏氨酸脱胺基、脱羧基形成正丙醇;其二,糖的厌氧发酵机理,即氨基酸中间代谢产物α-酮丁酸脱羧、还原生成正丙醇[11]。受蛋白质分解机理的影响,国内白酒行业普遍怀疑正丙醇的产生与堆积料的耐高温细菌有关。细菌是窖泥中的主要微生物,也被广泛关注[12]。本课题组前期的研究已表明芽孢杆菌不是白酒中正丙醇产生的主要因子[13],在此基础上,本研究旨在进一步研究固态法发酵白酒中正丙醇产生的机理,为白酒酿造过程中正丙醇等高级醇产生量的调控提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株来源
根霉(Rhizopus)2-1:分离自“白云边”小曲曲粉;酿酒酵母(Saccharomyces cerevisiae)2-5M:分离自“白云边”小曲出池酒醅。
1.1.2 样品来源
“白云边”大曲二轮入池酒醅、三轮出池上中下层酒醅及混合酒醅、“白云边”小曲曲粉、高粱等均由白云边酒业股份有限公司提供。
1.1.3 培养基
牛肉膏蛋白胨培养基:牛肉膏5g,蛋白胨10g,氯化钠5g,水1 000mL,pH 7.2~7.4。
虎红培养基:北京奥博星生物技术有限责任公司,取35g溶于1 000mL蒸馏水。
酵母浸出粉胨葡萄糖培养基(yeast peptone dextrose medium,YPD)培养基:葡萄糖20g,蛋白胨10g,酵母粉10g,水1 000mL。
1.1.4 试剂
葡萄糖、氯化钠:天津市科密欧化学试剂有限公司。牛肉膏、酵母粉、蛋白胨:英国OXOID公司。
1.2 仪器与设备
ZGP-2050普通生化培养箱:上海智诚分析仪器制造有限公司;Nikon YS100显微镜:广州颐腾贸易有限公司;7890A气相色谱仪:美国安捷伦公司。
1.3 实验方法
1.3.1 酒醅中细菌、酵母菌活菌数的测定方法
称取10g酒醅样品,加入装有90mL无菌水的三角瓶中,170r/min摇床15min后,采用稀释平板法[14]分别涂布于牛肉膏蛋白胨平板及虎红平板上,置于30℃生化培养箱中培养2d,计数,取单菌落划线分离、镜检。
1.3.2 工厂酒醅取样及蒸馏方法
分别取A、B两个班组的“白云边”大曲酒二轮入池酒醅、三轮出池酒醅(上、中、下层)样品各50g用于酒精蒸馏。蒸馏液经过滤后用气相色谱法测定正丙醇含量。
普通蒸馏操作:取50g酒醅,加入150mL蒸馏水,蒸馏取酒样100mL。
取头酒蒸馏操作:取50g酒醅,加入100mL蒸馏水,蒸馏酒样只取前15mL。
1.3.3 实验室同步装瓶发酵方法
现场取工厂已堆积结束、即将入池的酒醅装入750mL的玻璃菌种瓶中,装满后压紧,用8层保鲜袋封口,置于生化培养箱28℃发酵30d,取出酒醅进行蒸馏,过滤后用气相色谱法测定正丙醇含量。
1.3.4 实验室模拟小曲白酒发酵方法
取600g高粱于60~70℃蒸馏水中浸泡24h后取出,放置于蒸锅上层,用纱布垫好,下层加水烧开,蒸粱1h。之后用100℃沸水浸泡焖粱0.5h,复蒸高粱1h,摊晾高粱,使之冷却至30℃。接种小曲曲粉(接种量0.5%)后混匀。39~41℃堆积30h左右。将堆积料装入750mL的玻璃菌种瓶中,装满后压紧,用8层保鲜袋封口,置于生化培养箱28℃培养。发酵6d,取出酒醅蒸馏(普通蒸馏操作,同上),过滤后用气相色谱测定蒸馏液中正丙醇含量及酒精度。
1.3.5 实验室模拟小曲酒固态纯种发酵方法
基本方法同1.3.4,接种时用2%纯种培养的种子液替代小曲曲粉。种子液培养方法:YPD平板活化根霉2-1和酵母菌2-5M,30℃培养36h后,转接到YPD液态培养基中,170r/min摇床培养12h。
1.3.6 蒸馏液中正丙醇及酒精含量的测定方法
蒸馏液中酒精、正丙醇、乙酸乙酯、丁酸乙酯、乳酸乙酯的含量测定均采用气相色谱测定法[15]。
1.3.7 色谱条件
色谱柱:极性柱DB-WAXETR;载气为高纯氮气;流速为25mL/min,分流比为20∶l,氢气流速为30mL/min,空气流速为400mL/min。起始柱温为60℃,保持2min,然后以5℃/min程序升温至80℃。检测器温度:200℃;进样口温度:200℃。
2 结果与分析
2.1 工厂大曲入池和出池酒醅微生物数量测定结果
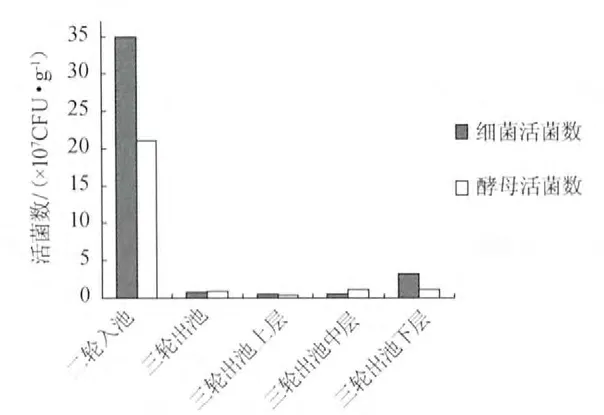
图1 大曲酒酒醅活菌数测定结果Fig.1 The count results of microorganism in Daqu fermented grains
由图1可知,大曲三轮出池酒醅中的细菌和酵母菌与二轮入池相比均大大降低,少量存活下来的为具有一定耐酒精能力的菌株。三轮出池下层酒醅的细菌数和酵母总数均高于中层和上层酒醅菌数,可能是由于下层酒醅含水率相对较高,易于菌体生长。
2.2 工厂大曲酒醅与实验室同步模拟发酵酒醅结果比较
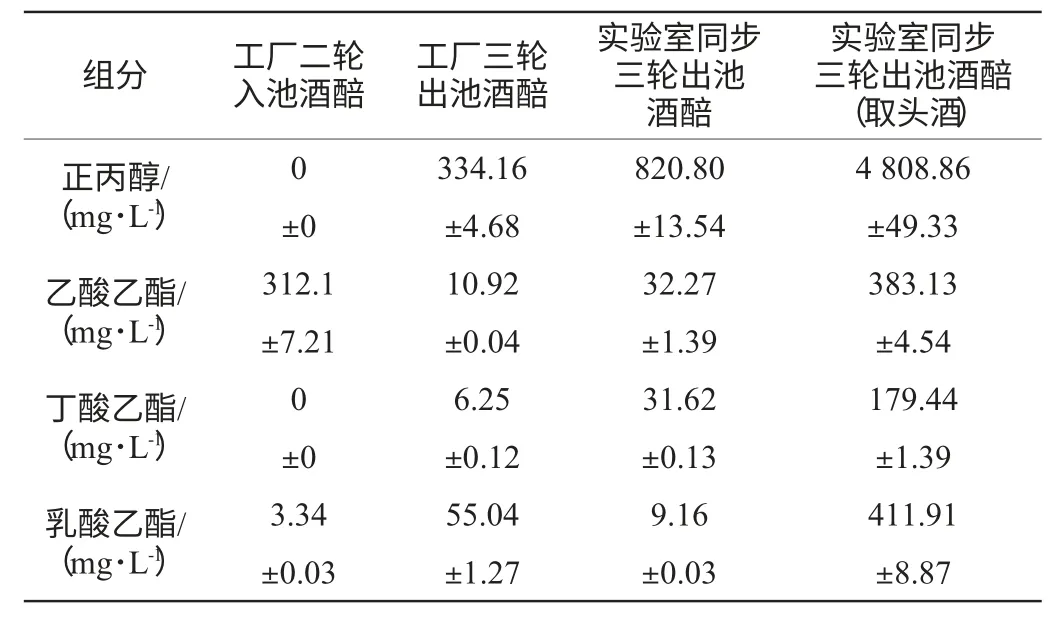
表1 工厂A组大曲酒醅取样蒸馏与实验室同步模拟发酵酒醅结果比较Table 1 Comparison of fermented distilled grains between samples from group A and synchronize simulate fermentation in lab
如表1所示,对比“工厂二轮入池酒醅”与“工厂三轮出池酒醅”,前者正丙醇含量为0,即堆积后没有正丙醇产生,而出池酒醅正丙醇含量为334.16mg/L,这表明正丙醇产生于入池发酵过程中,而不是在堆积过程中。与此相反,堆积后乙酸乙酯含量为312.1mg/L,远高于出池酒醅中的含量10.92mg/L,表明乙酸乙酯主要累积于堆积过程中。对比“工厂三轮出池酒醅”与“实验室同步三轮出池酒醅”,由于后者没有窖泥微生物的参与,但正丙醇含量达820.80mg/L,甚至超过了前者的正丙醇含量334.16mg/L,这表明正丙醇的产生与窖泥微生物无关。其含量过高的原因,推测是由于实验室发酵条件比工厂更稳定,优势菌种更早建立,因此乙酸乙酯、丁酸乙酯、乳酸乙酯的含量也有一定差异性。对比“实验室同步三轮出池酒醅”和其“取头酒”的数据,后者的正丙醇含量大幅增加,表明蒸馏酒样品中正丙醇含量与蒸馏和收集方法直接相关。乙酸乙酯、丁酸乙酯和乳酸乙酯的含量也随取头酒操作而增加。
如表2所示,工厂B组三轮出池的中、下层酒醅正丙醇含量均高于上层,而图1反映了中、下层酒醅中的酵母菌活菌数也高于上层,由此可以看出,随着取样深度的增加,大曲酒醅的正丙醇含量和酵母菌数量呈正相关。与此相反地,下层酒醅的乙酸乙酯、丁酸乙酯和乳酸乙酯的含量却低于上、中层,表明下层酒醅的发酵条件和环境抑制了产酯微生物的代谢,不利于优质白酒的产出。B组的实验室同步三轮出池酒醅正丙醇含量为4 808.86mg/L,同样超过了工厂的三轮出池酒醅,与A组的结果一致。这也表明正丙醇的产生与窖泥微生物无关。但是实验室过于稳定的发酵环境使参与发酵的微生物种类变少,酯类含量与工厂出池酒醅有差异。
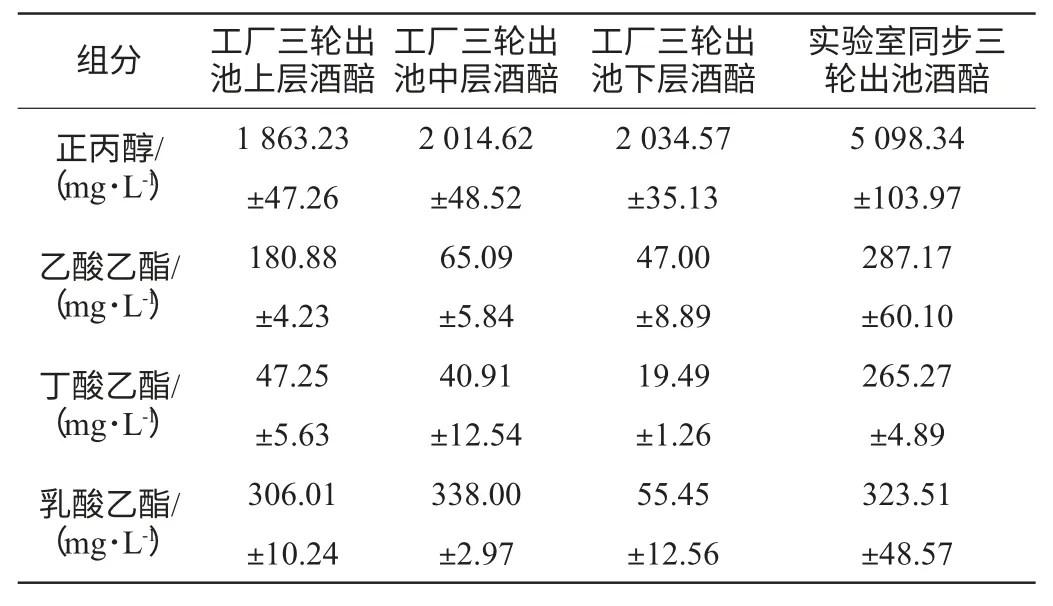
表2 大曲B组工厂取样蒸馏与实验室同步装瓶发酵酒醅结果(取头酒)Table 2 Comparison of fermented distilled grains between samples from group B and synchronize bottle fermentation in lab(the first liquor)
2.3 模拟小曲发酵过程中正丙醇产生时间及微生物数量的变化
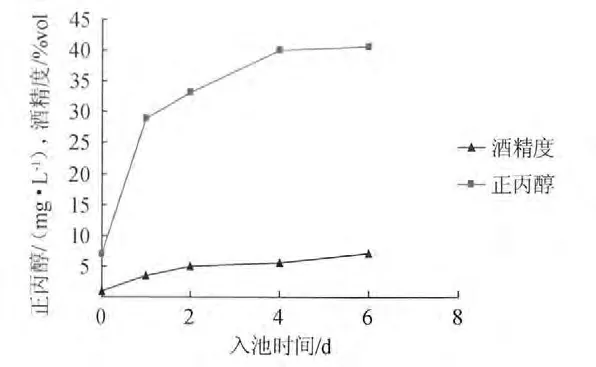
图2 小曲酒模拟发酵过程中正丙醇与酒精度含量的变化Fig.2 The propanol content and alcohol content change during Xiaoqu simulated fermentation
如图2所示,在实验室模拟小曲发酵过程中,堆积结束时正丙醇的含量很低,与工厂堆积料的测定结果相一致,但堆积料在装瓶发酵后的前24h,正丙醇含量激增,24h后增加速度趋于平缓,4d时正丙醇含量几乎达到最大值,4d以后正丙醇含量增加十分缓慢。酒醅中酒精含量随发酵时间延长逐步提高。
如图3所示,装瓶后酒醅中的细菌总活菌数在前24h内急剧下降,2~4d内趋于稳定,4~6d细菌总数进一步降低;而酵母菌总活菌数在前24h内显著增加,2~4d内趋于稳定,4~6d又有明显增加,其变化趋势与细菌恰恰相反。由此可以看出,酵母菌数量和正丙醇含量在实验室模拟小曲发酵过程中也是呈正相关的。因此可以推测固态法发酵白酒,无论是大曲酒还是小曲酒,正丙醇的含量与入池酒醅的酵母菌生态群落结构有关。
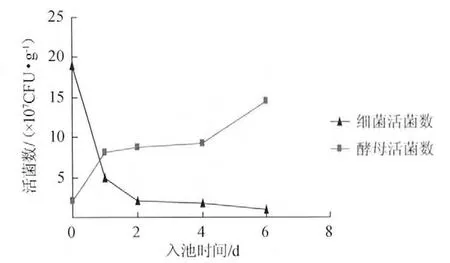
图3 小曲酒模拟发酵过程中细菌总数和酵母总数的变化Fig.3 The total bacterial and yeast amount during Xiaoqu simulated fermentation
2.4 模拟小曲固态纯种发酵结果
如图4、图5所示,以接种小曲曲粉为对照,在整个发酵过程中,实验室纯种(仅接种根霉2-1和酿酒酵母2-5M)模拟小曲发酵的酒精产量与正丙醇产量均与对照组相近。表明酿酒酵母2-5M是模拟小曲发酵过程中正丙醇的主要产生菌株。
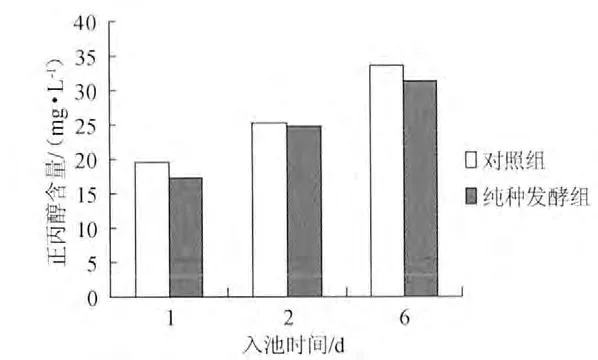
图4 酿酒酵母2-5M纯种模拟小曲发酵中正丙醇含量随时间变化图Fig.4 The time-varying propanol content of Xiaoqu simulated fermentation by pure Saccharomyces cerevisiae 2-5M
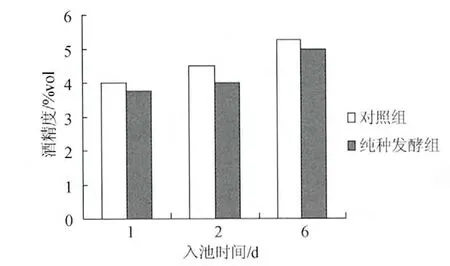
图5 酿酒酵母2-5M纯种模拟小曲发酵中酒精度随时间变化图Fig.5 The time-varying alcoholic content of Xiaoqu simulated fermentation by pure Saccharomyces cerevisiae 2-5M
3 结论
结果表明,酒醅中的酵母菌数量与其正丙醇含量成正相关。以不含窖泥的实验室同步模拟大曲酒醅发酵试验结果表明,固态发酵白酒酒醅中正丙醇的产生不依赖于窖泥微生物的存在。取头酒的实验结果表明蒸馏酒样品中正丙醇含量与蒸馏和收集方式直接相关。
实验室小曲模拟发酵实验结果表明,酒醅发酵过程中酵母菌总数与正丙醇含量成正相关,而与细菌总数成负相关。堆积料在装瓶发酵后24h内正丙醇含量激增,4d时正丙醇含量达到最大值。采用仅含酿酒酵母和根霉的纯种接种剂与含细菌的小曲曲粉进行对比发酵试验表明,两者发酵的酒精度和正丙醇含量均接近。表明酵母菌是白酒中正丙醇的主要产生菌。实验室接种小曲曲粉及纯种发酵结果均表明,酒醅的酒精度与正丙醇含量基本呈正相关。由此可以推断,固态法发酵白酒中正丙醇主要是在酵母菌进行糖的厌氧发酵过程中作为酒精的副产物产生的,而不是细菌对蛋白质分解导致的。
为了控制正丙醇的含量,对于由多种微生物参与的固态法白酒发酵而言,可以首先筛选出入池发酵阶段中的各种优势酵母菌,通过纯种发酵和混合发酵的办法找出产正丙醇高的酵母菌种类。进而研究其代谢条件。在工厂实际生产中,可以采用改变发酵条件抑制此类酵母菌代谢,或是选择产酯高而产正丙醇低的菌株制成强化曲添加到接种环节中,达到控制正丙醇含量、提升酯类香味物质的目的。本研究为提高优质白酒的人工控制水平提供了理论依据,对实际生产具有指导意义。
[1]唐 洁,王海燕,徐 岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学通报,2012(7):921-930.
[2]康文怀,徐 岩.中国白酒风味分析及其影响机制的研究[J].北京工商大学学报:自然科学版,2012,30(3):53-57.
[3]谢方安.谈白酒香气成分和作用[J].酿酒,2006,33(5):52-55.
[4]董友新,郭成林,熊小毛.影响“白云边”半成品酒正丙醇含量的原因初探[J].酿酒,2002(1):30-31.
[5]罗惠波,苟云凌,叶光斌,等.影响白酒中高级醇生成的工艺条件研究[J].中国酿造,2011,30(8):87-90.
[6]林志国.啤酒中高级醇的控制[J].酿酒科技,2001(2):55-56.
[7]周世水.控制啤酒中高级醇含量的研究[J].酿酒,2005(5):52-53.
[8]JANSSEN P H.Propanol as an end product of threonine fermentation[J].Arch Microbiol,2004,182(6):482-486.
[9]CARRAU F M.Production of fermentation aroma compounds bySaccharomyces cerevisiaewine yeasts:effects of yeast assimilable nitrogen on two model strains[J].FEMS Yeast Res,2008,8(7):1196-2007.
[10]SINGH R,KUNKEE R E.Alcohol dehydrogenase activities of wine yeasts in relation to higher alcohol formation[J].Appl Environ Microb,1976,32(5):666-670.
[11]谢文化.去除正丙醇提高糖蜜酒精质量[J].酿酒科技,2004(3):49-50.
[12]袁先玲,卫春会,黄治国,等.浓香型白酒窖泥中酵母菌的分离鉴定[J].酿酒科技,2012(8):45-49.
[13]柏永昊,张明春,缪礼鸿.芽孢杆菌对白酒发酵过程中正丙醇含量的影响[J].酿酒科技,2013(11):26-29.
[14]赵 斌,何绍江.微生物学实验[M].北京:科学出版社,2002.
[15]谷向春,肖冬光,邹 静,等.气相色谱外标法测定荔枝酒中的风味物质[J].酿酒科技,2006(11):99-103.

