鸦胆子油自微乳化颗粒在大鼠体内生物利用度考察
李 晔, 孙 雯, 蒋 楠, 李彤晖, 龙凯花, 辛永洁, 孙 力
( 1.陕西省中医药研究院, 陕西 西安 710003; 2.陕西中医学院, 陕西 咸阳 712046; 3.郑州大学附属洛阳市中心医院, 河南 洛阳 471000)
鸦胆子油自微乳化颗粒在大鼠体内生物利用度考察
李 晔1, 孙 雯2, 蒋 楠3, 李彤晖1, 龙凯花2, 辛永洁1, 孙 力1
( 1.陕西省中医药研究院, 陕西 西安 710003; 2.陕西中医学院, 陕西 咸阳 712046; 3.郑州大学附属洛阳市中心医院, 河南 洛阳 471000)
目的 研究鸦胆子油自微乳化颗粒在大鼠体内的药代动力学过程及其相对生物利用度。方法 大鼠分别灌服市售鸦胆子油口服乳剂和鸦胆子油自微乳颗粒剂, 于不同时间点取血, HPLC法检测血浆中鸦胆子油的油酸、 亚油酸,采用 DAS2.1.1 版软件求算药动学参数。 结果 大鼠灌服市售鸦胆子油口服乳剂和鸦胆子油自微乳颗粒剂后油酸 AUT为 72.738、 170.334 (h·μg) /mL, 亚油酸为 41.393、 140.759 (h·μg) /mL。 制剂中油酸、 亚油酸相对生物利用度分别达到 234.2%、 340.1%。 结论 与市售鸦胆子油口服乳剂相比, 鸦胆子自微乳化颗粒可明显提高油酸、 亚油酸在大鼠体内的相对生物利用度。
鸦胆子油;固体自微乳化给药系统;体内药代动力学;生物利用度
鸦胆子油的成分复杂, 其中 85%为甘油三酯, 其在体内水解后可以转化为具有抗癌活性的油酸[1], 对多种肿瘤有良好的疗效,可能的作用机制为:选择性破坏肿瘤的细胞膜和线粒体; 抑制癌细胞生长和 DNA合成, 阻断癌细胞的细胞周期;升白细胞作用;提高机体免疫力;对多种药物的耐药有逆转作用。其中油酸、亚油酸被认为是抗肿瘤的活性成分[2]。 鸦胆子油乳注射液为鸦胆子油经乳化后制成的注射液, 在临床上被广泛应用于治疗癌症[1]。 对鸦胆子油自微乳化颗粒在机体内的生物利用度进行考察,并与市售鸦胆子油口服乳剂相比较,为该制剂质量标准的制定及临床应用提供参考, 并为鸦胆子油 S-SMEDDS 的进一步研究提供实验基础。 本实验建立了 HPLC法测定鸦胆子油中油酸、亚油酸的量,测定了口服给药的大鼠血浆药物浓度,计算出鸦胆子油中油酸、亚油酸的相对生物利用度。
1 材料
1.1 仪器及试剂 高效液相色谱仪; 高效液相色谱仪( LC-2010AHT型, 日 本岛 津);LC-Solution 色谱 数 据 工 作站; 电子天平 (型号 BS210S, 0.1 mg, 北京赛多利斯天平厂); 台 式 离 心 机 ( 型 号 TGL-16G, 上 海 安 亭科 学 仪 器厂); 超声波清洗器 ( 型号 KQ-100, 昆山市超声仪器有限公司); 电热恒温水浴锅 (H.H.S 21-6K, 上海医疗器械五厂); 移液枪 (型号 20 ~200 μL、 100 ~1 000 μL, 上海万岛仪器科技有限公司); 水浴箱、 冰箱、 吹风机以及其他常用实验室仪器。
油酸 (Sigma公司, 纯度≥99.0%, 批号 BCBF5052);亚油酸 ( Sigma公司, 纯 度 ≥99.0%, 批 号 BCBF2279 );冰醋酸, 三乙醇胺, ω-溴代苯乙酮, 丙酮, 甲醇为色谱纯试剂,水为纯净水,其他试剂均为分析纯。
1.2 试药 鸦胆子油自微乳化颗粒剂 (实验室自制, 批号20120320); 鸦胆子油口服乳液 (批号 20111208, 吉林省康福药业有限公司, 国药准字 Z22025409)。
1.3 动物 SD大鼠, SPF级, 雌雄各半, 体质量 120 ~140 g, 由西安交通大学医学院实验动物中心提供, 编号为0001381, 许可证号 SCXK-(陕) 2007-001。
2 方法与结果
2.1 鸦胆子油自微乳颗粒的制备 称取处方量聚氧乙烯氢化蓖麻油 (RH-40) 与聚乙二醇 400 (PEG400), 辛酸癸酸三甘油酯 (GTCC) 与鸦胆子油, 分别混合均匀, (37 ± 1)℃磁力搅拌, 即得鸦胆子油自微乳, 静置待用; 按处方称取交联聚维酮,待加入自微乳,自微乳完全被吸附后加入处方量的淀粉、 糊精, 混匀搅拌, 15%淀粉浆制粒。 湿颗粒在55 ℃烘箱内干燥3 h后整粒, 即得。
2.2 分组与给药 取 SD大鼠 12 只, 正常饲养至体质量约为 (270 ±20) g, 随机分为 2 组, 颗粒剂组 (鸦胆子油自微乳化颗粒剂) 和对照组 (鸦胆子油口服乳剂), 每组 6只。 采用灌胃给药, 于大鼠禁食 12 h后, 从次日晨8 点开始灌胃给药, 分别于 0.17、 0.33、 0.50、 0.67、 0.83、 1、
2、 4、 6、 8 h 后颈总动脉分离插管采血, 血样置于肝素抗凝管中, 3 000 r/min 下离心 10 min, 取上层血清, -20 ℃冰箱冷藏备用。
2.3 血浆样品处理方法[3]精密量取大鼠待测血浆样品100 μL, 置于 10 mL具塞离心管中, 加 2.5 mL异丙醇-正庚烷-冰醋酸溶液 (4 ∶1 ∶0.25), 涡旋 1 min, 间断超声2min, 室温下放置 10min; 再精密加入正庚烷 1mL, 双蒸水 1.5mL, 涡旋 1min, 间断超声 2 min, 3 000 r/min 离心10 min。 再精密吸取上清液 1 mL, 置于 5 mL具塞离心管中, N2吹干; 精密加入 20 μg/mL的 ω-溴代苯乙酮丙酮溶液、 25 μg/mL三乙醇胺丙酮溶液各 50 μL, 乙腈 300 μL,试管加塞密封, 混匀。 90 ℃水浴加热 15 min, 冷却至室温; 精密加入 10 μg/mL醋酸溶液 75 μL, 90 ℃水浴加热5min, N2吹 干; 精 密 加 入 甲 醇 500 μL, 超 声 1 min,0.45 μm滤膜过滤, 得到生物样品衍生物溶液, 注入液相色谱仪,测定,记录色谱图。
2.4 生物样品分析方法的建立
2.4.1 测定条件 油酸和亚油酸为血浆中的固有脂肪酸,实验前需采集未给药大鼠基础值 (即空白血样), 对此后的不同时间点的血样进行自身空白对照。
2.4.2 色谱条件及系统适用性实验 AgiLent ZORBAX E-cLipse XDB-C18色谱柱 (4.6mm×250mm, 5 μm) ; 流动相为甲醇-水 (96 ∶4); 柱温 30 ℃; 检测波长 242 nm; 体积流量 1 mL/min; 进样量 10 μL。 见图 1。
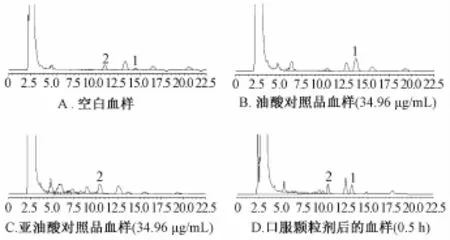
图1 空白大鼠血浆、加入油酸、 亚油酸对照品的血浆和血浆样品的 HPLC色谱图
实验结果表明,油酸、亚油酸在此色谱条件下分离良好,无其他杂质干扰。
2.4.3 标准曲线的制备 取大鼠空白血浆100 μL, 分别加入不同质量浓度的油酸、亚油酸对照品溶液,使血浆中油酸、 亚油 酸 质 量浓 度 分 别为 49.925、 34.960、 12.480、6.240、 3.120、 1.560、 0.370 μg/mL, 按 “2.2” 项血浆样品处理方法处理,注入液相色谱仪。各质量浓度油酸、亚油酸峰面积减去空白血浆油酸、 亚油酸峰面积 (Y) 对质量浓度 (X) 做线性回归, 得到标准曲线方程: 油酸 Y= 4 736.8X-1 597.1, r=0.999 5; 亚油酸 Y=5 030X+ 2 087.6, r=0.999 5。 结果表明, 油酸、 亚油酸在进样质量浓 度 分 别 在 1.560 ~49.925 μg/mL、 0.370 ~44.125 μg/mL的范围内呈良好的线性关系。
2.4.4 精密度 取大鼠空白血浆制备成高、 中、 低 3 个质量浓度的血标样各 5 份 (油酸分别为 34.96、 12.48、 6.24 μg/mL; 亚油 酸分别为 26.925、 12.660、 6.280 μg/m L),按 “2.2” 项血浆样品处理方法项下操作, 测定日内和日间精密度,记录峰面积,根据随行标准曲线方程计算各标样油酸、亚油酸的质量浓度。结果表明,油酸、亚油酸日内/日间精密度 RSD均 <7%, 该方法精密度良好, 符合生物样品的分析要求。
2.4.5 相对回收率[4-5]取大 鼠空白血浆, 向 其中分 别加入不同质量浓度油酸、亚油酸对照品溶液 (油酸分别为34.96、 12.48、 6.24 μg/m L; 亚 油 酸 分 别 为 26.925、12.660、 6.280 μg/mL), 制备成高、 中、 低 3 个质量浓度的血浆标品样品各 5 份, 并按 “2.2” 项下操作处理血标样,记录峰面积,根据随行标准曲线方程,计算每份样品中所得质量浓度,并计算其与加入质量浓度的比值即为相对回收率,结果见表 1。 结果表明, 该方法的相对回收率符合生物样品的测定要求。
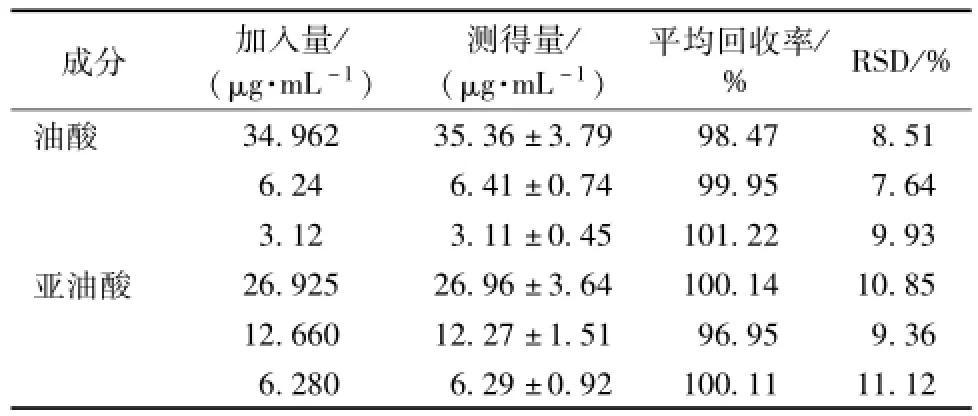
表1 生物样品中油酸、亚油酸相对回收率
2.5 鸦胆子油自微乳颗粒大鼠生物利用度测定
2.5.1 相对生物利用度的测定 按照 “2.1” 项下, 制得生物样品衍生物溶液,注入液相色谱仪,测定血浆样品中油酸、 亚油酸质量浓度并比较, 见图 2、 3。
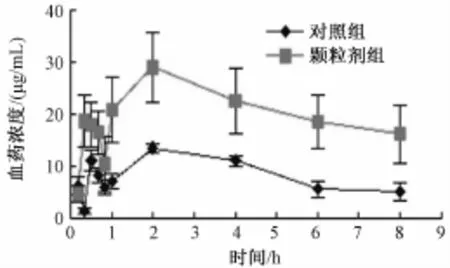
图2 不同制剂中油酸在体内药时曲线
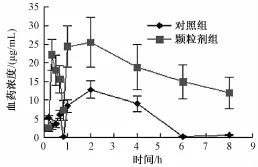
图3 不同制剂中亚油酸在体内药时曲线
结果表明,大鼠鸦胆子油自微乳化颗粒剂的血样中,油酸、 亚油酸的 Cmax均为普通口服乳剂的 2 倍多, 曲线下面积 (AUC) 也远大于普通口服乳剂。2.5.2 药-时曲线下面积和相对生物利用度的计算 根据不同血浆样品中油酸、 亚油酸的血药浓度-时间曲线, 使用DAS 2.1.1 版软件, 对鸦胆子油口服乳剂和鸦胆子油自微乳化颗粒在血浆中的 AUC、 Cmax、 等参数进行分析。 主要药动学参数见表2。
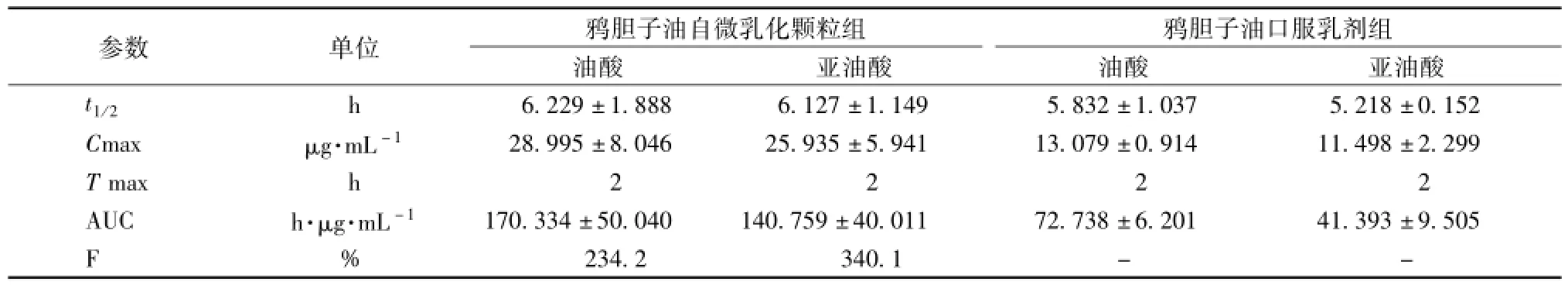
表2 药代动力学试验统计结果
3 结论与讨论
血浆中游离脂肪酸的定量测定报道较多[6-8]。 本实验结合实际情况建立的 HPLC法简便、 快捷, 方法学各项参数均合格,可以满足测定的要求。
实验室自制的鸦胆子油自微乳粒径约 35 nm, 30 min溶出度可达 89.9%。 相对生物利用度结果证实, 鸦胆子油自微乳颗粒剂生物利用度明显优于市售口服乳剂,能够显著促进鸦胆子油的口服吸收,其机理主要是在进入胃肠道后,微乳乳滴能够广泛分布,与胃肠黏膜充分接触,有利于鸦胆子油的吸收利用。同时,微乳中的脂质能够兴奋脂蛋白的形成,促进小肠淋巴循环,促进鸦胆子油在小肠部位的淋巴转运,降低首过效应,提高鸦胆子油的生物利用度[9]。
SMEDDS 的药时曲线存在双峰现象, 这主要与药物的释放情况有关,微乳处方中较多的表面活性剂具有打开细胞紧密连接、促进药物细胞间转运的特点,改变了药物原有的胃肠道吸收行为,产生导致例如胃肠循环、双吸收部位等特殊吸收[10]。 此外, 双峰现象的产生也与微乳本身的理化性质 (如电位、 粒径)、 生物学性质 (影响肠道的转运蛋白、酶系、细胞的紧密连接等)有密切的关系,需要进一步研究[11]。
[ 1 ] 孔令锋, 苗 颖.HPLC-ELSD法测定鸦胆子油乳注射液中甘油三油酸酯的含量 [ J].中国药师, 2013, 16 (5): 670-672.
[2] 韩凤娟, 蔡冬燕,吴效科, 等.鸦胆子油乳抗肿瘤机制研究进展[J].现代肿瘤医学, 2013, 21(3):669-671.
[3] 项 琪, 周莉玲,张 卉.鸦胆子油微乳在大鼠体内的药动学研究[ J] .中药材, 2007, 30(9) :1113-1115.
[ 4 ] Zhang Hua, Wang Guiling, Li Kexin, et al.A high performance liquid chromatographymethod for the quantitative determination of ribavirin in human plasma and its application in a pharmacokinetics study[ J] .J Chin Pharm Sci, 2013, 22(4):361-364.
[5] 王 丹, 刘春生,吕亚丽, 等.葛根素微透析线性探针相对回收率影响因素的研究[J].国际药学研究杂志, 2011,38(5):390-393.
[6] 李 玲, 魏锡文,杨 刚, 等.高效液相色谱法测定人血浆中的游离脂肪酸[J].分析仪器, 1996, (3):37-391.
[7] 黄作君, 徐 刚,黎月玲, 等.高效液相色谱法测定大鼠血浆中游离脂肪酸浓度[ J].广东药学院学报, 2004, 20(6):656-6581.
[8] 应珊红, 栾 霞,安友仲.气相色谱法测定手术前后人体血浆中游离脂肪酸含量的变化[J].现代仪器, 2000,(3):30-331.
[9] 高朝阳, 李 娟,芦 霜, 等.水飞蓟宾口服亚微乳剂的制备及大鼠体内药动学研究[J].药学与临床研究, 2012,20(4):289-293.
[10] 孙瑞元.药代动力学研究中双峰现象及其处理 [A] //第三届全国定量药理研究方法学研讨会论文集.北京:中国药理学会, 2010.
[11] 李桂玲, 范雅婷, 张燕惠, 等.醋柳黄酮自微乳化给药系统 的 体 内 外 评 价 [ J].药 学 学 报, 2012, 47 ( 8 ): 1055-1062.
R969.1
:B
1001-1528(2014)12-2615-03
10.3969/j.issn.1001-1528.2014.12.040
2013-09-12
陕西省 “13115” 科技创新工程重大科技专项项目 (2009ZDKG-82)
李 晔 (1970—), 女, 博士生, 研究员, 研究方向: 中药的新型给药系统。 Tel: (029) 87251837, E-mail:liyelsj@163.com
日期:2014-05-12
网络出版地址:http://www.cnki.net/kcms/detail/31.1368.R.20140512.1547.001.html

