‘赞皇枣’黑腐病菌拮抗芽胞杆菌的筛选及发酵条件优化
高 芬, 李静虹, 张娜莎, 王俊宏, 王梦亮
(山西大学应用化学研究所,太原 030006)
‘赞皇枣’黑腐病菌拮抗芽胞杆菌的筛选及发酵条件优化
高 芬, 李静虹, 张娜莎, 王俊宏, 王梦亮*
(山西大学应用化学研究所,太原 030006)
摘要以‘赞皇枣’黑腐病主要病原菌链格孢菌[Alternaria alternata(Fries)Keissler]为靶标,对具有较强抗真菌活性的10株芽胞杆菌进行室内多重筛选,并采用二次回归正交旋转设计和单因素试验对筛选获得的目标菌分别进行发酵培养基优化和最佳发酵条件确立。结果表明:芽胞杆菌B07对靶标菌拮抗作用良好,活体拮抗抑菌带宽度达(8.00±0.50)mm,无菌发酵滤液抑菌圈直径为(24.44±1.37)mm,且有良好的持久性,具有开发应用价值;B07发酵的最优培养基为:红薯粉2 g/L,牛肉膏10 g/L,NaCl 10 g/L,MnSO40.02 g/L;最佳发酵条件为:种子液浓度1.5×107~2.0×108cfu/mL时,接种量5%(V/V),装液量40 mL/250 m L,原始p H7.0,发酵温度32℃,时间72 h。
关键词赞皇枣; 黑腐病菌; 拮抗芽胞杆菌; 多重筛选; 发酵条件优化
‘赞皇枣’(Zanhuang jujube)又名金丝大枣,是我国700多个枣品种中唯一的自然三倍体,每100 g鲜枣中维生素C含量高达383~597 mg,称为“活维生素丸”,居各种果品之首[1]。黑腐病是‘赞皇枣’主要果实病害之一,受害果实的病部稍有凹陷或皱折,进而整个病果呈暗红色;发病后期枣果实干缩成灰黑色或黑色,易脱落,味苦,不能食用[2]。近几年来该病害发生日趋严重[3],极大地影响了‘赞皇枣’的产量、果实品质和商品价值。
针对该病害大多采用化学药剂防治,虽有一定成效,但由于化学农药存在毒性大、残留高、污染严重、对人体有危害等诸多缺点,且‘赞皇枣’作为鲜食品种,对防治果实病害的农药具有更高的使用要求,所以选用高效、低毒、低残留的生物农药,对生产绿色或有机枣果具有重大的现实意义[4]。拮抗微生物不仅不易使病原菌产生耐药性、不污染环境、无残留,而且其生防制剂具有高效、持久等特点,是植物病害生物防治中的重要可利用资源。芽胞杆菌分布广泛,具有显著的抗菌活性和极强的抗逆能力[5-6],能忍受极端的外部环境而长期存活[7],可以制成可湿性粉剂、粉剂等各种剂型而不失活,因此,是一种理想的生防微生物。一些芽胞杆菌(Bacillus spp.)的优势菌株已经开发成生物农药投入到植物病害的防治中。陈志谊[8]、黎起秦[9]等利用芽胞杆菌进行水稻纹枯病防治,取得了良好的效果;Daivasikamani等利用枯草芽胞杆菌(Bacillussubtilis)来防治咖啡锈病,体外抑制试验表明:该芽胞杆菌对咖啡锈菌(Hemileia vastatrix)孢子萌发的抑制率高达68.20%,而在体内试验中对其孢子萌发的抑制率也能达到42.98%[10]。目前,有关枣黑腐病生物防治的报道较少,仅见陈贻金等[11]将农抗链霉素(70~140 IU/mL)、50%DT600倍液、卡那霉素(140 IU/mL)和土霉素(210 IU/mL)等在发病期内混合使用,保果率在90%以上;李志清等[12]将3%中生菌素(800倍)、4%农抗120(400倍)和4%双抗(400倍)等与化学农药甲基硫菌灵等交替使用,防治效果也较好,但利用芽胞杆菌开发防治枣黑腐病生防制剂的研究未见报道。因此,为寻找枣果实病害无公害防治的新途径,本研究以从山西省石楼县‘赞皇枣’黑腐病果中分离获得的主要病原菌之一链格孢菌[Alternaria alternata(Fries)Keissler]为靶标,对本实验室保存的10株具较好抗真菌活性的芽胞杆菌进行了筛选,并对筛选获得的芽胞杆菌发酵培养基配方和条件进行了优化,以期为田间试验的进行和生防制剂的开发奠定基础。
1 材料和方法
1.1 试验材料
供试芽胞杆菌:B01(Bacillus thuringiensis)、B02(B.cereus)、B03(B.polymyxa)、B04(B.megaterium)、B06(B.laterosporus)、B09(B.licheniformis)、B05、B07、B08、B10均为B.subtilis,上述供试菌株由本实验室筛选并保存,相关种属鉴定数据待发表。
供试病原菌:‘赞皇枣’黑腐病主要病原菌链格孢菌(A.alternata),由本实验室分离鉴定。
1.2 拮抗芽胞杆菌的多重筛选
1.2.1 病原菌培养
孢子悬液制备:将靶标菌接PDA斜面活化120 h后,每个斜面加入无菌水5 m L,制备孢子或菌丝悬浮液(10×15倍下,30~40个/视野),置4℃冰箱备用。
菌块制备:在制备好的PDA平板上加入孢子悬液0.2 m L,玻璃棒涂布均匀,28℃恒温培养72 h,待靶标菌长满全皿后,用无菌打孔器制备菌块(直径7 mm),待用。
1.2.2 拮抗菌无菌发酵滤液制备
基础发酵培养基:葡萄糖6 g/L,牛肉膏9 g/L,NaCl4g/L,MnSO40.05 g/L,p H 7.0。将待筛选的芽胞杆菌在PDA培养基活化48 h(28℃),然后制成终浓度为1.5×107~2×108cfu/m L的菌悬液,按4%的比例(V/V)接种至50 m L的液体培养基中(250 m L三角瓶),180 r/min摇床振荡培养48 h(30℃)后,6 000 r/min离心10 min,取上清液,用细菌过滤器除去菌体(0.22μm),得拮抗菌无菌发酵滤液,置4℃冰箱备用。
1.2.3 活体对峙筛选
采用平板对峙法[13]筛选:挑取一环活化好的拮抗菌,在PDA平板1/2处画线,28℃培养24 h后,在拮抗菌线两边等距离(15 mm)接入靶标菌菌块,28℃培养72 h,测量抑菌带宽度。
1.2.4 拮抗菌摇瓶发酵筛选
用牛津杯法[14]进行复筛菌株抑菌活性测定:将靶标菌孢子悬液加入熔融态PDA培养基(30μL/70 m L PDA,20 m L/皿,9 cm平皿),制成混菌平板。凝固后,等距离放入牛津杯2个,牛津杯无菌滤液加样量0.2 m L,28℃培养72 h后,十字交叉法测量抑菌圈直径。
1.2.5 无菌发酵滤液抑制菌丝生长法筛选
采用含药平板法[15]测定发酵液对菌丝生长的抑制效果:把无菌发酵滤液按比例加入熔融态的PDA培养基中,使其最终稀释倍数分别为10、20、40、80、160倍,制备平板(每皿20 m L)。然后将靶标菌菌块接入平板中央,72、120、168 h时测量菌落直径,并计算抑制率。相对抑制率(%)=[(对照菌落直径-处理菌落直径)/对照菌落直径]×100。
上述试验均设无菌水为对照,试验设3次重复。
1.3 拮抗芽胞杆菌培养条件优化
1.3.1 发酵培养基碳、氮源优化
碳源优化:以原始培养基为基础,将其中的葡萄糖(C-A)依次换为麦芽糖(C-B)、可溶性淀粉(C-C)、红薯粉(C-D)、蔗糖(C-E)、麸皮(C-F)。按1.2.2的方法制备无菌发酵滤液,牛津杯法进行生物测定,确定最佳碳源。
氮源优化:在确定最适碳源基础上,将培养基中的牛肉膏(N-A)依次换为蛋白胨(N-B)、豆饼粉(NC)、酵母膏(N-D)、鱼粉(N-E)、氯化铵(N-F)。方法同碳源优化,确定最佳氮源。
以上试验均设3次重复。
1.3.2 二次回归正交旋转组合设计发酵培养基
采用二次回归正交旋转组合设计,选择培养基中4种主要组分:碳源(X1)、氮源(X2)、NaCl(X3)、MnSO4(X4)为4个考察因素,每个因素选取5个显著水平,采用DPS软件设计4因素5水平正交回归旋转试验组合,共进行36组试验[16-18],确定最佳发酵培养基。试验重复3次。
优化前后培养基的效价对比:将优化前后的培养基同时发酵,按照1.2.2的方法制备无菌发酵滤液,牛津杯法生物测定,明确培养基优化后的效果。试验设3次重复。
1.3.3 发酵条件优化
接种量:以优化后的培养基为发酵培养基,分别以2%、3%、4%、5%、6%的比例(V/V)进行接种,孢子液制备同1.2.1,无菌发酵滤液制备同1.2.2,生物测定同1.2.4,确定最佳接菌量。
初始p H:在接种量确定的基础上,将培养基初始p H分别调至5.0、6.0、7.0、8.0、9.0,同上试验,确定最佳初始p H。
装液量:在上述试验的基础上,装液量分别为20、30、40、50、60 m L(250 m L三角瓶)时进行发酵,同上试验,确定最佳装液量。
发酵温度:在上述试验的基础上,分别于20、24、28、32、36℃下发酵,同上试验,确定最佳发酵温度。
发酵时间:在上述试验的基础上,分别发酵培养24、36、48、60、72 h,同上试验,确定最佳发酵时间。
以上试验均设3次重复。所有结果采用DPS统计软件进行分析。
2 结果与分析
2.1 拮抗芽胞杆菌的多重筛选
通过平板对峙法对10株芽胞杆菌进行初筛,其中菌株B01、B05、B07有明显拮抗效果,抑菌带宽度分别为(9.25±0.96)、(8.00±0.50)和(8.00± 0.50)mm,远大于其他备筛菌株。上述3株菌的无菌发酵滤液活性测定表明:菌株B01、B07抑菌圈直径分别为(17.44±3.16)和(24.44±1.37)mm,而菌株B05抑菌圈直径仅为(12.13±1.66)mm,因此选取菌株B01、B07进入下步筛选。
菌丝生长抑制试验结果表明:同等稀释倍数下,B07的抑菌率明显高于B01,在稀释10倍时,B07的抑菌率可达54%;相同时间下,随着稀释倍数的增加,B01和B07发酵液对靶标菌的抑制率也随之下降(图1),但B01抑菌活性的下降速度明显比B07快。在发酵液稀释160倍,168 h时测定抑菌活性发现:B07发酵液的抑菌率仍达36%,而B01的抑菌率仅为13%,说明菌株B07代谢产生的拮抗物质有较好的持效性。
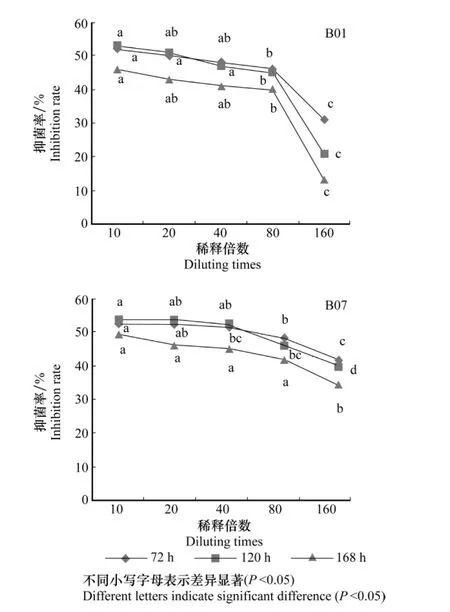
图1 芽胞杆菌B01和B07无菌发酵滤液对菌丝生长的抑制作用Fig.1 The inhibition effects of bacteria-free filtrate of B01 and B07 on mycelial growth
2.2 拮抗芽胞杆菌培养基优化
2.2.1 发酵培养基碳、氮源优化
在供试的6种碳源中,以红薯粉、淀粉、蔗糖和麦芽糖为碳源进行发酵,发酵液的抑菌效果较好,且活性依次略有降低,但四者之间无显著差异(P>0.05)。从实际应用和发酵成本考虑,选用红薯粉作为碳源。在供试的6种氮源中,以牛肉膏为氮源进行发酵后,发酵液的抑菌效果显著高于其他5种氮源,故选用牛肉膏作为氮源(图2)。
2.2.2 二次回归正交旋转组合设计发酵培养基
采用DPS数据处理系统对二次回归旋转组合试验的数据进行拟合,由方差分析(表1)可知,回归方程的失拟性检验F1=2.202 14<F0.05(10,11)=2.85不显著,可以认为所选定的二次回归模型是适当的;回归方程的显著性检验F2=2.396 98>F0.05(14,21)=2.20显著,说明方程与试验数据的配合是可行的,可用来建立模型[19],故认为仅就各试验因素而言,方程回归结果是可靠的。最终获得的优化后培养基配方为:红薯粉2 g/L,牛肉膏10 g/L,NaCl 10 g/L,MnSO40.02 g/L。
通过优化前后的培养基效价对比试验,测得原始培养基发酵液的抑菌圈直径为(26.25±0.71)mm,而优化后可达(30.50±1.52)mm,抑菌活性提高了16.2%,表明优化后的发酵培养基更利于B07菌株代谢产生抗菌物质。

图2 不同碳、氮源对芽胞杆菌B07发酵后抗菌物质的影响Fig.2 Effects of carbon and nitrogen sources on antifungal substances from Bacillus B07
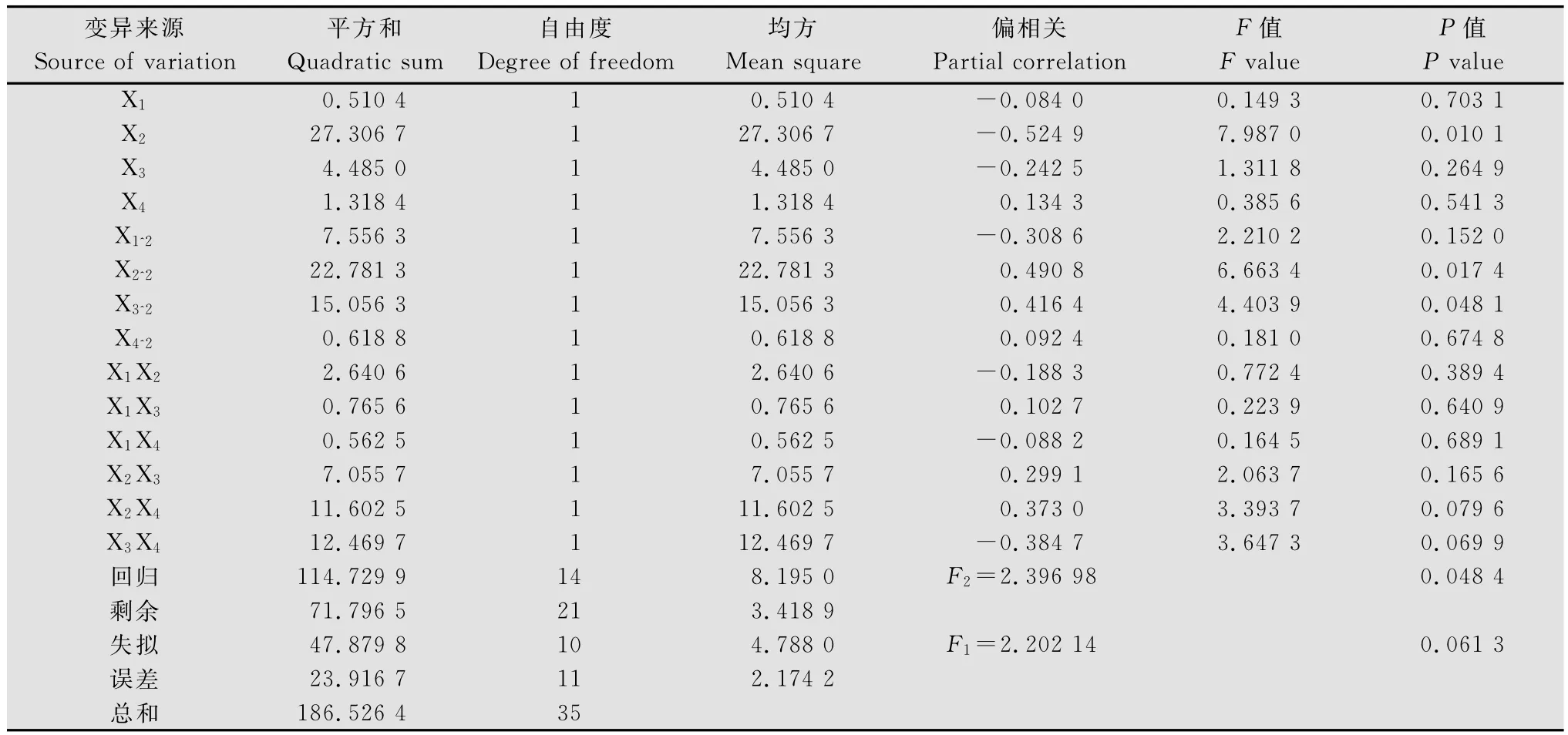
表1 回归旋转组合设计试验方差分析1)Table 1 Analysis of variance test of quadratic orthogonal rotation combination design
2.2.3 发酵条件优化
接菌量:在接种量占发酵液总体积2%~5%的范围内,菌株B07发酵液的抑菌活性随接种量的上升而上升,且在接种量占发酵液总体积的5%时产量达到最高。接种量>6%时,发酵液抑菌活性有所降低(图3a)。可见,在一定量的发酵培养基中,接种量的多少与抑菌活性物质的产量有关,菌量太小不能充分利用发酵培养基的营养成分;菌量过多则导致营养成分不足,使抑菌活性物质的产量受到影响。当接种量控制在5%时可得到较好的发酵效果。
初始p H:在不同初始p H条件下,菌株B07发酵液的抑菌活性随着p H的升高缓慢上升,当p H=7时达到最高,此后开始缓慢下降,但各处理间差异不显著,说明初始p H在5.0~9.0的范围内,对发酵液的抑菌活性影响不大,但以p H 7.0时为最佳。这可能和芽胞杆菌对极端环境有极强的抗逆能力,弱酸弱碱条件对菌株的生长没有造成太大的影响有关(图3b)。
装液量:菌株B07发酵液的抑菌活性随装液量增加缓慢上升,当装液量>40 m L时抑菌活性开始缓慢下降。装液量为20~60 m L/250 m L的范围内,各处理间抑菌活性无显著差异,但以40 m L最佳,说明装液量在40 m L时,营养成分的供应和通气量达到了良好的平衡(图3c)。由于装液量的多少直接影响到培养瓶中的氧气含量,氧气的量供应不足会影响菌体的生长,导致产素量降低[16]。因此,以该装液量为后续试验选用的装液量。
发酵时间:B07发酵液的抑菌活性随发酵时间的延长而增加,当发酵72 h时抑菌活性达到最佳,而84 h时抑菌活性无明显变化,可见72 h是其发酵的最佳时间,既保证了抗菌物质达到最大产生量,又节约了时间(图3d)。
温度:发酵温度在24~32℃之间时,发酵液的抑菌活性逐步上升,在32℃时达到最高,36℃时开始下降(图3e),但28℃和32℃处理间无显著差异,所以28~32℃都可视为适合发酵温度,以32℃为佳。
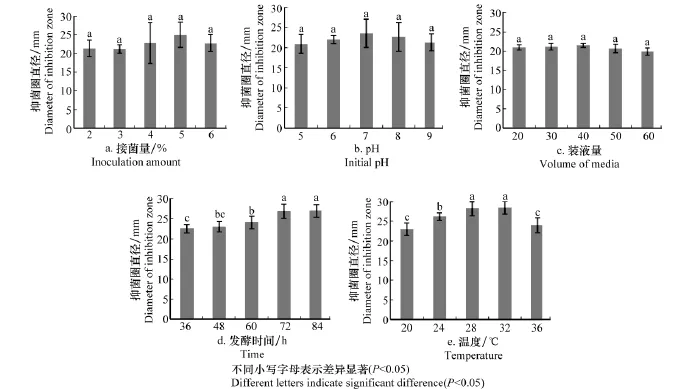
图3 不同发酵条件对芽胞杆菌B07产生抗菌物质的影响Fig.3 Effects of different fermentation conditions on antifungal substances from Bacillus B07
综上所述,B07摇瓶发酵的最佳条件为:种子液浓度1.5×107~2×108cfu/m L时,接种量5%(V/V),装液量40 m L/250 m L三角瓶,起始p H7.0,发酵温度32℃,发酵时间72 h。
3 讨论
生物防治是未来农业生产中的重要措施,而分离筛选高效拮抗菌是进行生物防治研究的基础[20-21]。本研究通过对10株有抗真菌活性的芽胞杆菌进行多重筛选,从中获得一株对‘赞皇枣’黑腐病主要病原菌链格孢菌(A.alternata)具有良好抑菌活性的菌株—枯草芽胞杆菌B07。该菌株在活体对峙培养和摇瓶发酵复筛中,表现出了显著而稳定的抑菌效果,同时也显示出了较好的持效性。枯草芽胞杆菌的研究与应用在国内外已有100多年的历史,作为一种安全、高效、多功能和极具开发潜力的微生物菌种已广泛应用于工业、农业、医药卫生、食品、畜牧业、水产及科研诸领域[22]。为此,我们对菌株B07的发酵条件进行了优化,获得了最优发酵培养基组合和室内摇瓶发酵的最佳条件,为进入中试发酵和田间试验奠定了基础。
本研究筛选获得的芽胞杆菌B07虽然在室内筛选中表现出了良好的抑菌效果,具有作为生物农药的潜力,但是由于生防制剂在使用过程中,受不同地区生态条件,包括温湿度、降雨量、土壤结构、p H、含水量以及微生物区系等因素的影响[23],田间的防治效果和室内的抑菌结果不具有完全的对应关系,因而还需在芽胞杆菌B07发酵条件优化的基础上进行中试发酵,进一步明确其田间防治效果。另外,由于枣黑腐病由多个病原菌引起,单纯施用对一种菌具有拮抗效果的生防制剂,不一定能起到最优的防治效果,所以,B07与多种拮抗菌株联合使用时,能否保持较好的拮抗效果也是后续生防制剂开发需要考虑的问题。
此外,抑菌有效组分的分离、活性物质理化性质的测定以及安全性试验等方面的工作也有待进一步深入开展。
参考文献
[1] 及华,关军锋,窦世娟,等.采后赞皇大枣不同包装处理的生理生化性状差异[J].果树学报,2004(6):540-543.
[2] 孙兆军.枣黑腐病的发病症状及防治措施[J].烟台果树,2009(1):54-55.
[3] 李志清,常聚普,程国华,等.枣黑腐病防治技术研究[J].林业科技通讯,2000(12):10-12.
[4] 魏天军,魏象廷.中国枣果实病害研究进展[J].西北农业学报,2006(1):88-94.
[5] 刘焕利,潘小玫,张学君,等.产抗菌蛋白芽孢杆菌的筛选及抗菌蛋白性质[J].中国生物防治,1995(4):17-21.
[6] Arima K,Kakinuma A,Tamura G.Surfactin,a crystalline peptidelipid surfactant produced by Bacillussubtilis:isolation,characterization and its inhibition of fibrin clot formation[J].Biochemical and Biophysical Research Communications,1968,31(3):488-494.
[7] Shoda M.Bacterial control of plant diseases[J].Journal of Bioscience and Bioengineering,2000,89(6):515-521.
[8] 陈志谊,许志刚,高泰东,等.水稻纹枯病拮抗细菌的评价与利用[J].中国水稻科学,2000,14(2):98-102.
[9] 黎起秦,林纬,陈永宁,等.芽孢杆菌对水稻纹枯病的防治效果[J].中国生物防治,2000(4):160-162.
[10]Daivasikamani S,Rajanaika.Biological control of coffee leaf rust pathogen,Hemileia vastatrix Berkeley and Broome using Bacillus subtilis and Pseudomonas fluorescens[J].Biopesticides,2009,2(1):94-98.
[11]陈贻金,陈谟林,朱林元.枣缩果病及其防治技术研究[J].林业科技通讯,1989(8):3-7.
[12]李志清,张兆欣,田国忠,等.枣黑腐病田间药剂防治技术研究[J].中国森林病虫,2005(5):3-6.
[13]林福呈,李德葆.枯草芽孢杆菌(Bacillus subtilis)S9对植物病原真菌的溶菌作用[J].植物病理学报,2003(2):174-177.
[14]董金甫,李瑶卿.茶多酚抑菌作用的研究[J].生物学杂志,1992(4):19-22.
[15]沈光斌,周明国.水稻白叶枯病菌对噻枯唑的抗药性监测[J].植物保护,2002(1):9-11.
[16]任丹,辜运富,张小平,等.二次回归正交旋转组合设计在紫芝液体发酵培养条件优化中的应用[J].西南农业学报,2011(2):681-686.
[17]童成立,贺喜全,盛良学.农业试验中正交旋转回归设计分析模型[J].计算机与农业,2000(10):16-20.
[18]王惠,吴兆亮,童应凯,等.应用二次回归正交旋转组合设计优化黄霉素发酵培养基[J].食品研究与开发,2006(6):19-22.
[19]张晓娜,周素梅,王世平.二次回归正交旋转组合设计对麦麸中阿拉伯木聚糖酶解工艺的优化[J].食品科学,2008(1):141-145.
[20]张慧,杨兴明,冉炜,等.土传棉花黄萎病拮抗菌的筛选及其生物效应[J].土壤学报,2008(6):1095-1101.
[21]Cook R J.Making greater use of introduced microorganisms for biological control of plant pathogens[J].Annual Review of Phytopathology,1993,31:53-80.
[22]惠明,窦丽娜,田菁,等.枯草芽孢杆菌的应用研究进展[J].安徽农业科学,2008,36(27):11623-11624,11627.
[23]van Rij E T,Wesselink M,Chin-A-Woeng T F C,et al.Influence of environmental conditions on the production of phenazine-1-carboxamide by Pseudomonas chlororaphis PCL1391[J].Molecular Plant-Microbe Interactions,2004,17(5):557-566.
中图分类号:S 476
文献标识码:A
DOI:10.3969/j.issn.0529-1542.2014.03.012
收稿日期:2013-07-15
修订日期:2013-10-29
基金项目:科技部创新方法专项(2010IM020700)
*通信作者E-mail:mlwang@sxu.edu.cn
In vitro screening of antagonistic Bacillus against Alternaria alternata and optimization of fermentation factors
Gao Fen, Li Jinghong, Zhang Nasha, Wang Junhong, Wang Mengliang
(Institute of Applied Chemistry,Shanxi University,Taiyuan 030006,China)
AbstractMultiple in vitro screening of 10 Bacillus strains against Alternaria alternata(Fries)Keissler was conducted.The optimum fermentation medium and fermentation conditions for the selected strain were determined by using quadratic orthogonal rotation combination design and single-factor experiment design,respectively.The results showed that the strain Bacillus B07 had obvious and stable antagonistic effect on A.alternata.The inhibition belt of the living body was up to(8.00±0.50)mm in width,and the inhibition zone of the bacteria-free filtrate was(24.44±1.37)mm in diameter.With lasting inhibition effect,Bacillus B07 had great potential for a commercial development.The optimum fermentation medium for strain B07 consisted of 2 g/L sweet potato powder,10 g/L beef extract,10 g/L NaCl,and 0.02 g/L MnSO4.The optimum fermentation conditions were defined as follows:inoculation amount,5%(V/V)with a seed broth concentration of 1.5×107-2.0×108cfu/m L,40 m L media in a 250 m L flask,initial p H at 7.0,and fermentation at 32℃for 72 h.
Key wordsZanhuang jujube; black rot; antagonistic Bacillus spp.; screening; optimization

