3个芹菜品种Agnp-G3PDH基因的克隆及其序列和表达特性分析
田 畅, 蒋 倩, 王 枫, 李梦瑶, 贾晓玲, 熊爱生
(南京农业大学园艺学院 作物遗传与种质创新国家重点实验室 农业部华东地区园艺作物生物学与种质创制重点实验室, 江苏 南京 210095)
哺乳动物中甘油醛-3-磷酸脱氢酶(G3PDH,glyceraldehyde-3-phosphate dehydrogenase)在蛋白质和DNA互作、DNA修复、转录、调控、细胞信号转导及细胞凋亡等生命活动中表现出不同的功能性,在植物中此酶可能与哺乳动物具有相似的调控模式[1]。高等植物的G3PDH分为磷酸化和非磷酸化两大类,是维持生命活动的最基本酶之一,主要参与糖酵解、糖异生以及卡尔文循环等能量代谢途径。按定位来说可以分为质体型和胞质型两类,磷酸化的甘油醛-3-磷酸脱氢酶(GAPDH)在质体及胞质中均存在,包含GAPC、GAPCp和GAPA/B 三类同工型蛋白质[2];非磷酸化的甘油醛-3-磷酸脱氢酶(np-G3PDH)定位于细胞质中,为4个同种亚基GAPC组成的多聚体[3],是催化糖酵解“支路”反应的酶,具体反应过程为np-G3PDH氧化3-磷酸甘油醛生成3-磷酸甘油酸,该反应是依赖于NADP+并伴有NADPH生成的不可逆反应[4]。np-G3PDH的氨基酸序列与磷酸化的GAPDH的氨基酸序列同源性很低,但与各种真菌和真核生物的醛脱氢酶(ALDHs)有约30%的氨基酸序列同源性[5]。目前已从多种生物中克隆出np-G3PDH基因序列,如菠菜(SpinaciaoleraceaLinn.)[6]、玉米(ZeamaysLinn.)[7]、小麦(TriticumaestivumLinn.)[8]、拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕[9]和皱叶烟草(NicotianaplumbaginifoliaViv.)[10]等,np-G3PDH基因具有高度保守性,通过不同物种np-G3PDH基因核苷酸或氨基酸序列的比较,可为物种分类及发育关系研究提供一定的证据。
芹菜(ApiumgraveolensLinn.)是常用蔬菜之一,富含蛋白质、碳水化合物、胡萝卜素、B族维生素以及钙、磷、铁、钠等元素,栽培历史悠久、栽培区域广泛且品种丰富。南京六合地区栽培的品种‘六合黄心芹’(‘Liuhe Huangxinqin’)具有植株矮小、晚熟、喜湿、耐肥、耐热和耐寒等特点;天津津南地区栽培的品种‘津南实芹’(‘Jinnan Shiqin’)具有植株直立、抽薹晚、抗逆性强和适应性强等特点;而引进品种‘文图拉’(‘Ventura’)则具有株型大、质地脆嫩和抗病能力强等特点,具有典型的西芹特征。作者以上述3个芹菜品种为实验材料,克隆获得芹菜非磷酸化甘油醛-3-磷酸脱氢酶基因Agnp-G3PDH并进行序列分析;利用生物信息学方法推导其氨基酸序列并对氨基酸组成、亲水性/疏水性及其与其他物种的进化关系进行预测和分析;通过实时定量PCR对该基因的组织表达特异性及胁迫诱导表达特性进行了研究,以期为芹菜Agnp-G3PDH基因功能的深入研究提供依据。
1 材料和方法
1.1 材料
大肠杆菌菌株DH5α为南京农业大学作物遗传与种质创新国家重点实验室伞形科(Apiaceae)植物课题组保存;质粒载体pMD18-T Vector、ExTaqDNA聚合酶和各类限制性内切酶均为宝生物工程(大连)有限公司产品。
供试芹菜品种‘六合黄心芹’、‘津南实芹’和‘文图拉’均种植于南京农业大学园艺学院江浦实验农场,保存于人工气候室中,采集成熟的根、茎、叶和花用于总RNA提取及cDNA合成。
1.2 方法
1.2.1 总RNA的提取及cDNA的合成 采用RNA simple Total RNA Kit总RNA提取试剂盒〔天根生化科技(北京)有限公司〕从3个品种的根、茎、叶和花中提取总RNA,利用Prime Script RT reagent Kit试剂盒〔宝生物工程(大连)有限公司〕将总RNA反转录成cDNA。
1.2.2Agnp-G3PDH基因的克隆 根据GenBank中芹菜的np-G3PDH基因(登录号AF196292)设计引物NXR37(序列为5′-ATGGCTGGAAGTGGTGTGTATG-3′)和NXR38(序列为5′-CTAGCCCATGGTATAAGAA GGGGA-3′)。然后分别以‘六合黄心芹’、‘津南实芹’和‘文图拉’的cDNA为模板进行扩增、克隆和测序[11]。
1.2.3 序列分析 用BLASTp及DNAMAN进行氨基酸序列比对,相关种类的np-G3PDH氨基酸序列均来自NCBI数据库。利用DNAMAN和http:∥web.expasy.org网站相关软件进行亲水性/疏水性鉴定和氨基酸类型等相关分析,利用Signal P软件分析蛋白信号肽,蛋白质基本性质分析用http:∥www.expasy.org网站相关软件完成。利用DNAMAN构建系统进化树,然后用MEGA 5.0软件对进化树进行编辑并生成报告图形[12]。
1.2.4 胁迫处理及实时定量PCR反应 分别对3个品种的2月龄幼苗各20株进行高温、低温、盐和干旱胁迫处理。其中,高温和低温胁迫处理分别将植株置于38 ℃光照培养箱和4 ℃冰箱中处理2 h,盐和干旱胁迫处理则分别将植株用0.2 mol·L-1NaCl和质量体积分数20%PEG溶液室温处理2 h。
分别取经高温、低温、盐和干旱胁迫处理后3个芹菜品种植株的叶片进行实时定量PCR分析,各3次重复。根据克隆获得的‘六合黄心芹’、‘津南实芹’和‘文图拉’的Agnp-G3PDH基因序列分别设计表达检测上游引物NRX37BDF1(序列为5′-AGGGACAT CAACAAAGCAATG-3′)和下游引物NRX31BDR1(序列为3′-CATATTGATGCTGTT TGTGATG-5′);以芹菜actin基因为内参设计表达检测上游引物ACTIN-F(序列为5′-CTTCCTGCCATATATGATTGG-3′)和下游引物ACTIN-R(序列为3′-GCCAGCACCTCGATCT TCATG-5′)。采用SYBR PremixExTaq试剂盒〔宝生物工程(大连)有限公司〕进行实时定量PCR反应;相对定量使用参照基因的ΔCt法,表达差异用2-ΔΔCt表示。其中,ΔCt=Ct目标基因-Ctactin,ΔΔCt=ΔCt样品-ΔCt对照(式中,Ct表示每个PCR反应管内荧光信号到达阈值时所经历的循环数)。
2 结果和分析
2.1 芹菜Agnp-G3PDH基因的序列分析及其编码的氨基酸序列分析结果
分别以品种‘六合黄心芹’、‘津南实芹’和‘文图拉’嫩叶的cDNA为模板,用引物NRX37和NRX38分别扩增出1段长约1 500 bp的扩增产物(图1),经测序得到3个芹菜品种的Agnp-G3PDH基因序列及其编码的氨基酸序列(图2、图3和图4)。
序列测定与分析结果显示:3个芹菜品种的Agnp-G3PDH基因均含有1个长度为1 491 bp的开放阅读框(ORF,open reading frame),编码496个氨基酸。3个品种的Agnp-G3PDH基因序列中存在84个碱基差异,编码的氨基酸序列存在14个氨基酸位点的改变;其中,品种‘六合黄心芹’与‘文图拉’间的Agnp-G3PDH基因序列有6个不同位点、编码的氨基酸序列有4个氨基酸位点改变;而品种‘津南实芹’的Agnp-G3PDH基因序列与其他2个品种差异较大。

M: DL2000 marker; 1: 芹菜品种‘六合黄心芹’ A. graveolens ‘Liuhe Huangxinqin’; 2: 芹菜品种‘津南实芹’ A. graveolens ‘Jinnan Shiqin’; 3: 芹菜品种‘文图拉’ A. graveolens ‘Ventura’.

图2 芹菜品种‘六合黄心芹’Agnp-G3PDH基因的核苷酸序列及其编码的氨基酸序列

图3 芹菜品种‘津南实芹’Agnp-G3PDH基因的核苷酸序列及其编码的氨基酸序列

图4 芹菜品种‘文图拉’Agnp-G3PDH基因的核苷酸序列及其编码的氨基酸序列
通过品种‘六合黄心芹’、‘津南实芹’和‘文图拉’Agnp-G3PDH基因预测的3个芹菜品种Agnp-G3PDH蛋白的理论相对分子质量分别为53 201.6、53 051.4和52 960.3,理论等电点分别为pI 7.49、 pI 7.86和pI 8.12,酸性氨基酸(天冬氨酸+谷氨酸)与碱性氨基酸(赖氨酸+组氨酸+精氨酸)的比值分别为51/61、50/61和49/61,可见,在3个芹菜品种的Agnp-G3PDH蛋白中碱性氨基酸数量均大于酸性氨基酸数量。
对3个芹菜品种的预测Agnp-G3PDH蛋白的氨基酸序列进行亲水性/疏水性分析,结果见图5。结果显示:3个芹菜品种Agnp-G3PDH蛋白的氨基酸序列的亲水性/疏水性基本一致,均具有亲水性与疏水性双重特性,均为疏水性蛋白。
2.2 芹菜Agnp-G3PDH基因编码的氨基酸序列与其他植物的np-G3PDH氨基酸序列比对结果
对芹菜品种‘六合黄心芹’、‘津南实芹’和‘文图拉’的Agnp-G3PDH基因编码的氨基酸序列进行多重比对,结果显示:3个芹菜品种Agnp-G3PDH基因编码的氨基酸序列均具有高度的保守区域,同源性达99.09%。BLASTp分析结果显示(图6):品种‘六合黄心芹’Agnp-G3PDH基因编码的氨基酸序列属于ALDH-SF超家族,归为ALDHF11家族,是NAD(P)+依赖醛脱氢酶,具有多个NADP结合位点,属于多结构域蛋白序列。BLASTp分析结果还显示:3个芹菜品种Agnp-G3PDH基因编码的氨基酸序列与蒺藜苜蓿(MedicagotruncatulaGaertn.)、毛果杨(PopulustrichocarpaTorr. & Gray)[13]、黄瓜(CucumissativusLinn.)、葡萄(VitisviniferaLinn.)、可可(TheobromacacaoLinn.)、鹰嘴豆(CicerarietinumLinn.)、SolanumlycopersicumLinn.、二穗短柄草〔Brachypodiumdistachyum(Linn.) Beauv.〕、大豆〔Glycinemax(Linn.) Merr.〕、节节麦(AegilopstauschiiCoss.)、乌拉尔图小麦(TriticumurartuTum.)[14]等种类的np-G3PDH氨基酸序列具有很高的相似度。
3个芹菜品种Agnp-G3PDH基因编码的氨基酸序列与其他11种植物np-G3PDH氨基酸序列的多重比对结果(图7)显示:它们的氨基酸序列同源性达93.81%,表明np-G3PDH蛋白在进化上高度保守。
对3个芹菜品种Agnp-G3PDH基因编码的氨基酸序列和其他11种植物的np-G3PDH氨基酸序列组成及理化性质进行分析,结果见表1。分析结果显示:仅大豆np-G3PDH氨基酸序列的氨基酸残基数为497,3个芹菜品种Agnp-G3PDH基因编码的氨基酸序列和其他10种植物的np-G3PDH氨基酸序列的氨基酸残基数均为496,且均不存在信号肽序列与剪切位点;理论相对分子质量为52 000~54 000,理论等电点pI 6~pI 8;脂肪族氨基酸所占比例较高;芹菜品种‘津南实芹’Agnp-G3PDH基因编码的蛋白质与毛果杨np-G3PDH蛋白的总平均疏水性(GRAVY)分别为-0.001和-0.015,其他植物np-G3PDH蛋白的总平均疏水性均为正值。

图5 3个芹菜品种Agnp-G3PDH基因编码的氨基酸序列的亲水性(A)和疏水性(B)比较

图6 芹菜品种‘六合黄心芹’Agnp-G3PDH基因编码的氨基酸序列保守域预测
2.3 芹菜Agnp-G3PDH基因编码的氨基酸序列同源进化分析
根据BLASTp检索结果,选取上述11种植物的np-G3PDH氨基酸序列与3个芹菜品种Agnp-G3PDH基因编码的氨基酸序列构建同源进化树,结果见图8。分析结果显示:同属于禾本科(Gramineae)的节节麦、乌拉尔图小麦和二穗短柄草以及同属于豆科(Leguminosae)的大豆、鹰嘴豆以及蒺藜苜蓿均各自聚在同一分支中,表明属于同科的植物其np-G3PDH氨基酸序列的进化关系较近;而3个芹菜品种也聚在同一分支中,表明3个芹菜品种的Agnp-G3PDH基因编码的氨基酸序列的进化关系较近,并且与属于杨柳科(Salicaceae)的毛果杨的np-G3PDH氨基酸序列的进化关系也较近。
2.4 芹菜Agnp-G3PDH基因的表达特性分析
2.4.1 在不同组织中表达量的差异 实时定量PCR检测结果显示(图9):芹菜Agnp-G3PDH基因在品种‘六合黄心芹’、‘津南实芹’和‘文图拉’根、茎、叶和花中的表达量差异较大。品种‘六合黄心芹’不同组织中Agnp-G3PDH基因相对表达水平由高到低依次为根、茎、叶、花;其中,在根中的相对表达水平极显著高于茎、叶和花;在叶与花间的相对表达水平也有显著差异。品种‘津南实芹’不同组织中Agnp-G3PDH基因相对表达水平由高到低依次为叶、根、茎、花;其中,在茎和花间的相对表达水平无显著差异,在其他组织间的相对表达水平有极显著差异。品种‘文图拉’不同组织中Agnp-G3PDH基因相对表达水平由高到低依次为花、根、叶、茎,且在各组织中的相对表达水平均有极显著差异。

1. 品种‘津南实芹’ A. graveolens ‘Jinnan Shiqin’; 2. 品种‘六合黄心芹’ A. graveolens ‘Liuhe Huangxinqin’; 3. 品种‘文图拉’ A. graveolens ‘Ventura’; 4. 蒺藜苜蓿Medicago truncatula Gaertn.; 5. 毛果杨Populus trichocarpa Torr. & Gray; 6. 黄瓜Cucumis sativus Linn.; 7. 葡萄Vitis vinifera Linn.; 8. 可可Theobroma cacao Linn.; 9. 鹰嘴豆Cicer arietinum Linn.; 10. Solanum lycopersicum Linn.; 11. 二穗短柄草Brachypodium distachyum (Linn.) Beauv.; 12. 大豆Glycine max (Linn.) Merr.; 13. 节节麦 Aegilops tauschii Coss.; 14. 乌拉尔图小麦Triticum urartu Tum.
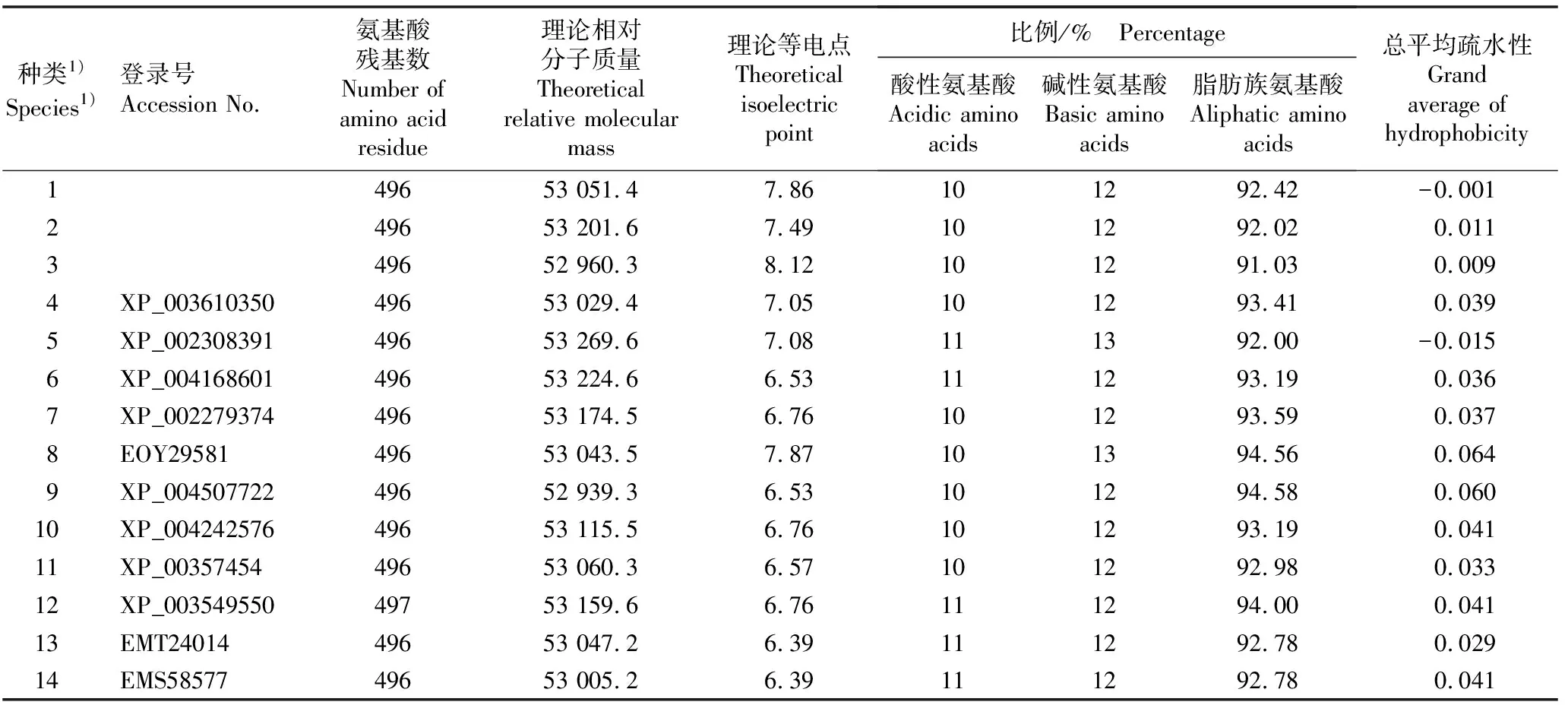
表1 3个芹菜品种Agnp-G3PDH基因编码的蛋白质与其他植物np-G3PDH蛋白的氨基酸组成及理化性质

图8 3个芹菜品种Agnp-G3PDH基因编码的氨基酸序列与其他植物np-G3PDH氨基酸序列的系统进化树

图中不同的大写和小写字母分别表示同一品种不同组织间差异极显著(P<0.01)和显著(P<0.05) The different capitals and small letters in the figure indicate the extremely significant (P<0.01)and significant (P<0.05) differences among different tissues of the same cultivar, respectively.
2.4.2 经不同胁迫处理后表达量的差异 经高温(38 ℃)、低温(4 ℃)、盐(0.2 mol·L-1NaCl)和干旱(20%PEG)胁迫处理后3个芹菜品种叶片中Agnp-G3PDH基因的相对表达水平见表2。由表2可见:经不同胁迫处理后3个芹菜品种Agnp-G3PDH基因的表达量有明显差异。经高温和低温处理后品种‘六合黄心芹’叶片中Agnp-G3PDH基因的相对表达水平均极显著高于对照,但经盐胁迫处理后其相对表达水平与对照差异不显著,而经干旱胁迫处理后其相对表达水平极显著低于对照。
经高温胁迫和干旱胁迫处理后品种‘津南实芹’叶片中Agnp-G3PDH基因的相对表达水平极显著高于对照,经盐胁迫处理后其相对表达水平显著高于对照,而经低温胁迫处理后其相对表达水平极显著低于对照。
经盐胁迫处理后品种‘文图拉’叶片中Agnp-G3PDH基因的相对表达水平与对照差异不显著,但经高温、低温及干旱胁迫处理后其相对表达水平均极显著低于对照。

表2 经不同胁迫处理后3个芹菜品种叶片中Agnp-G3PDH基因的相对表达水平比较
3 讨 论
研究结果表明:从芹菜品种 ‘六合黄心芹’、‘津南实芹’和‘文图拉’中分离得到的Agnp-G3PDH基因序列具有高度同源性,在芹菜中该基因进化非常保守,大部分基因位点突变属于同义突变。品种‘六合黄心芹’和‘文图拉’的Agnp-G3PDH基因编码的氨基酸序列同源性更高,表明供试3个芹菜品种中品种‘六合黄心芹’与‘文图拉’进化关系更为接近。3个芹菜品种Agnp-G3PDH基因编码的氨基酸序列与蒺藜苜蓿和毛果杨等其他11种植物的np-G3PDH氨基酸序列的同源性为93.81%,且3个芹菜品种Agnp-G3PDH基因编码的氨基酸序列与毛果杨的进化关系较近,葡萄科(Vitaceae)的葡萄与禾本科植物的进化关系较近,而属于葫芦科(Cucurbitaceae)的黄瓜与属于茄科(Solanaceae)的Solanumlycopersicum聚在同一个分支,表明np-G3PDH氨基酸序列的进化也是非常保守的,这可能与np-G3PDH参与糖酵解等能量代谢途径并生成光呼吸及甘露醇等生物合成过程所必需的还原剂NADPH的重要功能有关[15-16]。
供试3个芹菜品种中Agnp-G3PDH基因的表达差异较大,表现出明显的组织特异性,这可能与品种差异有关。经不同胁迫处理后3个芹菜品种Agnp-G3PDH基因的相对表达水平也有明显差异,其中,品种‘文图拉’Agnp-G3PDH基因的表达对胁迫处理的响应与另2个芹菜品种明显不同。在不同胁迫处理后品种‘文图拉’Agnp-G3PDH基因的相对表达水平与对照差异不显著或极显著低于对照,而品种‘六合黄心芹’在高温和低温胁迫处理后以及品种‘津南实芹’在高温和干旱胁迫处理后Agnp-G3PDH基因的相对表达水平均极显著高于对照。
Gao等[17]的研究结果表明:np-G3PDH的代谢与甘露糖-6-磷酸还原酶的表达水平有紧密联系,并且甘露醇合成的NADPH供给受np-G3PDH的严格控制。甘露醇参与植物体的抗逆代谢机制响应,如抗盐胁迫[18]、抗干旱胁迫、抗低温胁迫[19]和抗氧化胁迫[20]等,同时在调节植物生长发育及果实成熟等方面也具有重要作用[21]。推测np-G3PDH通过影响甘露醇代谢进而在植物体的生长发育及抗逆代谢机制中发挥作用。
参考文献:
[1] 卢 倩, 弭晓菊, 崔继哲. 植物甘油醛-3-磷酸脱氢酶作用机制的研究进展[J]. 生物技术通报, 2013(8): 1-6.
[2] 马凌波, 张凤英. 条斑紫菜细胞质甘油醛-3-磷酸脱氢酶的cDNA克隆和序列分析[J]. 海洋渔业, 2004, 26(4): 300-305.
[3] MARTIN W, BRINKMANN H, SAVONNA C, et al. Evidence for a chimeric nature of nuclear genomes: eubacterial origin of eukaryotic glyceraldehyde-3-phosphate dehydrogenase genes[J]. Proceedings of the National Academy of Sciences of the United States of America, 1993, 90(18): 8692-8696.
[4] VALVERDE F, ORTEGA J M, LOSADA M, et al. Sugar-mediated transcriptional regulation of the Gap gene system and concerted photosystem Ⅱ functional modulation in the microalgaScenedesmusvacuolatus[J]. Planta, 2005, 221(6): 937-952.
[5] HABENICHT A, HELLMAN U, CERFF R. Non-phosphorylating GAPDH of higher plants is a member of the aldehyde dehydrogenase superfamily with no sequence homology to phosphorylating GAPDH[J]. Journal of Molecular Biology, 1994, 237(1): 165-171.
[6] IGLESIAS A A, LOSADA M. Purification and kinetic and structural properties of spinach leaf NADP-dependent nonphosphorylating glyceraldehyde-3-phosphate dehydrogenase[J]. Archives of Bio-chemistry and Biophysics, 1988, 260(2): 830-840.
[7] IDDAR A, VALVERDE F, SERRANO A, et al. Expression, puri-fication, and characterization of recombinant nonphosphorylating NADP-dependent glyceraldehyde-3-phosphate dehydrogenase fromClostridiumacetobutylicum[J]. Protein Expression and Purification, 2002, 25(3): 519-526.
[8] BUSTOS D M, IGLESIAS A A. Non-phosphorylating glyceraldehyde-3-phosphate dehydrogenase is post-translationally phosphorylated in heterotrophic cells of wheat (Triticumaestivum)[J]. FEBS Letters, 2002, 530(1): 169-173.
[9] PIATTONI C V, RIUS S P, GOMEZ-CASATI D F, et al. Hetero-logous expression of non-phosphorylating glyceraldehyde-3-phosphate dehydrogenase fromTriticumaestivumandArabidopsisthaliana[J]. Biochimie, 2010, 92(7): 909-913.
[10] HABENICHT A, QUESADA A, CERFF R. Sequence of the non-phosphorylating glyceraldehyde-3-phosphate dehydrogenase fromNicotianaplumbaginifoliaand phylogenetic origin of the gene family[J]. Gene, 1997, 198(1/2): 237-243.
[11] 李梦瑶, 王 枫, 侯喜林, 等. 2个芹菜品种泛变应原Apig4基因的克隆与分析[J]. 植物资源与环境学报, 2013, 22(1): 1-7.
[12] TAMURA K, PETERSON D, PETERSON N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10): 2731-2739.
[13] TUSKAN G A, DIFAZIO S, JANSSON S, et al. The genome of black cottonwood,Populustrichocarpa(Torr. & Gray)[J]. Science, 2006, 313(5793): 1596-1604.
[14] LING H Q, ZHAO S C, LIU D C, et al. Draft genome of the wheat A-genome progenitorTriticumurartu[J]. Nature, 2013, 496(7443): 87-90.
[15] SCAGLIARINI S, TROST P, VALENTI V, et al. Glyceraldehyde 3-phosphate: NADP+reductase of spinach leaves steady state kinetics and effect of inhibitors[J]. Plant Physiology, 1990, 94(3): 1337-1344.
[16] TROST P, PUPILLO P. Inhibition of spinach D-glyceraldehyde 3-phosphate: NADP+oxidoreductase (nonphosphorylating) by adenylate compounds: the effect of dead-end inhibitors on a steady state random reaction mechanism[J]. Archives of Biochemistry and Biophysics, 1993, 306(1): 76-82.
[17] GAO Z F, LOESCHER W H. NADPH supply and mannitol bio-synthesis. Characterization, cloning, and regulation of the non-reversible glyceraldehyde-3-phosphate ehydrogenase in celery leaves[J]. Plant Physiology, 2000, 124(1): 321-330.
[18] 王慧中, 刘俊君, 卢德赵, 等. 1-磷酸甘露醇脱氢酶基因转化水稻的研究[J]. 中国水稻科学, 2003, 17(1): 6-10.
[19] CALMES B, GUILLEMETTE T, TEYSSIER L, et al. Role of mannitol metabolism in the pathogenicity of the necrotrophic fungusAlternariabrassicicola[J].Frontiers in PlantScience, 2013, 4: 1-18.
[20] VÉLЁZ H, GLASSBROOK N J, DAUB M E. Mannitol metabolism in the phytopathogenic fungusAlternariaalternata[J]. Fungal Genetics and Biology, 2007, 44(4): 258-268.
[21] STOOP J M H, WILLIAMSON J D, MASON PHARR D. Mannitol metabolism in plants: a method for coping with stress[J]. Trends in Plant Science, 1996, 1(5): 139-144.

