土壤Cd胁迫对三七生长和根系DNA损伤及抗氧化酶活性的影响
朱美霖, 魏富刚, 崔 斌, 陈中坚, 蒋艳雪, 曹红斌,①
(1. 北京师范大学: a. 中药资源保护与利用北京市重点实验室, b. 资源药物教育部工程研究中心, 北京100875;2. 苗乡三七科技有限公司, 云南 文山 663000)
三七〔Panaxnotoginseng(Burk.) F. H. Chen〕隶属于五加科 (Araliaceae) 人参属 (PanaxLinn.),根可入药,为中国出口的大宗药材之一。目前中药材应用领域和出口量日趋扩大,但世界各国对中药材质量的要求日趋增高,除对其农药残留的限制越来越严格外,还增加了Cd、Hg、Pb、Cu和 Cr等重金属元素的检测。中药三七主要产区为云南及广西的富Cd区[1],这些地区拥有大量Cd富集的铅锌矿床,有可能造成土壤Cd污染,也可能导致三七药材中Cd积累。冯江等[2]和韩小丽等[3]的研究结果均显示三七药材中存在Cd含量超标的状况。因此,研究土壤Cd污染对三七生长发育的影响对保障三七药材的品质有重要意义。目前,已有研究者对三七植株内Cd含量及残留量进行了分析[4-5];冯光泉等[6]比较了土壤及三七药材中重金属的含量;Yan等[7]还研究了三七对重金属As的耐性机制。但至今有关Cd污染对三七的毒害效应特别是分子水平的毒害效应尚未见研究报道。
Cd是植物生长的非必需元素,当植物体内的Cd积累到一定程度时,植物表现出毒害症状。在形态上主要表现为根和茎生长迟缓、叶面卷曲和黄叶病;而生理生化方面主要表现为光合作用和蒸腾作用受到抑制、体内酶活性受到影响、引起氧化应激反应和细胞膜损伤等一系列反应[8],导致抗氧化酶活性产生适应性变化。但Cd浓度较低时反而出现作物产量增加的情况[9-10],说明低浓度Cd对某些植物的生长发育有一定的促进作用。SOD(超氧化物歧化酶)、POD(过氧化物酶)和CAT(过氧化氢酶)是植物体内最重要的抗氧化酶,这些酶活性的改变可作为机体受到氧化胁迫的指标。此外,Cd胁迫可不同程度损伤植物细胞DNA,对植物的繁衍及子代健康造成伤害,甚至可以改变植物的进化过程,目前广泛采用彗星实验 (Comet assay)、通过对植物DNA损伤的评价确定污染物的毒理学[11-12]。
作者采用盆栽实验法,研究了不同程度土壤Cd胁迫对三七幼苗生长以及根系保护酶活性的影响,并采用彗星实验分析了Cd胁迫对三七根系细胞DNA的损伤效应,以期在宏观及微观水平上揭示土壤Cd污染对三七生长发育的影响,为三七药材的标准化种植提供数据支撑和理论依据。
1 材料和方法
1.1 材料
供试三七种苗由云南文山苗乡三七科技有限公司提供,栽植于该公司砚山实验基地。实验用土取自基地附近0~20 cm的表层土,理化性质为:pH 4.94,有机质含量27.40 g·kg-1,阳离子交换量19.27 mmol·kg-1,全磷含量0.21 mg·kg-1,速效磷含量117.95 mg·kg-1,粉粒141.9 g·kg-1,粘粒782.9 g·kg-1,砂粒75.1 g·kg-1,土壤Cd本底值0.45 mg·kg-1。
供试主要仪器包括ZM200 Pulverisette 14型高速旋转粉碎机/仪(德国Fritsch公司)、PHG-9030A型烘箱(上海精宏设备有限公司)、ST-60型自动消解仪(北京普利泰科仪器有限公司)和SPECTRO ARCOS EOP型ICP-AES(德国斯派克公司)等;彗星实验试剂盒由北京博乐通生物科技有限公司提供,其余试剂均为分析纯或优级纯。
1.2 方法
1.2.1 胁迫处理 于2012年1月进行Cd胁迫处理。用CdCl2·2.5H2O配制Cd处理液。将实验用土过0.5 cm尼龙筛,称取适量土壤,将Cd处理液喷洒至土壤中并搅拌均匀,使土壤中Cd添加量分别为0.0(对照)、 0.1、 0.3、 0.6、 1.0、 3.0、 6.0、 10.0和 30.0 mg·kg-1,土壤中Cd实际含量为添加量与本底量之和。将各处理土壤分别装入花盆中,每个花盆5 kg,每处理设4次重复。将生长健壮且生长状况相似的1年生三七种苗移栽至花盆中,每盆栽种3株,统一栽培管理。于2012年10月进行生长状况观察并采集根系样品供酶活性测定及DNA损伤检测。
1.2.2 生长状况观察及生长量测定 2012年10月,记录各处理三七植株的成活率和单株复叶数,并测量植株的株高、叶长和叶宽(用于单株叶面积计算),测量精度0.1 cm。用普通天平(精度0.01 g)分别称量三七单株根、茎和叶片的鲜质量;将新鲜根、茎和叶置于55 ℃处理72 h,冷却后分别称量单株根、茎和叶片干质量。
1.2.3 彗星实验 采集三七成熟植株根系,先将根尖取下,洗净后于4 ℃保存。取4 ℃保存的根尖,切成适当大小,采用机械法分离细胞核,使细胞核悬液密度为每个视野下20~40个[13],按照彗星实验试剂盒说明进行单细胞凝胶电泳和彗星图像分析。以彗尾长、尾部DNA相对含量(尾部DNA含量与总DNA含量的比值)和Olive尾矩 (尾部DNA含量与尾长的乘积) 作为彗星实验定量分析指标。
1.2.4 抗氧化酶活性测定 将去除根尖后的剩余根系洗净,4 ℃保存。取0.2 g根系样品置于预冷研钵中,加入预冷的50 mmol·L-1磷酸缓冲液 (pH 7.8)1.6 mL, 冰浴研磨至匀浆, 于4 ℃、 12 000g离心20 min,取上清液用于酶活性测定。参照文献[14],采用氮蓝四唑光化还原法测定SOD活性,采用愈创木酚法测定POD活性,采用过氧化氢法测定 CAT活性。
1.3 数据分析
2 结果和分析
2.1 土壤Cd胁迫对三七生长的影响
不同程度土壤Cd胁迫对三七植株成活率、株高、单株复叶数和单株叶面积的影响见表1;不同程度土壤Cd胁迫对三七单株根、茎和叶片鲜质量及干质量的影响见表2;在不同程度土壤Cd胁迫条件下种植10个月后三七植株的形态见图1。
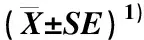
表1 土壤Cd胁迫对三七植株4个生长指标的影响
表1结果显示:与对照组相比,随土壤Cd添加量的增加,三七植株的成活率、株高、单株复叶数和单株叶面积均呈先升高后下降的变化趋势。在Cd胁迫条件下三七植株的成活率均高于对照,且在Cd添加量0.6、1.0和3.0 mg·kg-1条件下植株成活率较高(均超过80%),显著高于对照(P<0.05),而其余处理组的成活率均与对照无显著差异。在Cd添加量0.1~6.0 mg·kg-1条件下株高均高于对照,而在Cd添加量10.0和30.0 mg·kg-1条件下株高则均低于对照;其中,在Cd添加量0.3 mg·kg-1条件下株高最大(23.19 cm)且显著高于对照(P<0.05),其余处理组的株高与对照均无显著差异。各处理组的单株复叶数均多于对照,其中Cd添加量3.0 mg·kg-1处理组的单株复叶数最多(5.01片);在Cd添加量0.1、0.3、1.0和3.0 mg·kg-1条件下单株复叶数显著多于对照(P<0.05),其余处理组的单株复叶数与对照差异不显著。在Cd添加量0.1~3.0 mg·kg-1条件下三七植株的单株叶面积均高于对照、而在Cd添加量6.0、10.0和30.0 mg·kg-1条件下单株叶面积则低于对照,但各处理组的单株叶面积与对照均无显著差异;其中,在Cd添加量0.3 mg·kg-1条件下单株叶面积最大,达到16.39 cm2。
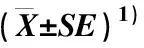
表2 土壤Cd胁迫对三七单株不同器官质量的影响

1-9: 土壤Cd添加量分别为 0.0(对照)、0.1、0.3、0.6、1.0、3.0、6.0、10.0和30.0 mg·kg-1 Adding amount of Cd in soil is 0.0 (CK), 0.1, 0.3,0.6, 1.0, 3.0, 6.0, 10.0 and 30.0 mg·kg-1, respectively.
表2结果显示:随土壤Cd添加量的增加,三七单株根、茎和叶的鲜质量及干质量均呈波动但总体上先升高后下降的变化趋势。三七单株根鲜质量和干质量、单株茎鲜质量和干质量、单株叶鲜质量和干质量的最大值分别出现在土壤Cd添加量0.3、1.0和1.0 mg·kg-1处理组, 其中仅单株根鲜质量和单株叶干质量的最大值与对照有显著差异(P<0.05),其余处理组的各项指标均与对照无显著差异。在土壤Cd添加量30 mg·kg-1条件下,单株根、茎和叶的鲜质量及干质量均小于对照但差异不显著。
从上述生长指标可见:在土壤Cd水平较低的条件下,三七的各项生长指标均高于对照,表明低水平Cd处理对三七生长有促进作用。从不同处理组植株的形态(图1)也可看出这一结果。
2.2 土壤Cd胁迫对三七根系DNA损伤的分析
在不同程度土壤Cd胁迫条件下种植10个月后三七根尖细胞DNA的彗星图像见图2;对照组与各处理组根尖细胞DNA损伤参数见表3。
由图2可以看出:没有受损的三七根尖细胞DNA呈现出圆形的荧光核心,而受损的DNA则出现彗星状拖尾。由表3可以看出:不同程度土壤Cd胁迫条件下三七根尖细胞DNA的损伤程度有一定差异,但各指标与对照均无显著差异。其中,彗尾长以1.0和6.0 mg·kg-1Cd处理组最长,平均值分别达到0.24和0.23 μm;10.0和30.0 mg·kg-1Cd处理组彗尾也较长,平均值分别达到0.18和0.19 μm,均明显高于对照(0.15 μm)。尾部DNA相对含量以6.0和10.0 mg·kg-1Cd处理组最高,平均值分别为14.16%和15.05%,均明显高于对照(12.98%)。Olive尾矩以6.0、 10.0和30.0 mg·kg-1Cd处理组最大,平均值分别为0.45、0.34和0.33,均明显高于对照(0.12)。说明在土壤Cd添加量较高的条件下(6.0、10.0和30.0 mg·kg-1Cd),Cd对三七根尖细胞的DNA损伤较为严重。
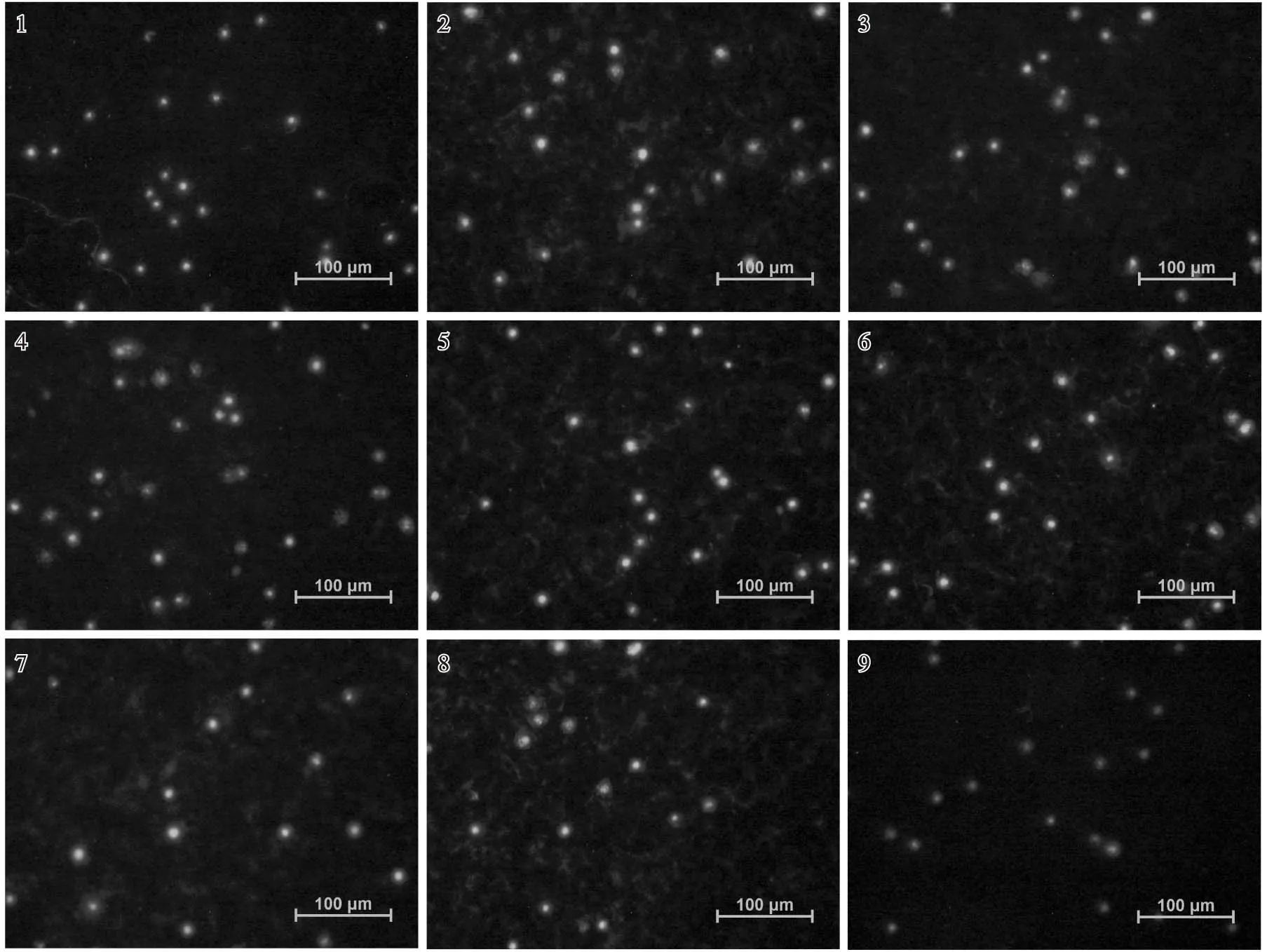
1-9: 土壤Cd添加量分别为 0.0(对照)、0.1、0.3、0.6、1.0、3.0、6.0、10.0和30.0 mg·kg-1 Adding amount of Cd in soil is 0.0 (CK), 0.1, 0.3,0.6, 1.0, 3.0, 6.0, 10.0 and 30.0 mg·kg-1, respectively.
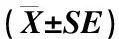
表3 土壤Cd胁迫条件下三七根尖细胞DNA损伤参数比较
2.3 土壤Cd胁迫对三七根系抗氧化酶活性的影响
经不同程度土壤Cd胁迫处理后三七根系SOD、POD和CAT活性的变化见表4。结果表明:随Cd添加量的提高,三七根系中SOD、POD和CAT活性均有明显变化,但变化趋势有差异。SOD活性呈现先上升后下降、然后再缓慢上升再下降的波动趋势,其中0.3 mg·kg-1Cd处理组的SOD活性显著(P<0.05)高于对照,而0.6、1.0、3.0和30.0 mg·kg-1Cd处理组的SOD活性极显著(P<0.01)或显著(P<0.05)低于对照。POD活性总体上随土壤Cd添加量的提高逐渐升高,仅0.1 mg·kg-1Cd处理组的POD活性低于对照,其余处理组的POD活性均高于对照;其中,1.0、3.0、6.0、10.0和30.0 mg·kg-1Cd处理组的POD活性与对照有极显著差异(P<0.01),以10.0 mg·kg-1Cd处理组的POD活性最高。CAT活性的变化趋势也呈先上升后略有下降、再上升再下降的波动趋势,各处理组的CAT活性均高于对照,其中,1.0、3.0、6.0、10.0和30.0 mg·kg-1处理组的CAT活性与对照有极显著差异(P<0.01),以6.0 mg·kg-1处理组的CAT活性最高。
实验结果表明:在 Cd添加量较低的条件下,三七根系中SOD、POD和CAT活性有所提高,但Cd添加量超过一定限制值,则抗氧化酶活性受到抑制。不同酶的Cd限制值不同,三七根系中SOD、POD和CAT活性的Cd限制值分别为0.3、10.0和6.0 mg·kg-1。
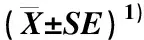
表4 土壤Cd胁迫对三七根系中SOD、 POD和CAT活性的影响
3 讨论和结论
实验结果表明:Cd对三七生长的抑制作用不是简单的毒害作用,而是在低浓度条件下促进其生长、在高浓度条件下抑制三七生长,而在其他植物中也有类似现象[15-18]。低浓度Cd胁迫能促进植物生长,其原因是低浓度Cd可提高或加速根系的某些生理生化反应,从而促进根系生长[19];也有研究者[20]认为低浓度Cd胁迫对根毛生长有一定的促进作用,从而增强植物对Cd的耐性。但根系的这种作用因植物种类不同而异。
通过彗星实验研究Cd胁迫条件下三七根尖DNA损伤,但通过肉眼观察并不能从各处理组的彗星图像中发现明显的拖尾现象,而且虽然某些Cd处理组的DNA损伤参数较高,但与对照无显著差异。分析其原因可能为:其一,其他研究者[21-22]是用Cd盐溶液直接处理植物组织,而本研究采用的胁迫方法是将Cd盐加入土壤中进行胁迫处理,由于土壤的缓冲性能[23-24]使Cd毒性明显减弱。其次,本研究采用机械法分离三七根尖细胞核,细胞核的分离效果可能不佳,从而影响彗星实验的结果,有待利用其他方法(如酶解法)进行进一步研究。第三,一些植物组织中含有某些特殊的化学成分,这些成分会增加凝胶的粘性进而阻碍DNA在电场中的迁移[25],但三七根尖中是否含有这类成分则需进一步研究。此外,不同植物种类及不同器官间彗星实验的结果也存在很大差异,如在Cd胁迫条件下,洋葱(AlliumcepaLinn.)[26]、蚕豆(ViciafabaLinn.)[22]及豌豆(PisumsativumLinn.)[27]的DNA损伤程度不同,而且Cd对豌豆根部DNA的损伤远大于其对叶片DNA的损伤[27]。这些因素均对彗星实验的结果有影响。
SOD、POD和CAT是清除植物体内活性氧的抗氧化酶,在逆境条件下通过抗氧化酶降低体内活性氧的积累,从而减轻逆境因子对机体的伤害。在Cd胁迫条件下,抗氧化酶活性也有类似的适应性作用,且这种作用与Cd胁迫水平有关[28-29]。本研究中,三七根系的SOD和CAT活性随Cd添加量的提高呈波动的变化趋势,在其他植物种类中也有类似现象。如Cd胁迫条件下狭叶香蒲(TyphaangustifoliaLinn.)叶片中SOD和POD活性随Cd浓度提高呈低浓度时上升、高浓度时下降的变化趋势[30];Al胁迫条件下小麦(TriticumaestivumLinn.)的SOD、CAT和POD活性随胁迫强度的增加而升高,重度胁迫下会有所下降[31]。其原因可能是:在低浓度胁迫条件下,植物体内的抗氧化酶系统受到诱导,其活性增强以清除过量的活性氧;而当胁迫水平持续增加时,植物体内的活性氧积累超过了抗氧化酶的清除能力,使植物细胞及组织功能受到影响,进而导致抗氧化酶活性降低[32]。抗氧化酶活性的变化是植物对Cd胁迫的耐性机制之一。而Yan等[7]的研究结果显示:随As胁迫水平的增加,三七的SOD和POD活性显著增加、CAT活性降低。这一结果与三七根系抗氧化酶活性对Cd胁迫的响应不同,说明三七对不同重金属胁迫的耐性不一致。
研究结果表明:较低水平的土壤Cd胁迫具有促进三七生长的作用、而较高水平的土壤Cd胁迫可抑制三七生长;Cd胁迫对三七根尖细胞DNA没有明显的损伤,但可导致三七根系SOD、POD和CAT活性不同程度变化。因此,对药材三七种植而言,不能仅仅依据Cd对三七生长的影响确立其土壤Cd安全浓度限值,还需要考虑Cd在三七药材中的富集状况和富集程度。有关三七药材中Cd的积累和富集机制则有待进一步的实验研究。
参考文献:
[1] 李 航, 朱长生, 谭显龙, 等. 云南金顶超大型铅锌矿床岩(矿)石中镉的分布及富集特征[J]. 矿物学报, 2007, 27(Z1): 381-382.
[2] 冯 江, 黄 鹏, 周建民. 100种中药材中有害元素铅 镉 砷的测定和意义[J]. 微量元素与健康研究, 2001, 18(2): 43-44.
[3] 韩小丽, 张小波, 郭兰萍, 等. 中药材重金属污染现状的统计分析[J]. 中国中药杂志, 2008, 33(18): 2041-2048.
[4] 郝南明, 田 洪, 苟 丽. 三七生长初期不同部位重金属元素含量测定[J]. 微量元素与健康研究, 2004, 21(5): 27-28, 31.
[5] 冯光泉, 刘云芝, 张文斌, 等. 三七植物体中重金属残留特征研究[J]. 中成药, 2006, 28(12): 1796-1798.
[6] 冯光泉, 张文斌, 陈中坚, 等. 三七及其栽培土壤中几种重金属元素含量的测定[J]. 中草药, 2003, 34(11): 1051-1054.
[7] YAN X L, LIN L Y, LIAO X Y, et al. Arsenic accumulation and resistance mechanism inPanaxnotoginseng, a traditional rare medicinal herb[J]. Chemosphere, 2012, 87(1): 31-36.
[9] 魏小凤. 污染元素镉对能源作物的生长影响[D]. 北京: 华北电力大学 (北京)环境工程学院, 2010.
[10] 张金彪, 黄维南. 镉对植物的生理生态效应的研究进展[J]. 生态学报, 2000, 20(3): 514-523.
[11] ROJAS E, LOPEZ M C, VALVERDE M. Single cell gel electro-phoresis assay: methodology and applications[J]. Journal of Chromatography B: Biomedical Sciences and Applications, 1999, 722(1/2): 225-254.
[12] TICE R R, AGURELL E, ANDERSON D, et al. Single cell gel/comet assay: guidelines forinvitroandinvivogenetic toxicology testing[J]. Environmental and Molecular Mutagenesis, 2000, 35(3): 206-221.
[13] 曹玉伟, 马 军, 郭长虹, 等. 植物彗星实验及其在生态毒理监测中的应用[J]. 生态毒理学报, 2009, 4(2): 183-189.
[14] 杨 光, 钱 丹, 郭兰萍, 等. 重金属对膜荚黄芪种子生长及抗氧化系统的影响[J]. 中国中药杂志, 2010, 35(9): 1095-1099.
[15] 何俊瑜, 任艳芳, 王阳阳, 等. 不同耐性水稻幼苗根系对镉胁迫的形态及生理响应[J]. 生态学报, 2011, 31(2): 522-528.
[16] 张 玲, 李俊梅, 王焕校. 镉胁迫下小麦根系的生理生态变化[J]. 土壤通报, 2002, 33(1): 61-65.
[17] 于方明, 仇荣亮, 汤叶涛, 等. Cd对小白菜生长及氮素代谢的影响研究[J]. 环境科学, 2008, 29(2): 506-511.
[18] 任艳芳, 何俊瑜, 刘 畅, 等. 镉胁迫对莴苣幼苗生长及抗氧化酶系统的影响[J]. 生态环境学报, 2009, 18(2): 494-497.
[19] 段昌群, 王焕校, 曲仲湘. 重金属对蚕豆(Viciafaba)根尖的核酸含量及核酸酶活性影响的研究[J]. 环境科学, 1992, 13(5): 31-35.
[20] 仇 硕, 黄苏珍. Cd胁迫下黄菖蒲幼苗根系生长与Cd积累的研究[J]. 植物资源与环境学报, 2008, 17(3): 33-38.
[21] 聂志刚, 王 艳, 李韶山. 重金属诱导拟南芥原生质体DNA损伤的单细胞凝胶电泳检测[J]. 植物学报, 2009, 44(1): 117-123.
[22] 张旭红, 林爱军, 苏玉红, 等. 镉引起蚕豆(Viciafaba)叶片DNA损伤和细胞凋亡研究[J]. 环境科学, 2006, 27(4): 787-793.
[23] 林玉锁. 土壤对重金属缓冲性能的研究[J]. 环境科学学报, 1995, 15(3): 289-294.
[24] 符娟林, 章明奎, 黄昌勇. 用分级方法评估土壤对重金属的缓冲能力[J]. 环境科学研究, 2006, 19(3): 109-113.
[25] DELINCÉE H, SOIKA C. Improvement of the ESR detection of irradiated food containing cellulose employing a simple extraction method[J].Radiation Physics and Chemistry,2002, 63(3): 437-441.
[26] SETH C S, MISRA V, CHAUHAN L K, et al. Genotoxicity of cadmium on root meristem cells ofAlliumcepa: cytogenetic and Comet assay approach[J]. Ecotoxicology and Environmental Safety, 2008, 71(3): 711-716.
[27] HATTAB S, CHOUBA L, BEN KHEDER M, et al. Cadmium- and copper-induced DNA damage inPisumsativumroots and leaves as determined by the Comet assay[J]. Plant Biosystems, 2009, 143(S1): S6-S11.
[28] 刘可慧, 于方明, 李明顺, 等. 镉胁迫对小白菜(BrassicacampestrisL.)抗氧化机理的影响[J]. 生态环境, 2008, 17(4): 1466-1470.
[29] 段云青, 王 艳, 雷焕贵. 镉胁迫对小白菜POD、PPO和SOD活性的影响[J]. 河南农业科学, 2006(7): 88-91.
[30] 吴晓丽, 罗玉明, 徐迎春, 等. 镉胁迫对狭叶香蒲某些生理指标的影响[J]. 植物资源与环境学报, 2007, 16(1): 74-78.
[31] 彭 艳, 李 洋, 杨广笑, 等. 铝胁迫对不同小麦SOD、CAT、POD活性和MDA含量的影响[J]. 生物技术, 2006, 16(3): 38-42.
[32] 尹永强, 胡建斌, 邓明军. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J]. 中国农学通报, 2007, 23(1): 105-110.

