ALDH2基因多态性与乙醇代谢及外周乙醛积蓄程度的关系
熊卉,王薇,叶懿,颜有仪,肖敏,阮若云,廖林川
(四川大学华西基础医学与法医学院,四川成都610041)
乙醇,俗称酒精。饮酒后,乙醇通过胃肠道完全吸收入血,乙醛是乙醇在体内氧化代谢的第一代谢产物,代谢过程涉及多个器官和酶系统。乙醛主要被乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)进一步代谢为乙酸,并最终氧化成二氧化碳和水排出体外[1-2]。ALDH是乙醇在人体代谢过程中的关键酶,已被证实有12种不同基因编码的同工酶,而ALDH2是唯一存在于线粒体内,且与黄种人的饮酒行为密切相关的酶[3]。ALDH2具有高度遗传多态性,其编码的基因存在变异,随编码基因的不同,酶活性不同。
本实验采用灵敏、可靠的顶空气相色谱法,同时测定血中乙醇及乙醛浓度,并得到一系列药代动力学数据,初步考察ALDH2基因多态性与乙醇代谢及乙醛外周积蓄的相关性,为完善乙醇药代动力学规律提供基础数据。
1 材料与方法
1.1 实验对象
收集无血缘关系志愿者14名,男性7名,女性7名,随机编号为A~N,常规体检及生化检验结果证明肝肾功能均正常,无精神病史,常见镇静催眠药和毒品尿检板筛查均呈阴性。志愿者于受试前3d内未饮酒,实验期间未服用药物。
1.2 主要仪器与试剂
9700型PCR扩增仪(美国AB公司),CP-3800气相色谱仪(美国Varian公司),DANI HSS 86.50自动顶空进样仪(意大利DANI公司),Thermo Scientific Sorvall ST16R通用台式离心机(美国Thermo Fisher Scientific公司)。
乙醛标准品(上海安谱科学仪器有限公司,批号1075400),乙醇标准品(美国Ceriliant公司),正丙醇(分析纯,成都科龙化工试剂厂),正丁醇(分析纯,北京化工厂),70%高氯酸(分析纯,天津东方化工厂),去离子水经优普纯水系统制备。
1.3 色谱条件
色谱柱:PEG-20M气相色谱柱(50 m×0.53 mm,2 μm,美国安捷伦科技公司);恒温箱温度:65℃;恒温时间:10 min;进样间隔:12 min;程序升温:初始温度50℃,保持1.5min,然后以35℃/min升温到85℃,保持4.5 min;进样口温度:120℃;FID检测器温度:200℃;载气:N2。
1.4 标准溶液配制
乙醛储备液:称取乙醛标准品(98.9%)0.1047g,用新沸后冷却至4℃的超纯水定容至100 mL,得1.035×103μg/mL乙醛储备液,4℃冰箱储存待用。
乙醇储备液:取2 mL乙醇标准品(99.5%),用新沸后冷却至室温的超纯水定容至50 mL,得3.141×104μg/mL乙醇储备液,4℃冰箱储存待用。
高氯酸(PCA)溶液:取氯化钠4.250 7 g,硫脲0.380 7 g,乙二胺四乙酸二钠0.093 2 g,70%高氯酸28mL,超纯水稀释1000倍后的正丙醇0.8 mL,超纯水稀释100倍后的正丁醇2 mL,用煮沸过的超纯水溶解定容至500mL,4℃冰箱储存待用。
1.5 ALDH2基因型检测
采集志愿者空白静脉血1 mL,经过盐析法提取DNA,根据文献[4]的方法,采用预设好的程序对ALDH2目的片段进行PCR扩增,扩增完成后,用限制性内切酶MboⅡ进行酶切,37℃水浴4h。采用6%非变性聚丙烯酰胺凝胶电泳,经银染后观察结果,以20 bp DNA Marker分子量标准物来确定酶切产物的位置。
1.6 饮酒剂量与血样采集
给予志愿者按0.64 g/kg乙醇剂量啤酒[5],30 min内佐以零食(花生和红薯条)饮完。饮酒前采集空白血样1mL。从饮酒第一口计,于30min、45min、1h、1.5h、2h、3h、4h、5h和6h时间点,通过静脉留置针从肘静脉采血1mL,置于4℃冰箱保存,6h内处理待检。
1.7 样品预处理
取血液0.5 mL置于提前预冷的塑料离心管中,加入1 mL PCA溶液,涡旋5 s,在0℃下以离心半径10 cm,8000r/min,离心5min后,取1mL上清液转移至20mL顶空瓶中,立即盖上硅橡胶垫、铝帽,用密封钳密封后进样分析。乙醛沸点约为20℃,为避免乙醛挥发,操作全过程均在冰盒内进行。
2 结果与讨论
2.1 分析方法的选择
有实验[6]采用Porapak填充柱的乙醇及其代谢物的顶空气相色谱测定法,而本实验采用PEG毛细管色谱柱及自动顶空进样仪,考察了色谱分离条件。
本实验考察了恒温温度为55℃、65℃、75℃、85℃的乙醛和乙醇峰面积,结果显示,随温度的升高,乙醛和乙醇的峰面积也增加(表1),因此在满足灵敏度的情况下,避免较高温度下血液中挥发性较强的物质进入色谱系统造成干扰,选择65℃为恒温温度。

表1 不同恒温温度下乙醛和乙醇的峰面积
另外,本实验还考察了恒温时间为10、20、30min时的乙醛和乙醇峰面积,结果显示,随时间的延长,乙醛和乙醇的峰面积均变化不大(表2),因此选择恒温时间为10min。

表2 不同恒温时间乙醛和乙醇的峰面积
对于乙醛和乙醇内标的选择,本实验考察了叔丁醇、异丙醇、正丙醇和正丁醇,在选定前处理和色谱条件的情况下,四者出峰时间依次分别为2.249、2.453、3.435、4.844min,乙醛和乙醇的出峰时间分别为1.337、2.549min,异丙醇与乙醇有重叠,而叔丁醇多次进样显示峰面积不稳定,因此选择正丙醇为乙醛的内标,正丁醇为乙醇的内标。
2.2 分析方法适用性评价
在选定的色谱条件下,乙醛、乙醇和内标对照品溶液、空白血样和饮酒1 h后血样结果显示,乙醛和乙醇与相关物质能完全分离,峰形良好,内源性物质不干扰测定。取高、中、低3个质量浓度(乙醇为783.54、197.91、47.120μg/mL,乙醛为5.1772、1.0355、0.1035μg/mL)添加样品各3份,按1.7项处理样品后分别于当日和不同日内检测,乙醛和乙醇方法回收率分别为96.1%~114.1%和90.2%~100.3%;乙醛和乙醇日内精密度分别小于5.5%和1.8%,日间精密度分别小于6.7%和2.8%。取高、中、低3个质量浓度添加样品分别于4℃放置0、2、6h后,按1.7项处理样品,分析结果表明,样品存放于4℃冰箱中放置6h内稳定,精密度小于5.8%。
2.3 ALDH2分型结果及分组
根据电泳结果,14名志愿者ALDH2基因型分型,分为突变组9名(A、B、C、D、E、H、I、J、N)和野生组5名(F、G、K、L、M),基因型分别为突变杂合型ALDH2*1/*2和野生纯合型ALDH2*1/*1。14名志愿者中,未见基因型ALDH2*2/*2。其中4例女性志愿者(A、B、C、E)在实验中出现呕吐症状,退出实验。
2.4 血中乙醛、乙醇标准曲线
取适量乙醛和乙醇储备液,分别用煮沸过的超纯水配制成系列梯度质量浓度,各取50μL加入0.4mL空白血液中,得乙醛质量浓度为0、0.051772、0.10355、0.517 72、1.035 5、2.071 0、5.177 2 μg/mL和乙醇质量浓度为0、47.120、100.53、197.91、392.68、783.54、1570.7μg/mL的添加血样。按1.7项处理,并进行色谱分析,记录乙醛峰面积A1,正丙醇峰面积A2,乙醇峰面积A3,正丁醇峰面积A4。以乙醛质量浓度x1(μg/mL)对乙醛和正丙醇峰面积之比y1(A1/A2)进行线性回归,得回归方程y1=1.3039x1-0.0188,决定系数R2=0.9993;以乙醇质量浓度x2(μg/mL)对乙醇和正丁醇峰面积之比y2(A3/A4)进行线性回归,得回归方程y2=0.0060x2+0.0216,决定系数R2=0.9993。每批次进样前,同上述方法建立随行标曲,决定系数R2均大于0.990。
2.5 饮酒后药代动力学结果
本实验检测了10名志愿者饮用同种、同剂量啤酒后,于相同时间点采集的血液样本中乙醛和乙醇的浓度,描绘药时曲线,利用DAS 3.1.6软件的非房室模型统计矩法得到乙醇药代动力学参数(表3),并计算乙醛药时曲线下面积(AUC),见表4。不同个体之间的乙醇药代动力学参数存在差异,乙醇峰浓度(Cmax)范围在557.9~951.2 μg/mL,达峰时间(tmax)范围在0.8~2.0h,AUC(0-t)范围在1881.9~3604.7mg·L-1·h,平均驻留时间MRT(0-t)范围在2.0~2.8 h,末端消除半衰期(t1/2z)范围在0.5~2.6 h,经生物利用度校正的表观分布容积(V/F)和表观清除率(CL/F)的范围分别在0.2~0.5L/kg和0.1~0.3L·h-1·kg-1。此外,乙醛AUC(0-t)范围在1.312~6.642mg·L-1·h。

表3 乙醇药代动力学参数
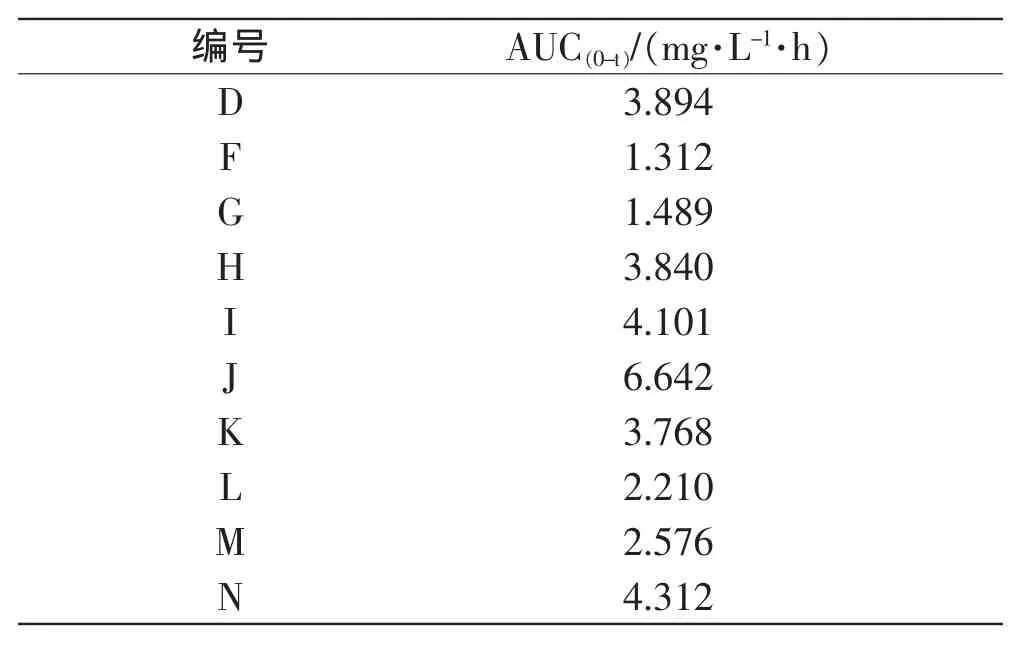
表4 乙醛药时曲线下面积
2.6 ALDH2基因型与乙醇代谢相关性
野生组ALDH2*1/*1(志愿者F、G、K、L、M)和突变组ALDH2*1/*2(志愿者D、H、I、J、N)个体,饮酒后乙醛和乙醇药时曲线图见图1~2。
利用SPSS 19.0软件对两组血液中乙醇药代动力学参数和乙醛AUC进行Mann-Whitney U检验(非参数检验),P<0.05时,差异具有统计学意义。结果显示,野生组和突变组乙醇Cmax、tmax、MRT(0-t)以及V/F值比较,差异无统计学意义(P>0.05);突变组AUC乙醇、AUC乙醛以及t1/2z值均大于野生组,CL/F值小于野生组(P<0.05),详见表5。
2.7 性别、体质量与乙醇代谢的相关性
对男性组(志愿者D、F、H、I、K、L、M)和女性组(志愿者G、J、N)个体血液中乙醇药代动力学参数和乙醛AUC进行Mann-Whitney U检验(非参数检验),结果显示,两组间差异无统计学意义(P>0.05),详见表6。
根据所有志愿者体质量均值(65 kg),将志愿者分为两组,对体质量≥65kg(志愿者D、F、I、J、K)和体质量<65kg(志愿者G、H、L、M、N)个体血液中乙醇药代动力学参数和乙醛AUC进行Mann-Whitney U检验(非参数检验),结果显示,两组数据差异无统计学意义(P>0.05),详见表7。仅以性别或体质量分组考察其与乙醇代谢的相关性,结果差异均无统计学意义,推测可能为样本量少,且性别或体质量单一变量对乙醇代谢影响较小。同时也反映出ALDH2基因型对乙醛和乙醇代谢具有决定性的作用。

图1 野生组和突变组乙醛药时曲线

图2 野生组和突变组乙醇药时曲线
表5 野生组和突变组血液中乙醇药代动力学参数和乙醛药时曲线下面积比较(±s)

表5 野生组和突变组血液中乙醇药代动力学参数和乙醛药时曲线下面积比较(±s)
注:1)与野生组比较,P<0.05
组别Cmax/(μg/mL)tmax/hAUC乙醇/(mg·L-1·h)MRT(0-t)/ht1/2z/hV/F/(L/kg)CL/F/(L·h-1·kg-1)AUC乙醛/(mg·L-1·h)野生(n=5)688.0±160.0 1.6±0.52137.5±256.32.3±0.30.6±0.20.3±0.10.3±0.02.3±1.0突变(n=5)734.4±87.91.3±0.42814.7±511.51)2.6±0.21.5±0.71)0.4±0.10.2±0.01)4.6±1.21)
表6 男性和女性乙醇药代动力学参数和乙醛药时曲线下面积比较(±s)

表6 男性和女性乙醇药代动力学参数和乙醛药时曲线下面积比较(±s)
性别Cmax/(μg/mL)tmax/hAUC乙醇/(mg·L-1·h)MRT(0-t)/ht1/2z/hV/F/(L/kg)CL/F/(L·h-1·kg-1)AUC乙醛/(mg·L-1·h)男性(n=7)668.3±88.61.5±0.42299.6±399.62.4±0.20.9±0.40.3±0.10.3±0.13.1±1.1女性(n=3)811.2±156.2 1.3±0.72887.9±620.72.5±0.41.5±1.10.4±0.20.2±0.14.1±2.6
表7 体质量≥65kg和<65kg者乙醇药代动力学参数和乙醛药时曲线下面积比较(±s)

表7 体质量≥65kg和<65kg者乙醇药代动力学参数和乙醛药时曲线下面积比较(±s)
体质量/kg Cmax/(μg/mL)tmax/hAUC乙醇/(mg·L-1·h)MRT(0-t)/ht1/2z/hV/F/(L/kg)CL/F/(L·h-1·kg-1)AUC乙醛/(mg·L-1·h)≥65(n=5)704.8±169.2 1.6±0.62433.0±412.72.5±0.3 1.0±0.50.3±0.10.3±0.12.9±1.2<65(n=5)717.6±77.31.3±0.32519.2±662.52.4±0.3 1.1±0.90.3±0.10.3±0.13.9±1.9
ALDH2是公认的乙醇体内代谢途径的关键酶,其编码的基因存在变异,基因型不同,编码的同种异型酶活性不同,从而影响乙醇及其代谢产物乙醛在人体的代谢动力学及其作用效果,进而影响饮酒后的行为。
ALDH2*1/*2突变组由于ALDH2酶活性较低,代谢乙醛速率较慢,外周乙醛大量蓄积,AUC大于野生组(P<0.05);而积聚的乙醛对于乙醇氧化反应有产物抑制作用,减缓了其代谢速率,使得血中乙醇的CL/F降低,t1/2z延长。与乙醇吸收和分布有关的乙醇药代动力学参数如Cmax、tmax、MRT(0-t)以及V/F等,两组间差异无统计学意义,可能原因为ALDH2只是乙醛氧化成乙酸这一步骤中的关键酶,即乙醇代谢途径中的关键酶[7],只在乙醇的代谢过程中起重要作用,而对于代谢之前的吸收和分布基本无影响。
综上,本研究通过建立顶空气相色谱法同时测定血液中乙醇及乙醛,对ALDH2基因型与乙醇代谢及乙醛外周积蓄的关系进行了初步研究,为进一步研究乙醇代谢提供了基础。
[1]Lieber CS.The discovery of the microsomal ethanol oxidizing systemand its physiologic and pathologic role[J].Drug Metab Rev,2004,36(3-4):511-529.
[2]Deng XS,Deitrich RA.Putative role of brain acetaldehyde in ethanol addiction[J].Curr Drug Abuse Rev,2008,1(1):3-8.
[3]Li TK,Yin SJ,Crabb DW,et al.Genetic and environmental influences on alcohol metabolism in humans[J].Alcoholism:Clinical and Experimental Research,2001,25(1):136-144.
[4]Harada S,Zhang S.New strategy for detection of ALDH2 mutant[J].Alcohol Alcohol,1993,28(S1A):11-13.
[5]Reed TE,Kalant H,Gibbins RJ,et al.Alcohol and acetaldehyde metabolism in Caucasians,Chinese and Amerinds[J].Can Med Assoc J,1976,115(9):851-855.
[6]吴何坚,沈敏,沈彦,等.血中乙醇及其代谢物乙醛、乙酸的顶空气相色谱法测定[J].法医学杂志,1993,9(4):151-153.
[7]哈斯图雅,毕力夫,苏秀兰.乙醛脱氢酶2(ALDH2)基因研究进展[J].中国优生与遗传杂志,2007,15(5):3-4,34.

